Содержание
- 2. ОРГАНИЧЕСКАЯ ХИМИЯ Изучает соединения углерода, их строение, способы получения и практического использования. Углерод, водород, кислород, азот,
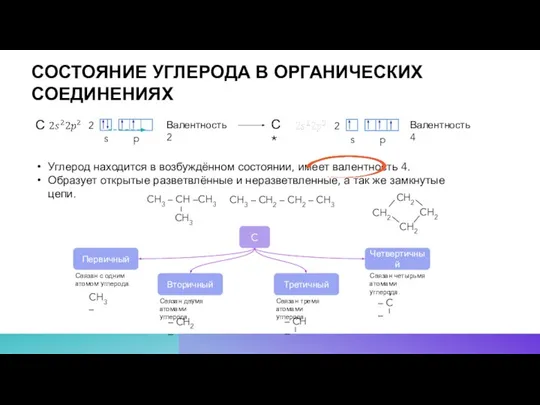
- 3. СОСТОЯНИЕ УГЛЕРОДА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ С С* Валентность 2 Валентность 4 Углерод находится в возбуждённом состоянии,
- 4. ТЕОРИЯ БУТЛЕРОВА (1869 Г.) Александр Михайлович Бутлеров 1828—1886 Атомы в молекуле соединены друг с другом в
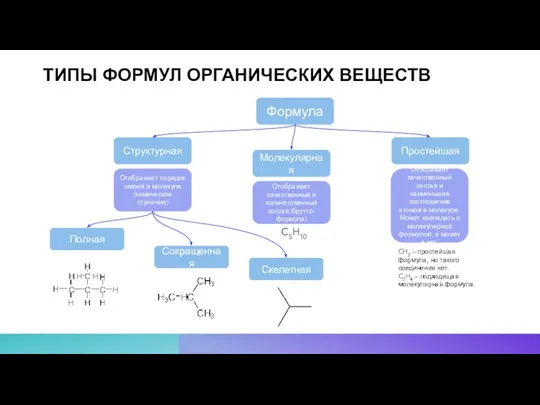
- 5. ТИПЫ ФОРМУЛ ОРГАНИЧЕСКИХ ВЕЩЕСТВ Формула Структурная Молекулярная Простейшая Отображает порядок связей в молекуле (химические строение) Отображает
- 6. Изомеры – соединения с одинаковой молекулярной формулой, но разной структурной: Гомологи – вещества одного класса, схожие
- 7. ТИПЫ ИЗОМЕРИИ Изомерия Структурная Пространственная Углеродной цепи Межклассовая Положения кратной связи (= и ≡) Положения функциональной
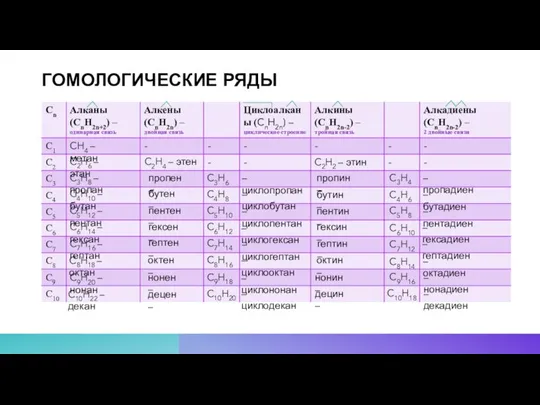
- 8. ГОМОЛОГИЧЕСКИЕ РЯДЫ CH4 – метан C2H6 – этан C3H8 – пропан C4H10 – бутан C5H12 –
- 9. НАЗВАНИЯ РАДИКАЛОВ И ЗАМЕСТИТЕЛЕЙ Алкильные радикалы: -CH3 метил -C2H5 этил -C3H7 пропил: CH3 – CH2 –
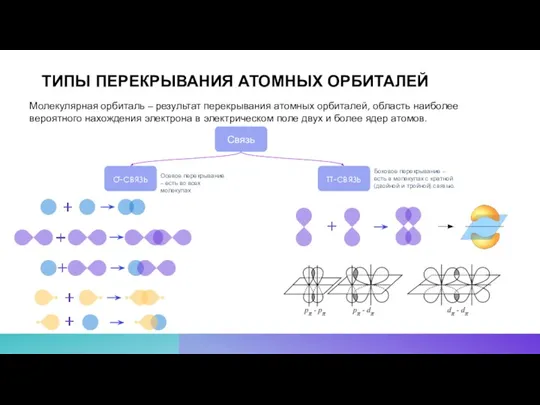
- 10. ТИПЫ ПЕРЕКРЫВАНИЯ АТОМНЫХ ОРБИТАЛЕЙ Молекулярная орбиталь – результат перекрывания атомных орбиталей, область наиболее вероятного нахождения электрона
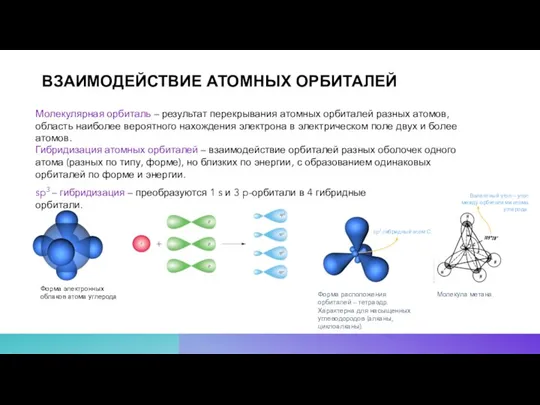
- 11. ВЗАИМОДЕЙСТВИЕ АТОМНЫХ ОРБИТАЛЕЙ Форма электронных облаков атома углерода Гибридизация атомных орбиталей – взаимодействие орбиталей разных оболочек
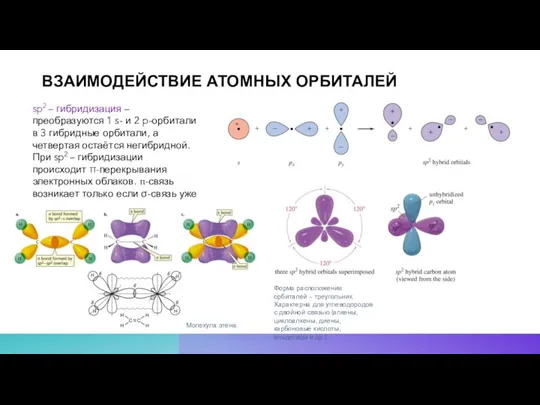
- 12. ВЗАИМОДЕЙСТВИЕ АТОМНЫХ ОРБИТАЛЕЙ sp2 – гибридизация – преобразуются 1 s- и 2 p-орбитали в 3 гибридные
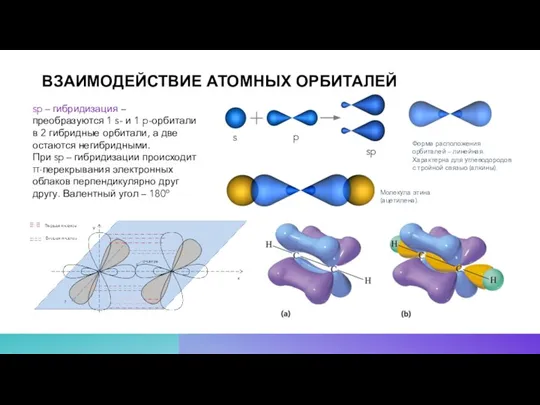
- 13. ВЗАИМОДЕЙСТВИЕ АТОМНЫХ ОРБИТАЛЕЙ sp – гибридизация – преобразуются 1 s- и 1 p-орбитали в 2 гибридные
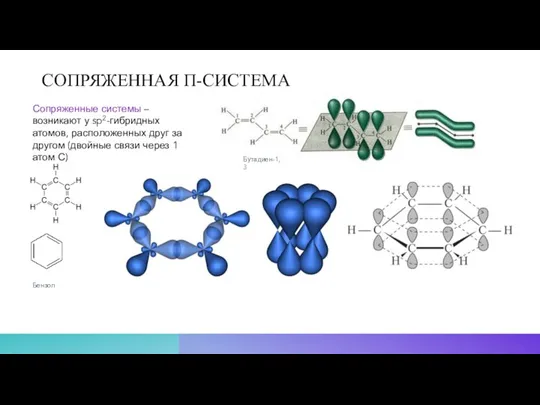
- 14. СОПРЯЖЕННАЯ Π-СИСТЕМА Сопряженные системы – возникают у sp2-гибридных атомов, расположенных друг за другом (двойные связи через
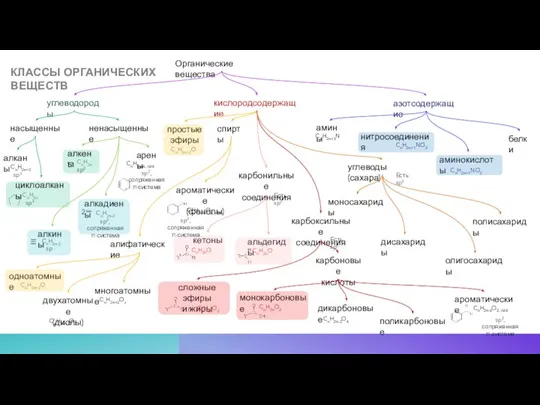
- 15. КЛАССЫ ОРГАНИЧЕСКИХ ВЕЩЕСТВ Органические вещества углеводороды насыщенные ненасыщенные алканы циклоалканы алкены алкины алкадиены арены кислородсодержащие спирты
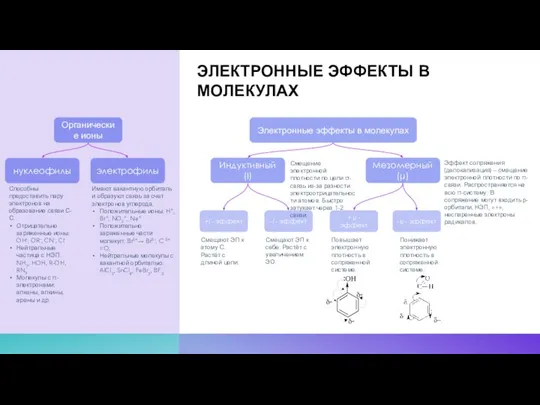
- 16. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В МОЛЕКУЛАХ Органические ионы электрофилы нуклеофилы Способны предоставить пару электронов на образование связи С-С.
- 17. ЭЛЕКТРОНОДОНОРНЫЕ И ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ Знаки М и I- эффектов у одного заместителя могут не совпадать. Донор
- 18. МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ Радикальные реакции идут с участием свободных радикалов. Нуклеофильные реакции – новая ковалентная связь
- 19. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- 24. Скачать презентацию











 СТРОИТЕЛЬНЫЙ КЛАСТЕР ХАБАРОВСКОГО КРАЯ
СТРОИТЕЛЬНЫЙ КЛАСТЕР ХАБАРОВСКОГО КРАЯ f79a28ec771a810189e5224e59bf9a4d
f79a28ec771a810189e5224e59bf9a4d Военные триумфы
Военные триумфы Культивирование клеток
Культивирование клеток Планирование самостоятельной работы студентов в условиях бакалавриата и ее роль в достижении общих компетенций
Планирование самостоятельной работы студентов в условиях бакалавриата и ее роль в достижении общих компетенций Ты-сама жизнь!
Ты-сама жизнь! ADSL оборудование D-Link
ADSL оборудование D-Link  Коммерческое предложение Улучшение качества связи
Коммерческое предложение Улучшение качества связи По стране Сказок
По стране Сказок International taxation Introduction
International taxation Introduction  Право + Защита прав людей, живущих с ВИЧ
Право + Защита прав людей, живущих с ВИЧ С днём защитника Отечества!!!
С днём защитника Отечества!!! Международные корпорации как фактор глобализации международных экономических отношений
Международные корпорации как фактор глобализации международных экономических отношений Пушкин в лицее
Пушкин в лицее Высшая нервная деятельность
Высшая нервная деятельность Вручение медалей ветеранам Великой Отечественной войны Встреча вторая.
Вручение медалей ветеранам Великой Отечественной войны Встреча вторая. ИСТОРИЯ ТЕЛА В СРЕДНИЕ ВЕКА Жак Ле Гофф Николя Трюон Бабынина
ИСТОРИЯ ТЕЛА В СРЕДНИЕ ВЕКА Жак Ле Гофф Николя Трюон Бабынина  Презентация на тему Модульные изделия
Презентация на тему Модульные изделия Звёздное небо (2 класс)
Звёздное небо (2 класс) Нижегородская акдемия МВД
Нижегородская акдемия МВД Статика
Статика Игра с рифмами
Игра с рифмами Восточный базар
Восточный базар ОБЗОР РАСПРОСТРАНЕННЫХ ТЕСТОВ ЗАВИСИМОСТЬ И НЕЗАВИСИМОСТЬ ВЫБОРОК (НЕ-)
ОБЗОР РАСПРОСТРАНЕННЫХ ТЕСТОВ ЗАВИСИМОСТЬ И НЕЗАВИСИМОСТЬ ВЫБОРОК (НЕ-) Российский совет олимпиад школьников Совещание организаторов олимпиад школьников При содействии Московского государственно
Российский совет олимпиад школьников Совещание организаторов олимпиад школьников При содействии Московского государственно Технология изготовления сувениров из текстильных материалов. 8 класс
Технология изготовления сувениров из текстильных материалов. 8 класс Материки и части света
Материки и части света Квадратные неравенства
Квадратные неравенства