Содержание
- 2. Учебная цель: изучить способы получения, химические свойства и применение алкенов на примере непредельного углеводорода - этилена
- 3. Эпиграф к уроку «Границ научному познанию и предсказанию предвидеть невозможно» Д.И.Менделеев
- 4. Лист самоанализа учебной деятельности учащегося ___________ по теме «Получение, химические свойства и применение алкенов»
- 5. Ответьте, пожалуйста, на следующие вопросы: Какие углеводороды называются алкенами? Какова общая формула алкенов? Какова структурная формула
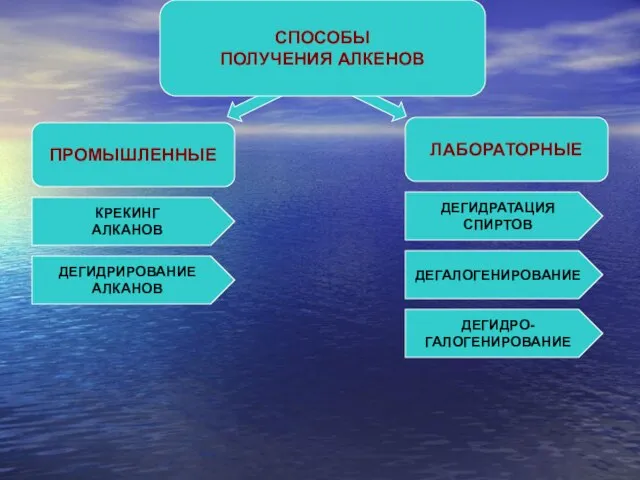
- 6. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
- 7. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ
- 8. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
- 9. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
- 10. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 +
- 11. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
- 12. Типы химических реакций, которые характерны для алкенов Реакции присоединения. Реакции полимеризации. Реакции окисления.
- 13. Реакции присоединения 1. Гидрирование. CН2 = СН2 + Н2 СН3 – СН3 Этен этан Условия реакции:
- 14. Электрофильное присоединение Молекула галогена не имеет собственного диполя, однако в близи π-электронов происходит поляризация ковалентной связи,
- 15. Реакции присоединения 3. Гидрогалогенирование. 1 2 3 4 1 2 3 4 СН2 = СН –
- 16. Гидрогалогенирование гомологов этилена Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной
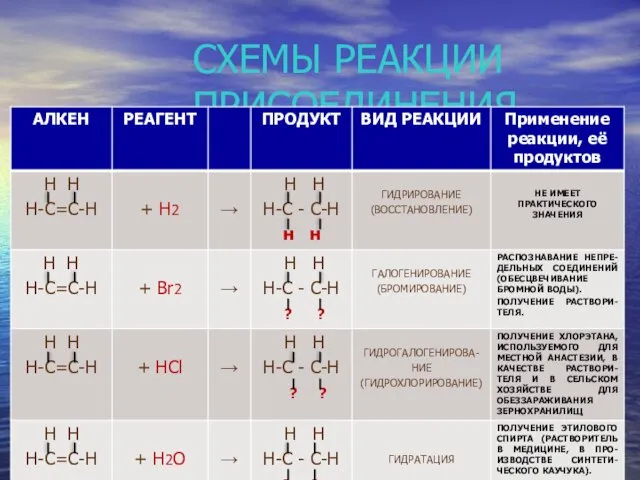
- 17. СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 18. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
- 19. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] +
- 20. 1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера): KMnO4
- 21. РЕАКЦИИ ОКИСЛЕНИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2С2Н6 + 7О2 4СО2 + 6Н2О
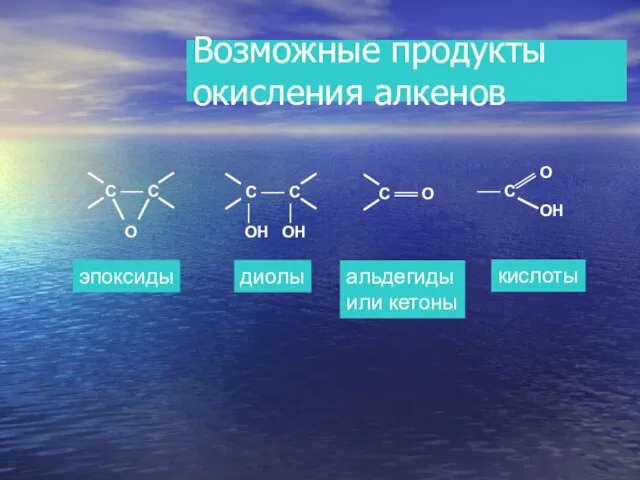
- 22. Возможные продукты окисления алкенов эпоксиды диолы альдегиды или кетоны кислоты
- 23. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
- 24. Реакции полимеризации (свободно-радикальное присоединение) Полимеризация – это последовательное соединение одинаковых молекул в более крупные. σ σ
- 25. Применение этилена
- 27. Практическая работа Получение и изучение свойств этилена. Цель работы: получить этилен и провести опыты, характеризующие его
- 28. Рис. 1 Получение этилена и изучение его свойств.
- 29. Интересно… Великое удивление старого отшельника Многим памятна необыкновенная история семейства Лыковых, которое по религиозным мотивам удалилось
- 30. О полиэтилене… Полиэтилен – довольно «старый» пластик. Исследователи фирмы JCJ в 1933 году подвергли сжатию под
- 31. Интересно… Этилен – вредитель Во многих странах большое количество урожая пропадает из-за увядания плодов. Например, в
- 32. Решите задачу Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 85,7 %. Относительная плотность
- 33. Проверь М(СхНY)=70 г/моль n(Н)=0,1 моль n(С)=0,05 моль x : y = 0,05 : 0,1 = 1
- 34. Используя правило Марковникова, напишите уравнения следующих реакций присоединения: а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3
- 35. Проверь: Ответы: а) СН3-СН=СН2 + НСl → СН3-СНCl-СН3 б) СН2=СН-СН2-СН3 + НBr → СН3-СНBr-СН2-СН3 в) СН3-СН2-СН=СН2
- 36. Осуществить превращения: + КОН(спирт),t + НBr + Na СН3-(СН2)2-СН2Br → Х1 → Х2 → Х3
- 37. Проверь: Ответы: Х1 бутен-1 Х2 2-бромбутан Х3 3,4-диметилгексан
- 38. СИНКВЕЙН 1 строка – имя существительное (тема синквейна) 2 строка – два прилагательных (раскрывающие тему синквейна)
- 39. СИНКВЕЙН Этилен Ненасыщенный, активный Горит, обесцвечивает, присоединяет Этилен – представитель непредельных углеводородов Алкен
- 40. ДОМАШНЕЕ ЗАДАНИЕ Оценка «3»: параграф 4, ТПО стр. 24-25, № 5-7 Оценка «4»: Хомченко И.Г.: 20.21
- 42. Скачать презентацию






























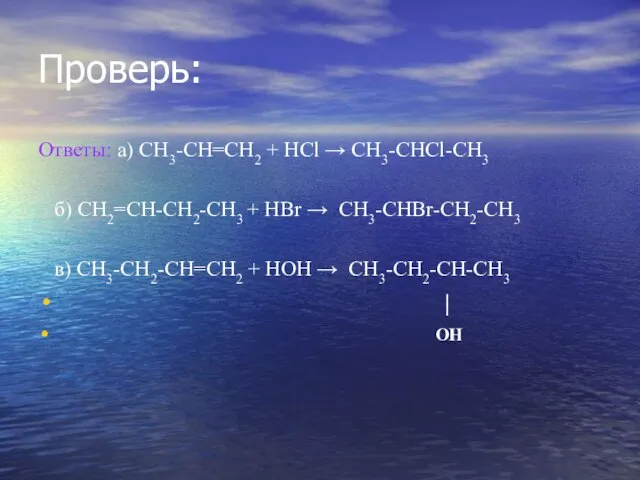





 Зеленая энергетика и российская энергетика: один путь и одна цель? Международный опыт в области энергоэффективности и энергосбер
Зеленая энергетика и российская энергетика: один путь и одна цель? Международный опыт в области энергоэффективности и энергосбер Презентация на тему Употребление односоставных и двусоставных предложений в речи
Презентация на тему Употребление односоставных и двусоставных предложений в речи  Карнавалы в Европе. Традиции и костюмы
Карнавалы в Европе. Традиции и костюмы Героическое прошлое нашей Родины в изобразительном искусстве
Героическое прошлое нашей Родины в изобразительном искусстве Памятники Екатеринбурга
Памятники Екатеринбурга Информация и информационные процессы в технике
Информация и информационные процессы в технике Презентация на тему Презентация Солнце
Презентация на тему Презентация Солнце  Человек и профессия
Человек и профессия Освещение
Освещение Анализ применения советами представительных органов муниципальных районов рекомендаций Совета представительных органов муници
Анализ применения советами представительных органов муниципальных районов рекомендаций Совета представительных органов муници Презентация на тему Стороны горизонта Ориентирование
Презентация на тему Стороны горизонта Ориентирование Строение голосового аппарата
Строение голосового аппарата Информационные электронные ресурсы по духовно – нравственному воспитанию.
Информационные электронные ресурсы по духовно – нравственному воспитанию. Учиться – всегда пригодится. Самообразование
Учиться – всегда пригодится. Самообразование Основы воинской службы
Основы воинской службы Перфоративная язва
Перфоративная язва Статистическая гипотеза
Статистическая гипотеза Санкт-Петербург, 29-30 ноября 2011 года
Санкт-Петербург, 29-30 ноября 2011 года Искусство Страны восходящего солнца
Искусство Страны восходящего солнца Аймактардын социалдык-экономикалык ?н?г?? тенденциясы
Аймактардын социалдык-экономикалык ?н?г?? тенденциясы Методы решения уравнений третьей степени
Методы решения уравнений третьей степени Процесс принятия и реализации управленческих решений в менеджменте и маркетинге
Процесс принятия и реализации управленческих решений в менеджменте и маркетинге Южная Африка
Южная Африка Роскошь IT общения
Роскошь IT общения Информационные системы
Информационные системы Фотоотчет о велопоездке МГУ - Мытищи
Фотоотчет о велопоездке МГУ - Мытищи shema_organizacii_remonta_i_modernizacii_tahografov_merkurij
shema_organizacii_remonta_i_modernizacii_tahografov_merkurij Как правильно построить презентацию авиакомпании для страхового рынка
Как правильно построить презентацию авиакомпании для страхового рынка