Содержание
- 2. Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степени окисления элементов (атомов). Степень окисления (СО) – условный
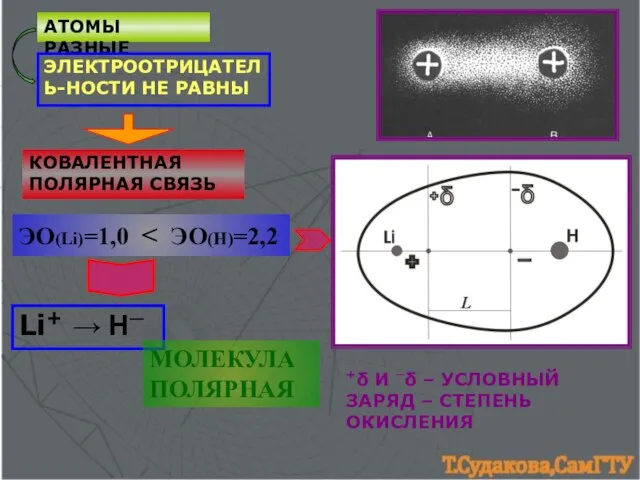
- 3. АТОМЫ РАЗНЫЕ ЭЛЕКТРООТРИЦАТЕЛЬ-НОСТИ НЕ РАВНЫ КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ +δ И ─δ – УСЛОВНЫЙ ЗАРЯД – СТЕПЕНЬ
- 4. Mg0 + Ag+N+5O─23 → → Mg+2O + N02 + O2 + Ag0 1) Mg0 + 2Ag+NO3
- 5. Элементы с постоянной СО: H+, Li+, Na+, K+, Rb+, Cs+, Be+2, Mg+2, Ca+2, Sr+2, Zn+2, Ag+,
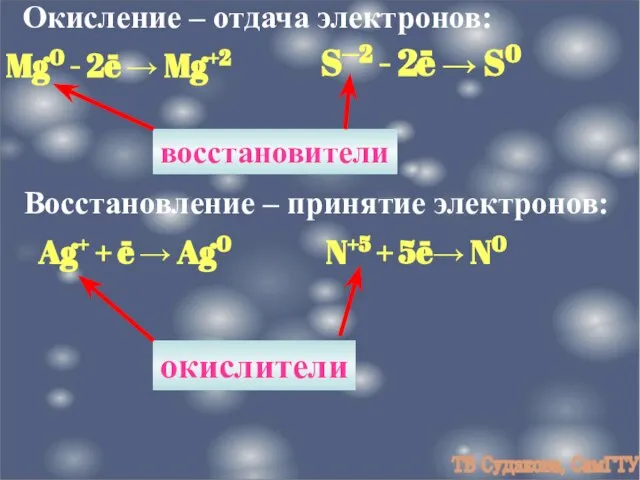
- 6. Окисление – отдача электронов: Mg0 - 2ē → Mg+2 S─2 - 2ē → S0 Восстановление –
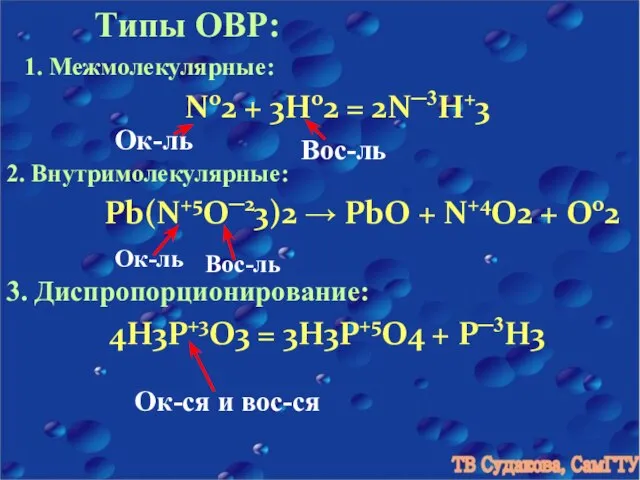
- 7. Типы ОВР: 1. Межмолекулярные: N02 + 3H02 = 2N─3H+3 Ок-ль Вос-ль 2. Внутримолекулярные: Pb(N+5O─23)2 → PbO
- 8. «Фараонова змея»: 2Hg(NCS)2 = 2HgS + C3N4 + CS2 CS─22 + 3O02 = CO─22 + 2S+4O2
- 9. Для окисления или восстановления в стандартных условиях: ΔG0 = - nFϕ0 n – кол-во ē; F
- 10. Направление самопроизвольного протекания ОВР: Полуреакция с большим значением ϕ0 – всегда ОКИСЛИТЕЛЬ! Полуреакция с меньшим значением
- 12. Скачать презентацию






 Африка
Африка Тууль Максим Юрьевич «Клуб Участников Проектного Процесса», Директор АКБ «Надежный банк», Президент тел: (495) 7675=02=23; E-mail: TMY@proje
Тууль Максим Юрьевич «Клуб Участников Проектного Процесса», Директор АКБ «Надежный банк», Президент тел: (495) 7675=02=23; E-mail: TMY@proje Илларион Михайлович Прянишников (1840-1894)
Илларион Михайлович Прянишников (1840-1894) ТЕРРИТОРИЯ ЛЮБВИ
ТЕРРИТОРИЯ ЛЮБВИ Презентация на тему И.С. Тургенева «Муму»
Презентация на тему И.С. Тургенева «Муму»  Презентація 10 клас Урок 31
Презентація 10 клас Урок 31 Ассирийская держава
Ассирийская держава Презентация 2
Презентация 2 Сертификация систем качества
Сертификация систем качества История развития зоологии
История развития зоологии Реализуемое имущество АО РоссельхозБанк: транспортные средства, с/х техника и оборудование
Реализуемое имущество АО РоссельхозБанк: транспортные средства, с/х техника и оборудование Обработка нижних срезов рукавов
Обработка нижних срезов рукавов Давайте знакомиться!
Давайте знакомиться! Мой первый бизнес-план
Мой первый бизнес-план Украшения своими руками
Украшения своими руками Стратегическое планирование и его этапы. Планирование маркетинга. Контроль. Типы маркетингового контроля
Стратегическое планирование и его этапы. Планирование маркетинга. Контроль. Типы маркетингового контроля Требования к информации, формируемой в бухгалтерском учете
Требования к информации, формируемой в бухгалтерском учете Центр«Интеллектуальные электронные энергосберегающие системы»(ЦИЭС)
Центр«Интеллектуальные электронные энергосберегающие системы»(ЦИЭС) Защитные очки
Защитные очки Карельский научный центр Российской академии наук. Молодые учёные
Карельский научный центр Российской академии наук. Молодые учёные История Т-34
История Т-34 По страницам русского языка
По страницам русского языка Ксюша
Ксюша Урок 20.1. Перевод дела в архив (на примере гражданского дела)
Урок 20.1. Перевод дела в архив (на примере гражданского дела) Презентация на тему Имена существительные нарицательные и собственные
Презентация на тему Имена существительные нарицательные и собственные Аудитория украинского интернета: статистика и тенденции
Аудитория украинского интернета: статистика и тенденции Любить но кого же?
Любить но кого же? Право, семья, ребенокКравченко, 9 класс
Право, семья, ребенокКравченко, 9 класс