Содержание
- 2. Окислительно-восстановительные реакции (ОВР) - – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в
- 3. Степень окисления Степень окисления атомов элементов простых веществ равна нулю Степень окисления водорода в соединениях +1,
- 4. Распознавание уравнений ОВР Запишите значения степеней окисления атомов всех элементов в уравнении реакции Определите изменяется ли
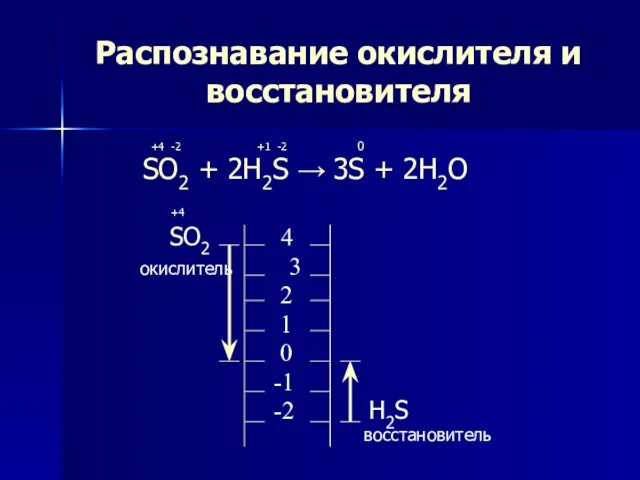
- 5. Распознавание окислителя и восстановителя +4 -2 +1 -2 0 SO2 + 2H2S → 3S + 2H2O
- 6. Метод электронного баланса +4 -2 +1 -2 0 SO2 + 2H2S → 3S + 2H2O +4
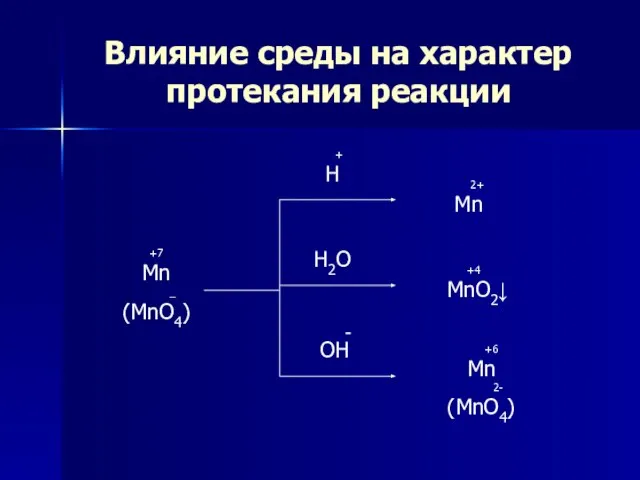
- 7. Влияние среды на характер протекания реакции +7 Mn _ (MnO4) + H H2O - OH 2+
- 8. Используя метод электронного баланса, составьте уравнение реакции: FeSO4+KMnO4+…→…+K2SO4+K2MnO4 Степень окисления Mn изменяется от +7 до +6
- 9. Используя метод электронного баланса, составьте уравнение pеакции: Zn+KMnO4+…→…+K2SO4+MnSO4 +Н2О Степень окисления Mn изменяется от +7 до
- 10. Используя метод электронного баланса, составьте уравнение реакции: K2SO3+KMnO4+…→…+MnO2 +… Степень окисления Mn изменяется от +7 до
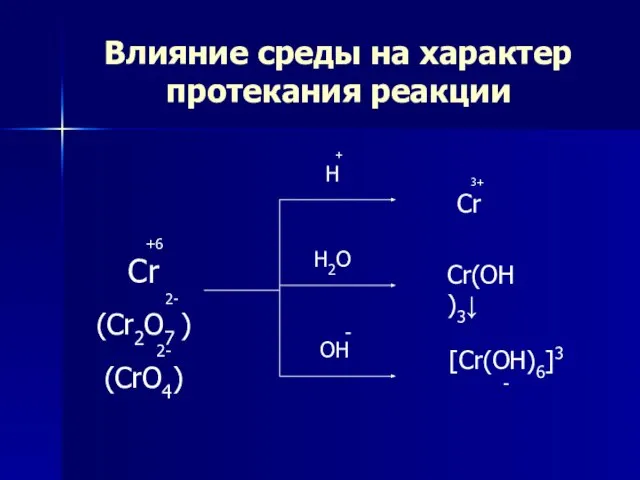
- 11. Влияние среды на характер протекания реакции +6 Cr 2- (Cr2O7 ) 2- (CrO4) + H H2O
- 12. Используя метод электронного баланса, составьте уравнение pеакции: H2S+K2Cr2O7+…→…+Cr2(SO4)3+…+H2O Соли Cr(III) образуются в кислой среде! Электронный баланс:
- 13. Используя метод электронного баланса, составьте уравнение pеакции: H2S+K2CrO4+…→…+Cr(OH)3 ↓ +KOH Гидроксид хрома(III) образуется в нейтральной среде.
- 14. Используя метод электронного баланса, составьте уравнение pеакции: K2CrO4+H2O2+…→K3[Cr(OH)6]+O2↑+… Комплексный анион [Cr(OH)6]3- образуется в щелочной среде. Электронный
- 15. Используя метод электронного баланса, составьте уравнение pеакции: NaCrO2+…+NaOH→…+NaBr +H2O Соединения хрома(III) при окислении в щелочной среде
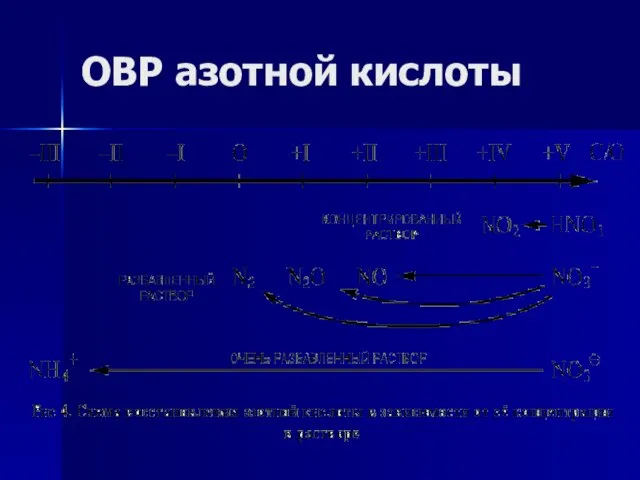
- 16. ОВР азотной кислоты
- 17. ОВР азотной кислоты 0 +5 +2 +1 4Ca + 10HNO3(конц.) → 4Ca(NO3)2 + N2O + 5H2O
- 18. ОВР азотной кислоты S0 + 6HNO3(конц) = H2S+6O4 + 6NO2 + 2H2O B0 + 3HNO3 (конц)=
- 19. ОВР азотной кислоты +2 -1 +5 +3 +6 +4 FeS2 + 18HNO3(конц.)→Fe(NO3)3+2H2SO4+15NO2+7H2O +2 _ +3 Fe
- 20. ОВР с участием органических соединений Окисление алкенов в нейтральной среде: C2H4 + 2KMnO4 + 2H2O→ CH2OH–CH2OH
- 21. Окисление алкинов в нейтральной среде: 3CH≡CH +8KMnO4→3KOOC – COOK +8MnO2 +2КОН +2Н2О 2C-1 – 8e- →
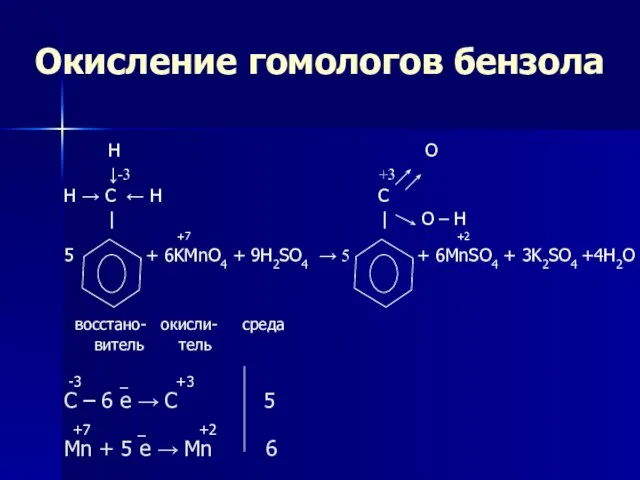
- 22. Окисление гомологов бензола H O ↓-3 +3 H → C ← H C | | O
- 23. Окисление гомологов бензола Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до
- 24. Окисление стирола В нейтральной среде: 3C6H5-CH =CH2+2 KMnO4+ H2O→ 3C6H5-CH(OH) -CH2(OH)+2MnO2+2KOH В кислой среде: C6H5-CH=CH2 +2KMnO4+3H2SO4→
- 25. Окисление спиртов 3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O 3СН2(ОН)
- 26. Окисление альдегидов 3CH3CH=O + 2KMnO4 = CH3COOH + + 2CH3COOK + 2MnO2 + H2O 3CH3CH=O +
- 27. Окисление карбоновых кислот НСООН + HgCl2 =CO2 + Hg + 2HCl HCOOH+ Cl2 = CO2 +2HCl
- 29. Скачать презентацию









![Используя метод электронного баланса, составьте уравнение pеакции: K2CrO4+H2O2+…→K3[Cr(OH)6]+O2↑+… Комплексный анион [Cr(OH)6]3- образуется](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/380419/slide-13.jpg)











 Урок повторения по теме “Световые явления”
Урок повторения по теме “Световые явления” Презентация на тему Изображение пространственных фигур
Презентация на тему Изображение пространственных фигур  Применение различных способов оплат для онлайн продаж в туризме.
Применение различных способов оплат для онлайн продаж в туризме. Волейбол. Двусторонняя игра по правилам
Волейбол. Двусторонняя игра по правилам Презентация на тему Скульптура классицизма
Презентация на тему Скульптура классицизма  Национальный и религиозный состав населения России
Национальный и религиозный состав населения России Система 5С в рационализации рабочего места школьника: основные принципы
Система 5С в рационализации рабочего места школьника: основные принципы Замок Riudabella находится в привилегированном месте у подножия горы, в заповеднике Prades в регионе Конка де Барбера (Испания). Всего в ст
Замок Riudabella находится в привилегированном месте у подножия горы, в заповеднике Prades в регионе Конка де Барбера (Испания). Всего в ст PREZENTATsIYa_Animirovanny_plakat_dlya_obyasnenia_napisania_pismennykh_bukv_russkogo_alfavita
PREZENTATsIYa_Animirovanny_plakat_dlya_obyasnenia_napisania_pismennykh_bukv_russkogo_alfavita Эстония
Эстония Организация приёма в профессиональные образовательные организации Новгородской области
Организация приёма в профессиональные образовательные организации Новгородской области Артериальная гипертензия и беременность
Артериальная гипертензия и беременность  Тысяча слоёв и треуголка императора. Мастер-класс по изготовлению торта Наполеон
Тысяча слоёв и треуголка императора. Мастер-класс по изготовлению торта Наполеон Интегрированный урок математики и истории
Интегрированный урок математики и истории Курсовая работа
Курсовая работа О модернизации учета электроэнергии
О модернизации учета электроэнергии Новогодний ночник
Новогодний ночник ПУБЛИЧНЫЙ ДОКЛАДо состоянии и перспективах развития
ПУБЛИЧНЫЙ ДОКЛАДо состоянии и перспективах развития Школа РосатомаРеализация национальной образовательной инициативы «Наша новая школа» в городах расположения предприятий атомно
Школа РосатомаРеализация национальной образовательной инициативы «Наша новая школа» в городах расположения предприятий атомно Презентация на тему Тема одиночества в лирике Лермонтова
Презентация на тему Тема одиночества в лирике Лермонтова  Планирование заявок на конкурсы для финансирования научно-исследовательских проектов
Планирование заявок на конкурсы для финансирования научно-исследовательских проектов Осенний натюрморт
Осенний натюрморт Школа №4 Жака-Ива Кустопредставляет
Школа №4 Жака-Ива Кустопредставляет Разработка Flash-проектов с использованием Apache Ant
Разработка Flash-проектов с использованием Apache Ant Особенности профессиональной подготовки психологов в России
Особенности профессиональной подготовки психологов в России LEONARDO DICAPRIO
LEONARDO DICAPRIO Презентация на тему Нашествие с запада
Презентация на тему Нашествие с запада «Права пациента в России»
«Права пациента в России»