Содержание
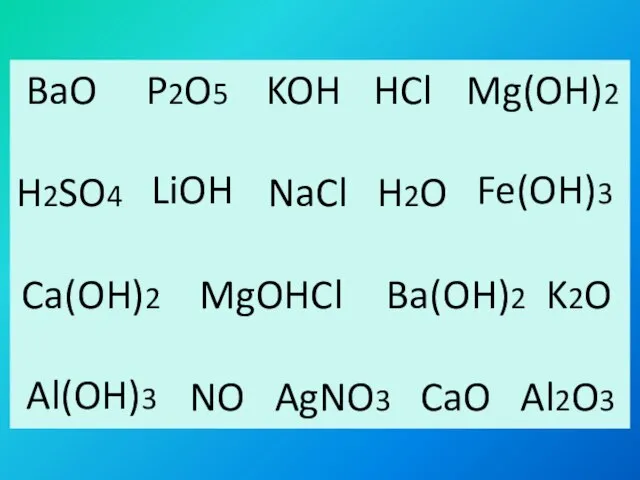
- 2. BaO P2O5 HCl H2SO4 NaCl H2O MgOHCl K2O NO AgNO3 CaO Al2O3 KOH Mg(OH)2 LiOH Fe(OH)3
- 3. Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. Me(OH)n n =
- 4. Названия оснований КОН Mg(OH)2 LiOH Fe(OH)3 Ca(OH)2 Al(OH)3 гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид калия магния
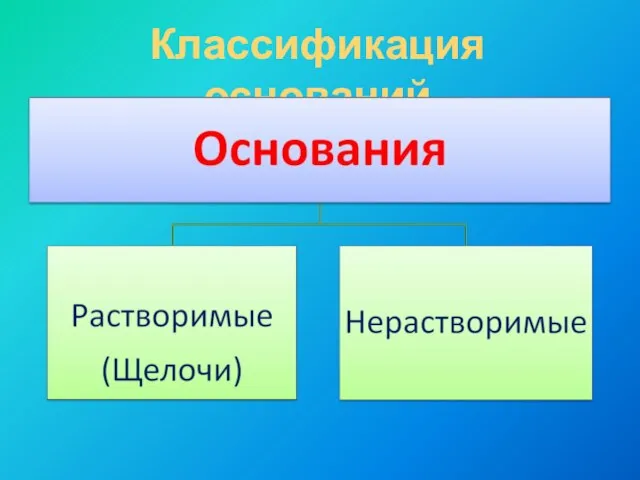
- 5. Классификация оснований
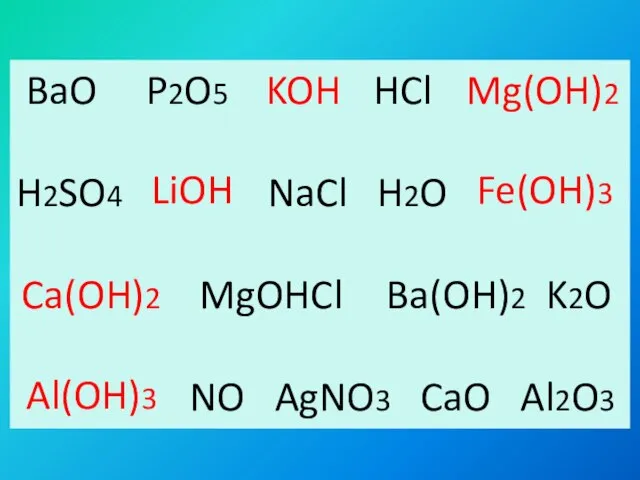
- 6. BaO P2O5 HCl H2SO4 NaCl H2O MgOHCl K2O NO AgNO3 CaO Al2O3 KOH Mg(OH)2 LiOH Fe(OH)3
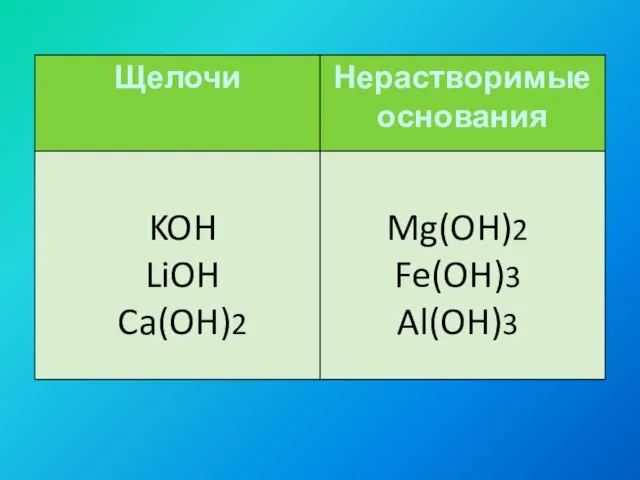
- 7. KOH LiOH Ca(OH)2 Mg(OH)2 Fe(OH)3 Al(OH)3
- 8. Физические свойства оснований Ba(OH)2 Co(OH)2 NaOH Ca(OH)2 LiOH Cu(OH)2
- 9. Получение оснований Активный металл + вода = = щелочь + водород 2Na + 2H2O = 2NaOH
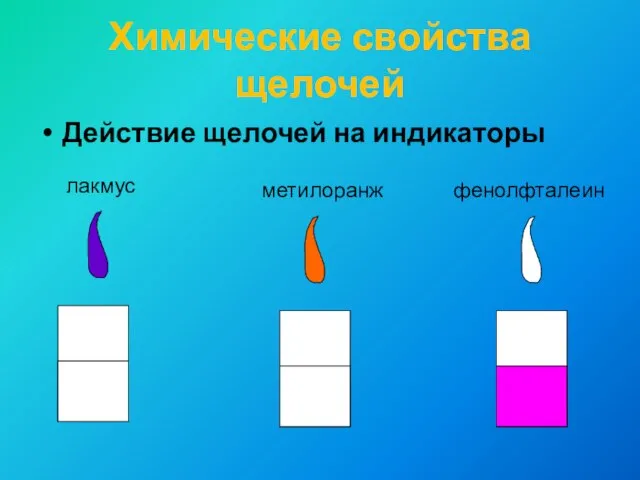
- 10. Химические свойства щелочей Действие щелочей на индикаторы лакмус метилоранж фенолфталеин
- 11. Химические свойства оснований Взаимодействие с кислотами: NaOH + HCl = NaCl +H2O 2. Взаимодействие щелочей с
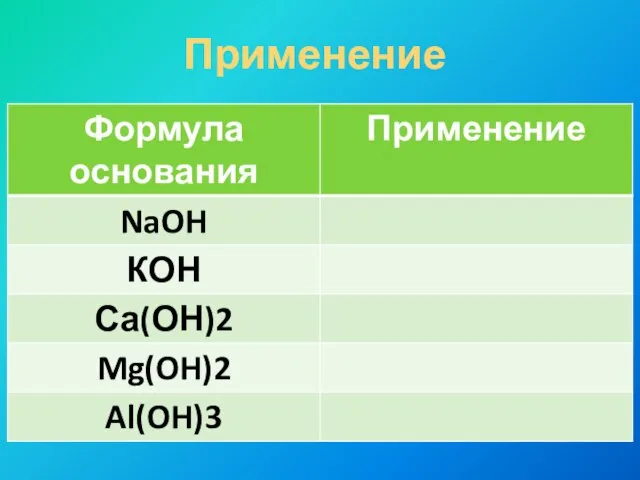
- 12. Применение
- 13. Домашнее задание §31 упр.1- 4
- 15. Скачать презентацию






 Работа с текстовым редактором
Работа с текстовым редактором Вокальная музыка.Типы певческих голосов
Вокальная музыка.Типы певческих голосов Священные города Мекка и Медина
Священные города Мекка и Медина a1323cf0fdad4da6977c138d34be271f
a1323cf0fdad4da6977c138d34be271f Воинская обязанность и военная служба. Военная служба в Российской Федерации и способы её реализации
Воинская обязанность и военная служба. Военная служба в Российской Федерации и способы её реализации Финансовый рынок, денежный рынок, монетарная политика
Финансовый рынок, денежный рынок, монетарная политика База данных складского учета
База данных складского учета Педсовет на тему: «Учитель и ученик в творческом диалоге»
Педсовет на тему: «Учитель и ученик в творческом диалоге» About Myself, my family and my best Friends
About Myself, my family and my best Friends геометрия 9а 11102022 (5)
геометрия 9а 11102022 (5) Многогранники
Многогранники Працяжнік паміж дзейнікам і выказнікам
Працяжнік паміж дзейнікам і выказнікам Информационная бизнес-платформа InterKent
Информационная бизнес-платформа InterKent Испания
Испания Загадки о ягодах
Загадки о ягодах Киевские князья и их прозвища
Киевские князья и их прозвища Презентация на тему Склонение имен существительных
Презентация на тему Склонение имен существительных  Ефременко Владимир Филиппович
Ефременко Владимир Филиппович Эздекова Нина Хажмуратовна Стаж работы – 40 лет 12 разряд Работает в 5 – 11 классах Проблема: «Активизация познавательной деятельнос
Эздекова Нина Хажмуратовна Стаж работы – 40 лет 12 разряд Работает в 5 – 11 классах Проблема: «Активизация познавательной деятельнос Городской транспорт будущего
Городской транспорт будущего Организация работы госпитальной школы
Организация работы госпитальной школы Осторожно – ЕДА!
Осторожно – ЕДА! Презентация на тему Модуль действительного числа
Презентация на тему Модуль действительного числа  Поль Сезанн
Поль Сезанн Ярилин день (макушка лета)
Ярилин день (макушка лета) Урок русского языка в 7 классеСочинение по картине С. Григорьева «Вратарь»
Урок русского языка в 7 классеСочинение по картине С. Григорьева «Вратарь» Экологическое право
Экологическое право Изменения глобальных энергетических рынков и требования к России как к участнику этих рынков
Изменения глобальных энергетических рынков и требования к России как к участнику этих рынков