Содержание
- 2. Химические свойства Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие
- 3. Химические свойства оснований (щелочей и нерастворимых оснований) 2NaOH + H2SO4 → Na2SO4 + 2H2O основание +
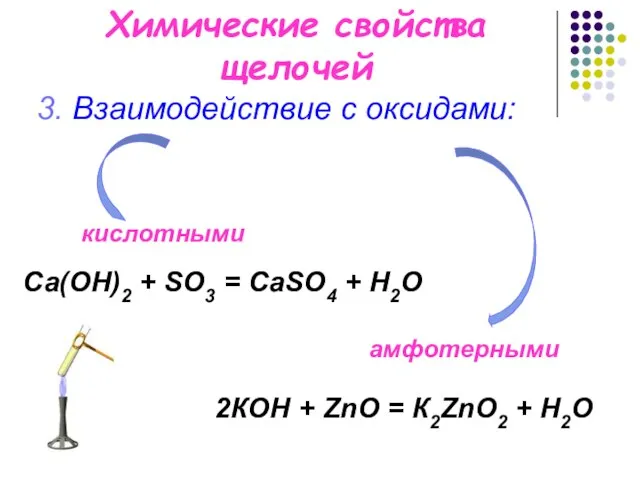
- 4. Химические свойства щелочей 3. Взаимодействие с оксидами: Са(OН)2 + SO3 = СаSO4 + H2O 2КOН +
- 5. Химические свойства щелочей 4. Взаимодействие с растворами солей: 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
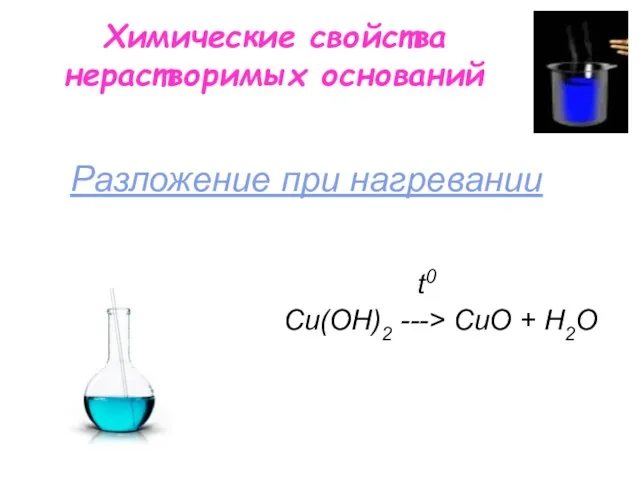
- 6. Химические свойства нерастворимых оснований t0 Сu(OН)2 ---> СuO + H2O Разложение при нагревании
- 7. Способы получения растворимых оснований (щелочей) 1. Взаимодействие щелочных и щелочно-земельных металлов с водой 2Na + 2H2O
- 9. Скачать презентацию




 Электрофильное замещение
Электрофильное замещение СОЛНЕЧНАЯ СИСТЕМА
СОЛНЕЧНАЯ СИСТЕМА Архитектура Флоренции
Архитектура Флоренции Оборудование для измельчения и переработки шин
Оборудование для измельчения и переработки шин Гражданский процесс
Гражданский процесс Развитие общества
Развитие общества Женщины в жизни Александра Сергеевича Пушкина
Женщины в жизни Александра Сергеевича Пушкина Информация об организации летнего труда, оздоровления и отдыха детей и молодежи города Калининграда в 2009 году. А.Н. Силанов - п
Информация об организации летнего труда, оздоровления и отдыха детей и молодежи города Калининграда в 2009 году. А.Н. Силанов - п ДАТЧИК ПОЛОЖЕНИЯ КОЛЕНЧАТОГО ВАЛА
ДАТЧИК ПОЛОЖЕНИЯ КОЛЕНЧАТОГО ВАЛА Мы все учились понемногу
Мы все учились понемногу Сепаратизм в современном мире,
Сепаратизм в современном мире, Экскурсионный маршрут “Православные храмы Бежецка”
Экскурсионный маршрут “Православные храмы Бежецка” Организация работы железнодорожных станций. Регламент переговоров ДСП станции, машинистов и составителя поездов при работе
Организация работы железнодорожных станций. Регламент переговоров ДСП станции, машинистов и составителя поездов при работе Биография Бианки
Биография Бианки Определение синуса, косинуса, тангеса острого угла прямоугольного треугольника
Определение синуса, косинуса, тангеса острого угла прямоугольного треугольника Искусство объединяет народы
Искусство объединяет народы КУДА ПОЙТИ УЧИТЬСЯ?
КУДА ПОЙТИ УЧИТЬСЯ? Регламентация IT-процессов
Регламентация IT-процессов Перцептивные процессы в управленческой деятельности
Перцептивные процессы в управленческой деятельности СЛОВАРЬ СЛЕНГА
СЛОВАРЬ СЛЕНГА Конструктивное партнерство. Стелопластик
Конструктивное партнерство. Стелопластик Презентация на тему Общие закономерности реакционной способности органических соединений как химическая основа их биологическо
Презентация на тему Общие закономерности реакционной способности органических соединений как химическая основа их биологическо Презентация_Актион
Презентация_Актион Бизнес-план проекта Велопрокат
Бизнес-план проекта Велопрокат Pointillism
Pointillism Родина Ломоносова
Родина Ломоносова Презентация на тему Бедные
Презентация на тему Бедные  э
э