Содержание
- 3. Кислоты Тема урока: «Химические свойства кислот с позиции теории электролитической диссоциации». «От кислых яблок сразу скисну».
- 4. Кислота, когда здорова, Угостить друзей готова Тем, что ей дала природа - Катионом водорода! Н+ Н+
- 5. а) НСl, H2SO4; H3PO4; HClO4 - кислоты; - индикаторы; - металлы; - основные оксиды; - основания;
- 6. Лабораторный опыт №3 Каковы химические свойства кислот? Почему кислоты обладают сходными химическими свойствами?
- 7. Взаимодействие кислот с индикаторами
- 8. Взаимодействие кислот с металлами
- 9. Взаимодействие кислот с основными оксидами
- 10. Взаимодействие кислот с основаниями
- 11. Взаимодействие кислот с солями
- 12. Содержание I. Определение кислот. II. Химические свойства кислот. Взаимодействие кислот: 1) с индикаторами; 2) с металлами,
- 13. «Воспоминание о лете» Погадаем на ромашке: «Взаимодействует – не взаимодействует?» Задание С какими из веществ взаимодействует
- 14. «Сами трудясь, вы многое сделаете для себя и для близких, а если при труде успеха не
- 15. О кислотных дождях Оксиды азота, серы содержатся в выхлопных газах реактивных двигателей и двигателей внутреннего сгорания,
- 16. Кислотные дожди виноваты в исчезновении рыбы во многих реках и озёрах, так как рыба не выдерживает
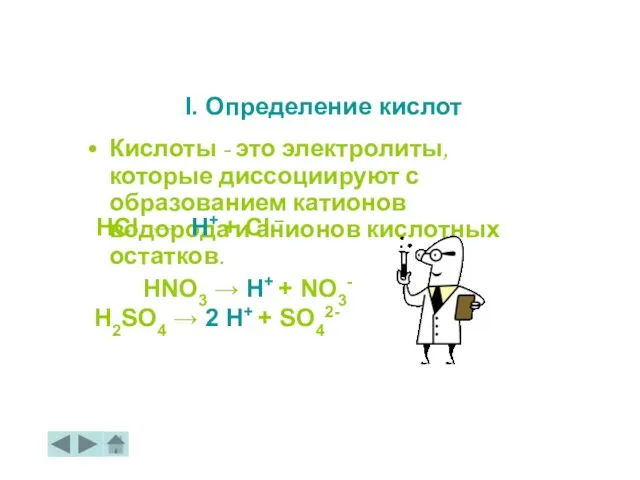
- 17. Кислоты - это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотных остатков. I. Определение
- 18. Опыт 1 Кислоты взаимодействуют: II. Химические свойства кислот ∙ метилоранж становится ∙ фенолфталеин остаётся розовым или
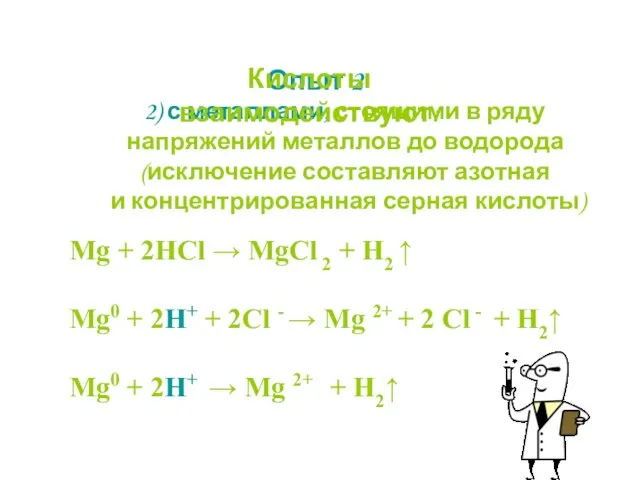
- 19. Опыт 2 2) с металлами, стоящими в ряду напряжений металлов до водорода (исключение составляют азотная и
- 20. 3) с основными оксидами с образованием соли и воды СаО + 2НСl → CaCl2 + H2O
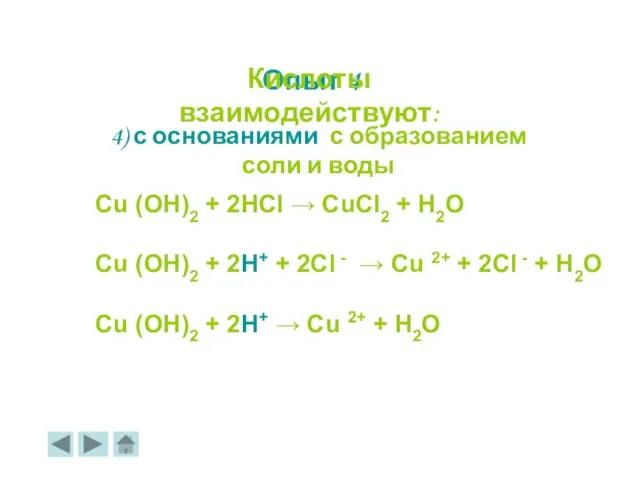
- 21. 4) с основаниями с образованием соли и воды Cu (OH)2 + 2HCl → CuCl2 + H2O
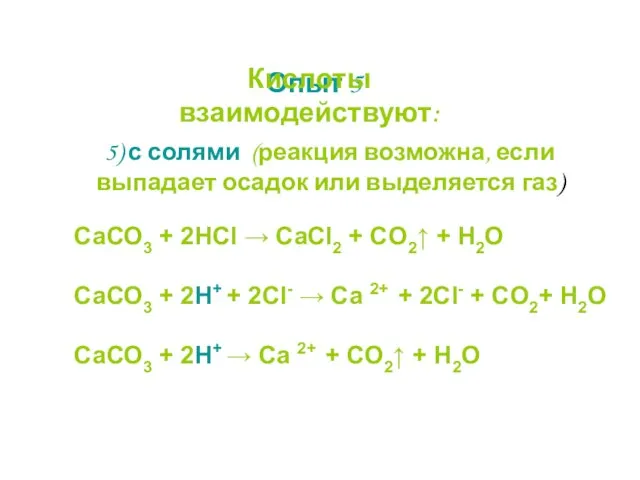
- 22. 5) с солями (реакция возможна, если выпадает осадок или выделяется газ) СаСО3 + 2НСl → CaCl2
- 24. Скачать презентацию

















 Центр гидравлики трубопроводного транспорта Академии наук Республики Башкортостан
Центр гидравлики трубопроводного транспорта Академии наук Республики Башкортостан Конкурс презентаций
Конкурс презентаций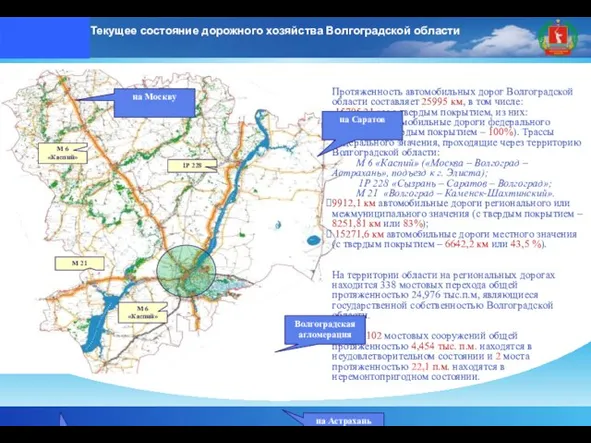 Текущее состояние дорожного хозяйства Волгоградской области
Текущее состояние дорожного хозяйства Волгоградской области Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092
Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092 TPG
TPG Глава 2
Глава 2 Джонатан Свифт. Слово о писателе. «Путешествие Гулливера» как сатира на государственное устройство общества. Образ Гулливера (час
Джонатан Свифт. Слово о писателе. «Путешествие Гулливера» как сатира на государственное устройство общества. Образ Гулливера (час Теория целей Локка
Теория целей Локка Как подобрать телефон для учебы работы игр
Как подобрать телефон для учебы работы игр Учителя русского языка
Учителя русского языка Правонарушения и юридическая ответственность
Правонарушения и юридическая ответственность В объятьях двух морей новый
В объятьях двух морей новый МОДЕЛЬ И АЛГОРИТМ ДЕЯТЕЛЬНОСТИ МОУ СОШ № 13 В УСЛОВИЯХ ВВЕДЕНИЯ Федерального государственного образовательного стандарта начал
МОДЕЛЬ И АЛГОРИТМ ДЕЯТЕЛЬНОСТИ МОУ СОШ № 13 В УСЛОВИЯХ ВВЕДЕНИЯ Федерального государственного образовательного стандарта начал Профилактикa и защита детей от насилия в школе
Профилактикa и защита детей от насилия в школе Шлифовальные станки, используемые в производстве фанеры
Шлифовальные станки, используемые в производстве фанеры Бухобслуживание
Бухобслуживание Портфель здоровья
Портфель здоровья Правило "ЕСЛИ-ТО"
Правило "ЕСЛИ-ТО" Русские народные праздники
Русские народные праздники О работе информационной системы «Единое окно доступа к образовательным ресурсам»
О работе информационной системы «Единое окно доступа к образовательным ресурсам» Русский язык и культура речи. Виртуальная выставка
Русский язык и культура речи. Виртуальная выставка Деловые документы (автобиография, заявление, резюме )
Деловые документы (автобиография, заявление, резюме ) 1 классМБОУ Великовская СОШ2011/2012 учебный год
1 классМБОУ Великовская СОШ2011/2012 учебный год Эквадор
Эквадор Презентация на тему Былины
Презентация на тему Былины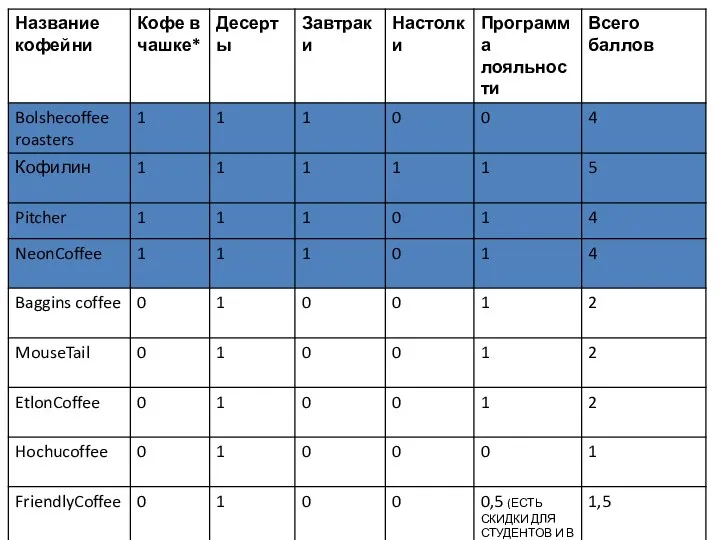 4. карта позиционирования, конкуренты_Шашина_3ГИВ13
4. карта позиционирования, конкуренты_Шашина_3ГИВ13 Нитяная графика
Нитяная графика Афанасий Фет и Фёдор Тютчев – певцы русской природы
Афанасий Фет и Фёдор Тютчев – певцы русской природы