Слайд 2Цель урока:
1. на основе положения металлов в ПСХЭ прийти к пониманию

особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки).
2.Обобщить и расширить знания о физических свойствах металлов и их классификаций.
3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.
Слайд 3МЕДЬ
Иду на мелкую монету,
В колоколах люблю звенеть,
Мне ставят памятник за это
И знают:

имя мое-….
Слайд 4ЖЕЛЕЗО
Пахать и строить -
все он может,
если ему уголек в том

поможет…
Слайд 5Металлы – это группа веществ с общими свойствами.

Слайд 6Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп
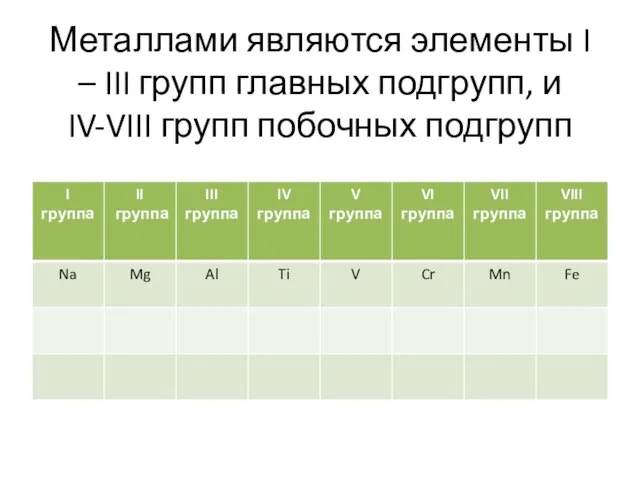
побочных подгрупп
Слайд 7Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым
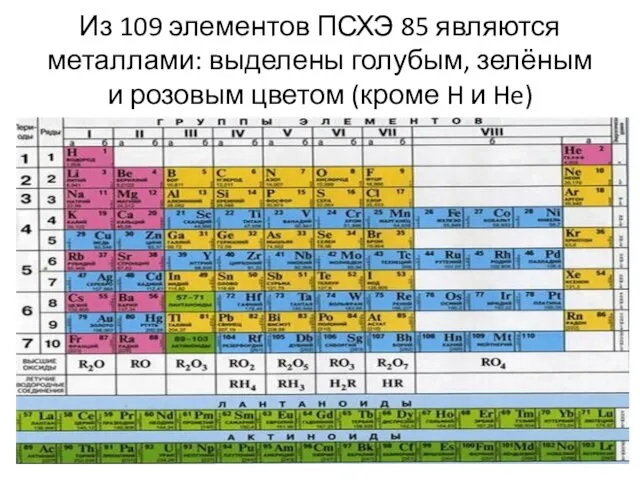
цветом (кроме H и He)
Слайд 8Положение элемента в ПС отражает строение его атомов

Слайд 10Электронное строение атома натрия
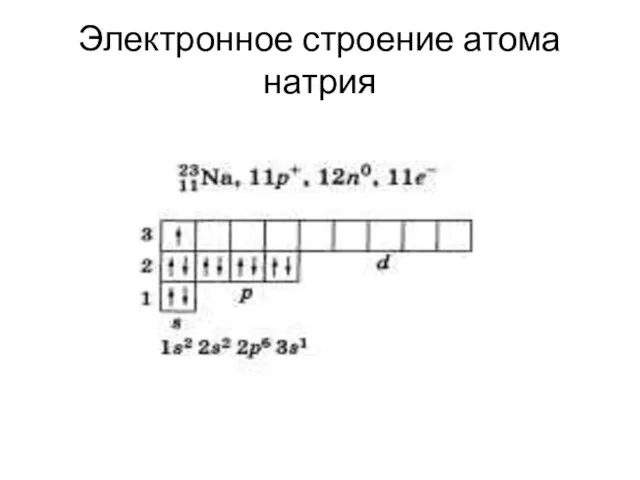
Слайд 11Задание 2.
Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно

по примеру с атомом натрия.
Слайд 12Вывод:
1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже

4-6.
2. Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Слайд 13Металлическая химическая связь характеризуется:
- делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно

связывают множество ядер;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направленностью и насыщенностью.
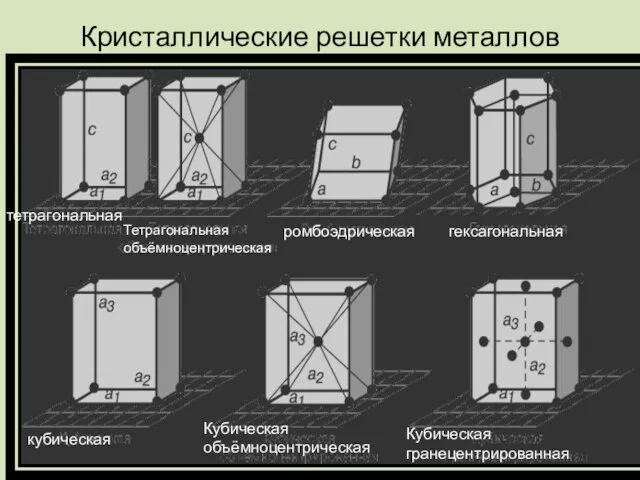
Слайд 14Кристаллические решетки металлов
тетрагональная
Тетрагональная объёмноцентрическая
ромбоэдрическая
гексагональная
кубическая
Кубическая объёмноцентрическая
Кубическая гранецентрированная
Слайд 15Видеоинформация о кристаллах металлов

Слайд 16Свойства металлов определяются строением их атомов.

Слайд 17Проверьте усвоение знаний на уроке тестированием



















 Структура холдинга
Структура холдинга Imagine – John Lennon
Imagine – John Lennon  Цели расследовательской деятельности журналиста
Цели расследовательской деятельности журналиста Синергетична концепція інноваційного розвитку інформаційного права
Синергетична концепція інноваційного розвитку інформаційного права Результаты исследования «SEO-альманах» ТопЭксперт.РФ
Результаты исследования «SEO-альманах» ТопЭксперт.РФ Профессиональная компетентность педагога
Профессиональная компетентность педагога Нормативно-правовые основы образования
Нормативно-правовые основы образования Задачи и объекты SWOT-анализа
Задачи и объекты SWOT-анализа Оформление и ведение учета операции с неплатежеспособными денежными знаками
Оформление и ведение учета операции с неплатежеспособными денежными знаками кибер-готы
кибер-готы Как увеличить вашу прибыль и расширить круг клиентов
Как увеличить вашу прибыль и расширить круг клиентов СOBIT® и ITIL®
СOBIT® и ITIL® Молодежный театр Эксперимент
Молодежный театр Эксперимент Компания «Винтер»
Компания «Винтер» Транспорт будущего
Транспорт будущего Анализ результатов Глобального опроса взрослого населения о потреблении табака в Российской Федерации и рекомендации для дальне
Анализ результатов Глобального опроса взрослого населения о потреблении табака в Российской Федерации и рекомендации для дальне himiki_i_ih_zaslugi
himiki_i_ih_zaslugi Кейс – технологии в учебном процессе
Кейс – технологии в учебном процессе Maslenitsa
Maslenitsa Ртуть
Ртуть Парные согласные в конце слова
Парные согласные в конце слова 10 вопросов о Солнце
10 вопросов о Солнце Дроби (6 класс)
Дроби (6 класс) Грибы
Грибы Мастер-классы по “Косметике для гурманов” учебного центра Yazykov-Group
Мастер-классы по “Косметике для гурманов” учебного центра Yazykov-Group Фонограф
Фонограф Организационное стимулирование
Организационное стимулирование Презентация на тему Internet-игра по русскому языку «Коротышкины задачи» с использованием web сервиса LearningApps.org
Презентация на тему Internet-игра по русскому языку «Коротышкины задачи» с использованием web сервиса LearningApps.org