Содержание
- 2. 8.8. Круговой процесс (цикл) Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд
- 3. Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне
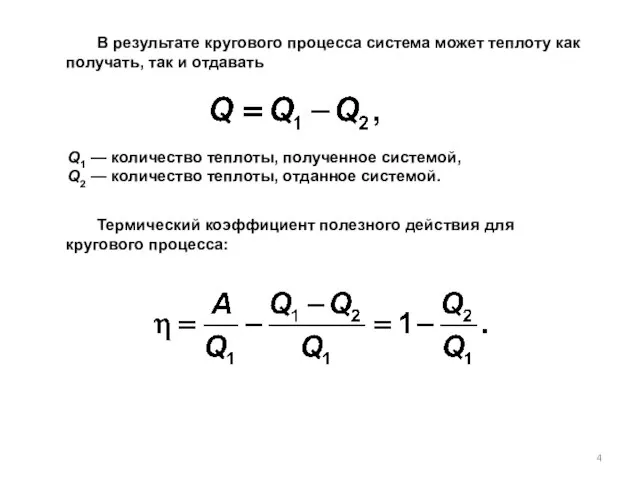
- 4. В результате кругового процесса система может теплоту как получать, так и отдавать Q1 — количество теплоты,
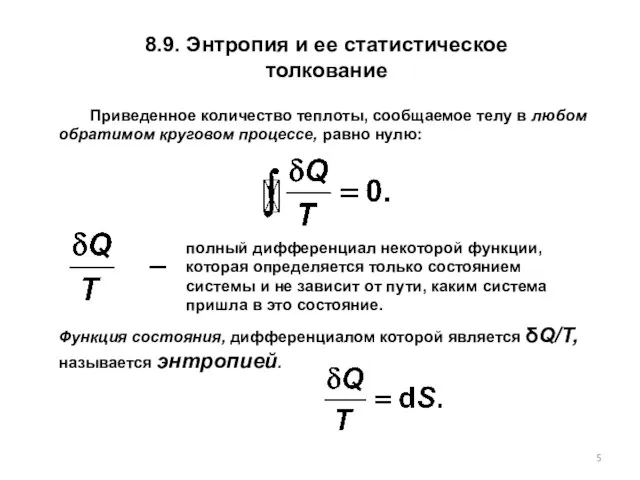
- 5. 8.9. Энтропия и ее статистическое толкование Приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе,
- 6. Для обратимых процессов изменение энтропии: Для системы, которая обменивается теплотой с внешней средой, энтропия может быть:
- 7. Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение ее энтропии:
- 8. или Замечания: Изменение энтропии ΔS1→2 идеального газа при переходе его из состояния 1 в состояние 2
- 9. Изменение энтропии при изотермическом процессе: Изменение энтропии при изохорном процессе: Следствия для приращения энтропии:
- 10. Термодинамическая вероятность состояния системы — это число микросостояний, определяющих данное макросостояние. Энтропия системы и термодинамическая вероятность
- 11. Статистическое толкование энтропии на основе формулы Больцмана: «энтропия является мерой неупорядоченности системы (мерой хаоса)». Другое определение
- 12. 8.10. Второе начало термодинамики Второе начало термодинамики определяет направление протекания термодинамических процессов. «В замкнутой системе при
- 13. В середине XIX в. возникла проблема так называемой тепловой смерти Вселенной. Рассматривая Вселенную как замкнутую систему
- 14. 8.11. Третье начало термодинамики Теорема Нернста — Планка: «энтропия всех тел в состоянии равновесия стремится к
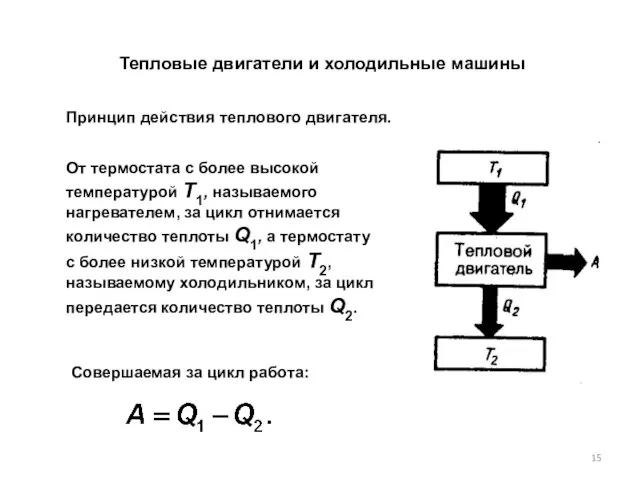
- 15. Тепловые двигатели и холодильные машины От термостата с более высокой температурой Т1, называемого нагревателем, за цикл
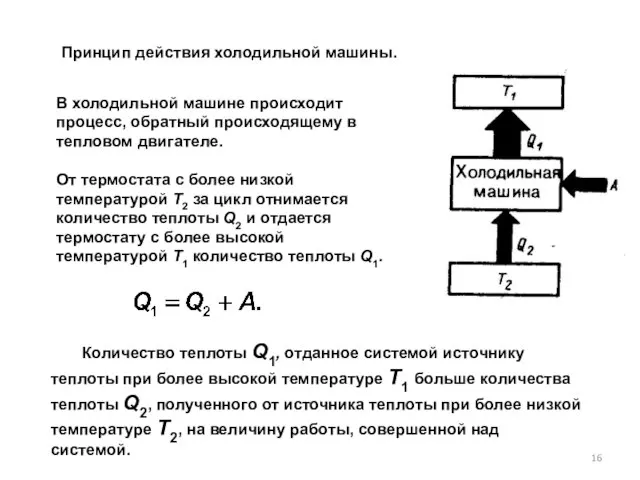
- 16. В холодильной машине происходит процесс, обратный происходящему в тепловом двигателе. От термостата с более низкой температурой
- 17. Теорема Карно: «из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (T1) и холодильников (T2),
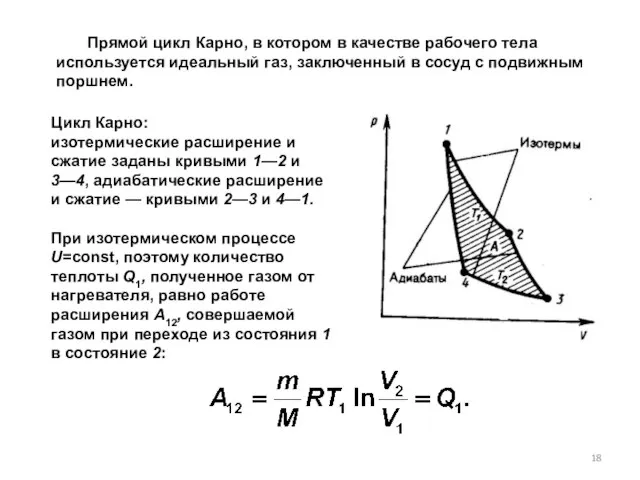
- 18. Цикл Карно: изотермические расширение и сжатие заданы кривыми 1—2 и 3—4, адиабатические расширение и сжатие —
- 19. При адиабатическом расширении 2—3 теплообмен с окружающей средой отсутствует и работа расширения А23 совершается за счет
- 21. Скачать презентацию













 Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика
Презентация на тему Формирование познавательной активности детей через экологическое воспитание: теория и практика My England
My England Проект переработки творожной сыворотки в ООО Молоко п. Торбеево
Проект переработки творожной сыворотки в ООО Молоко п. Торбеево Ing form or infinitive
Ing form or infinitive Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015
Адаптация систем менеджмента качества к требованиям новой версии стандарта ГОСТ Р ИСО 9001-2015 Гласные и согласные
Гласные и согласные Репродуктивные органы размножения у растений
Репродуктивные органы размножения у растений OneTouch Marketing Activity
OneTouch Marketing Activity Ангел на шпиле Петропавловского собора
Ангел на шпиле Петропавловского собора Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Фен. Косметический девичник
Фен. Косметический девичник Валютный рынок FOREX
Валютный рынок FOREX ДЕСЕРТЫ
ДЕСЕРТЫ фонтан на книжной полке
фонтан на книжной полке Тоннель
Тоннель Электромагнитные явления
Электромагнитные явления Проект«Возможно ли в наше время сохранение единого русского литературного языка?»
Проект«Возможно ли в наше время сохранение единого русского литературного языка?» Как РА найти веб-студию и не потерять клиента?
Как РА найти веб-студию и не потерять клиента? Генетика человека 11 класс
Генетика человека 11 класс Урок № 3 Сценография – особый вид художественного творчества
Урок № 3 Сценография – особый вид художественного творчества Как делать контрольную работу
Как делать контрольную работу Чем опасна толпа
Чем опасна толпа Брошюра для родителей. Наше творчество
Брошюра для родителей. Наше творчество Понятие коммуникационного процесса. Модель коммуникации лассуэла
Понятие коммуникационного процесса. Модель коммуникации лассуэла Химическое многоборье
Химическое многоборье 菲奥娜和史莱克
菲奥娜和史莱克 Россия и страны бывшего СССР: если интегрироваться, то с кем?
Россия и страны бывшего СССР: если интегрироваться, то с кем? «Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»
«Нестандартные формы работы на уроках литературы в условиях внедрения инновационных методов»