Содержание
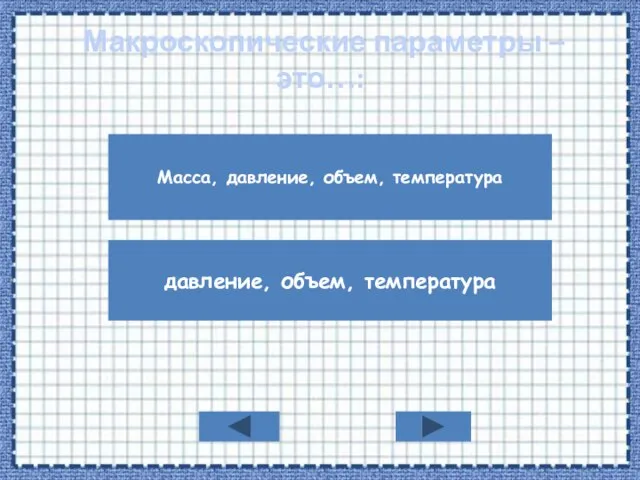
- 2. Макроскопические параметры – это…: Масса, давление, объем, температура давление, объем, температура
- 3. Состояние газа данной массы характеризуется тремя макроскопическими параметрами: давлением– р, объемом – V и температурой –
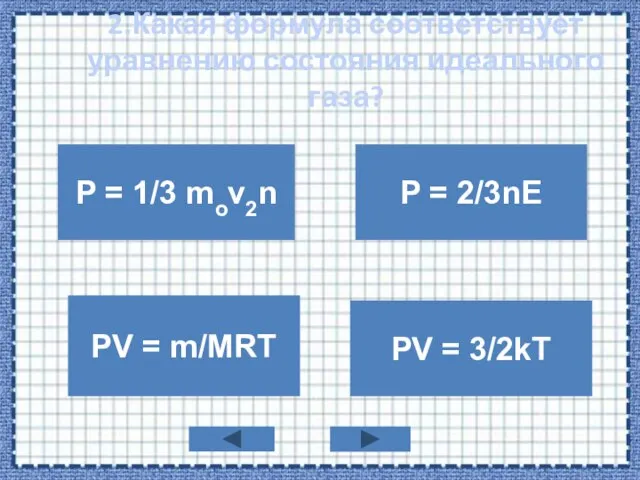
- 4. 2.Какая формула соответствует уравнению состояния идеального газа? P = 1/3 mov2n PV = m/MRT P =
- 5. Ответ неверен! Повтори теорию!
- 6. Молодец! Можешь приступать к следующему вопросу
- 7. Ответ неверен! Повтори теорию!
- 8. Уравнение, связывающее все три макроскопических параметра р, V и T, характеризующие состояние достаточно разряженного газа данной
- 9. Молодец! Можешь приступать к следующему вопросу
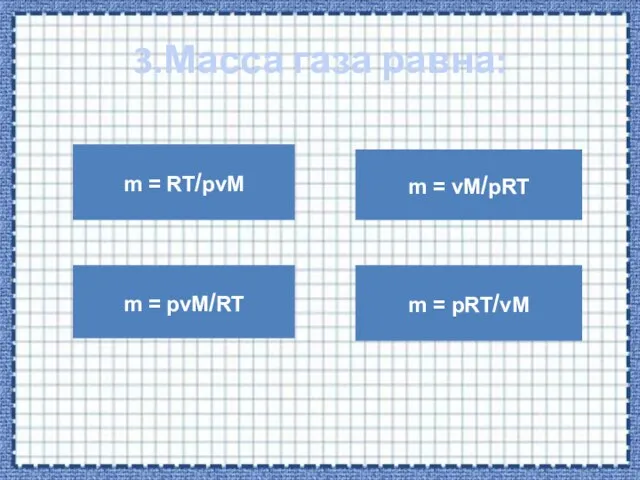
- 10. 3.Масса газа равна: m = RT/pvM m = pvM/RT m = vM/pRT m = pRT/vM
- 11. Молодец! Можешь приступать к следующему вопросу
- 12. Ответ неверен! Повтори теорию!
- 13. pv = m/MRT Чтобы выразить неизвестную величину из уравнения Менделеева – Клапейрона, умножь левую и правую
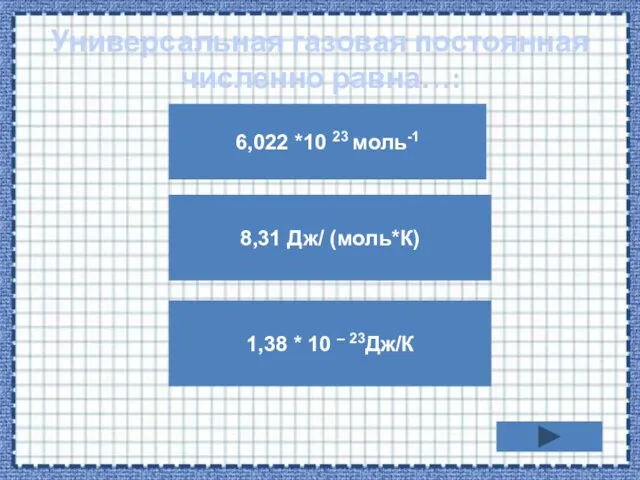
- 14. Универсальная газовая постоянная численно равна…: 6,022 *10 23 моль-1 1,38 * 10 – 23Дж/К 8,31 Дж/
- 15. Ответ неверен! Повтори теорию!
- 16. Молодец! Можешь приступать к следующему вопросу
- 17. Произведение постоянной Больцмана к и постоянной Авогадро Na называют универсальной газовой постоянной и обозначают буквой R
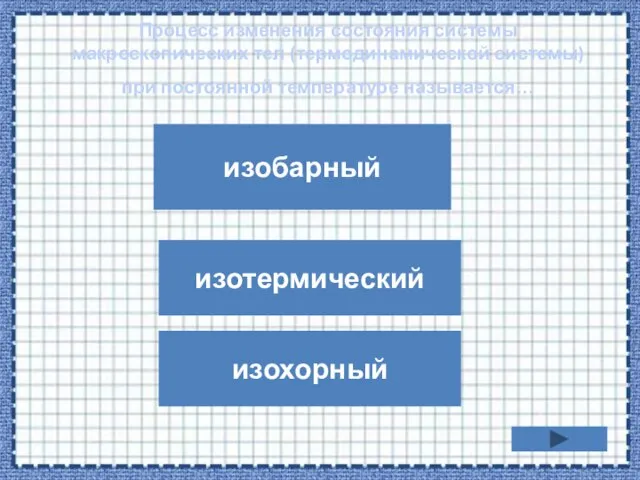
- 18. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называется… изобарный изохорный изотермический
- 19. pv = const Согласно уравнению состояния газа в любом состоянии с неизменной температурой произведение давления газа
- 20. Молодец! Можешь приступать к следующему вопросу
- 21. Ответ неверен! Повтори теорию!
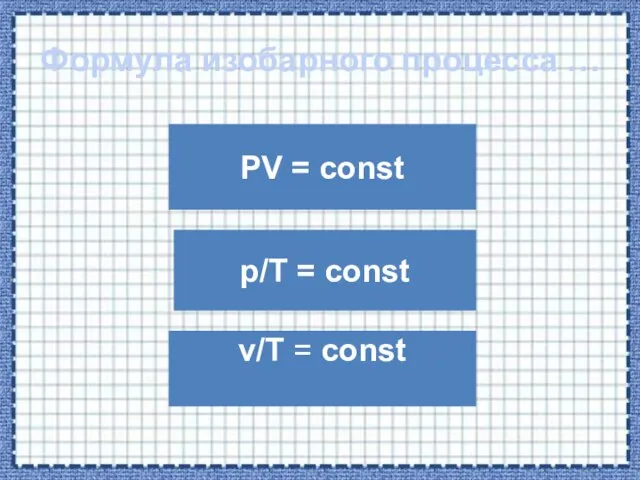
- 22. Формула изобарного процесса … PV = const v/T = const p/T = const
- 23. Ответ неверен! Повтори теорию!
- 24. Молодец! Можешь приступать к следующему вопросу
- 25. P = const Для данной массы газа отношение объема к температуре постоянно, если давление газа не
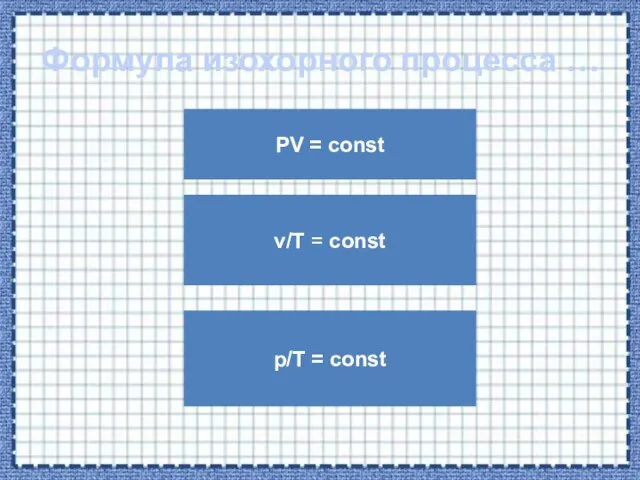
- 26. Формула изохорного процесса … PV = const p/T = const v/T = const
- 27. Ответ неверен! Повтори теорию!
- 28. Молодец! Можешь приступать к следующему вопросу
- 29. p/T = const Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Газовый закон Шарля.
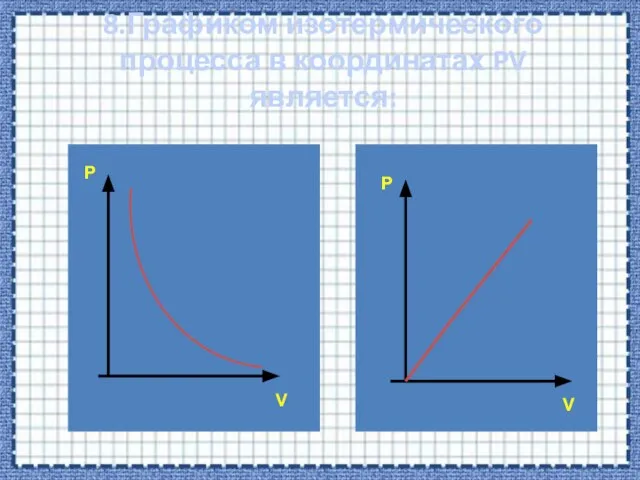
- 30. 8.Графиком изотермического процесса в координатах PV является: P P V V
- 31. Молодец! Можешь приступать к следующему вопросу
- 32. Ответ неверен! Повтори теорию!
- 33. Р V Зависимость между давлением и объемом в изотермическом процессе обратно пропорциональная. Графиком в координатах PV
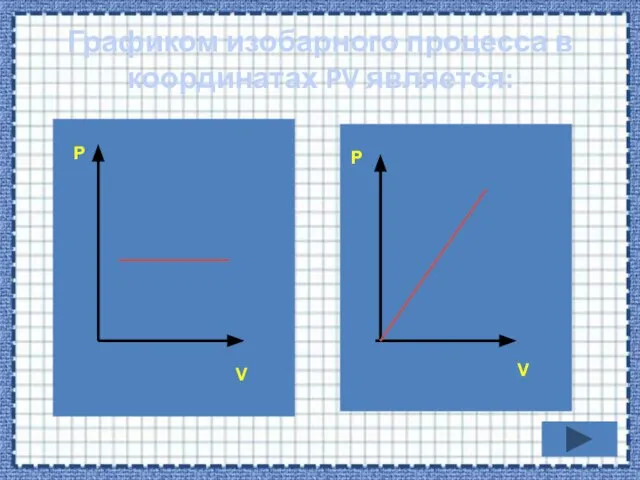
- 34. Графиком изобарного процесса в координатах PV является: P V P V
- 35. Молодец! Можешь приступать к следующему вопросу
- 36. Ответ неверен! Повтори теорию!
- 37. Если процесс изобарный давление постоянно, в координатах PV график прямая линия параллельная оси объема. Р V
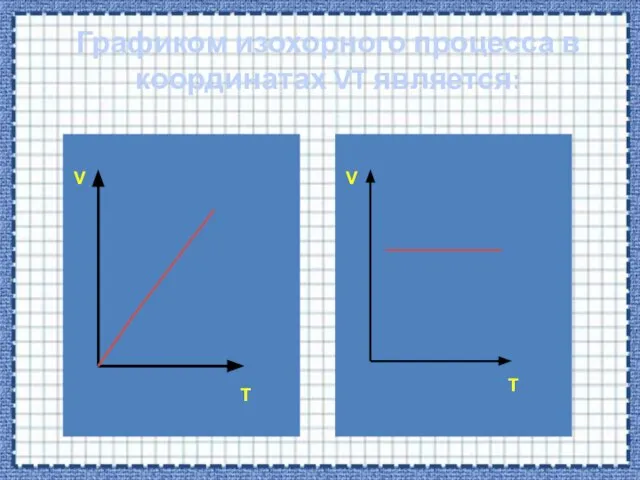
- 38. Графиком изохорного процесса в координатах VT является: V V T T
- 39. Молодец! Можешь приступать к следующему вопросу
- 40. Ответ неверен! Повтори теорию!
- 41. V T Если процесс изохорный объем постоянный, в координатах VT график - прямая линия параллельная оси
- 42. Реши задачу: В сосуде вместимостью 500 см3 содержится 0,89 г водорода при температуре 170С. Определите давление
- 43. Молодец! Задача решена правильно! Решим еще!
- 44. Ответ неверен! Проанализируй правильное решение задачи
- 45. Дано: V=500см3 =500*10-6м3 m = 0,89г = 0,89 *10-3кг T = 2900К R = 8,31 Дж/моль
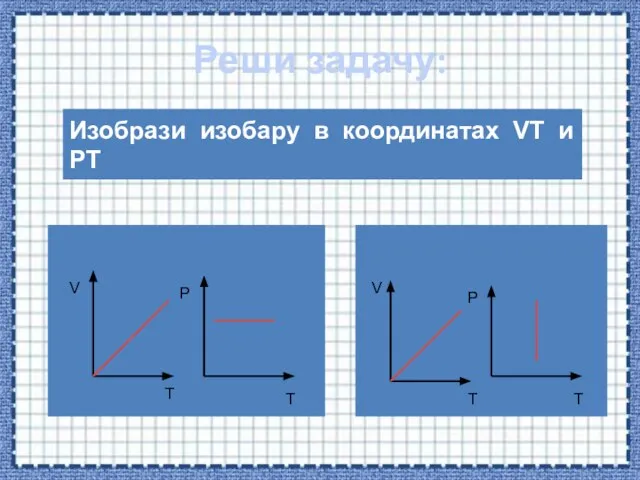
- 46. Реши задачу: Изобрази изобару в координатах VT и PT V T P T V T P
- 47. Поздравляю! Ты знаешь данную тему
- 49. Скачать презентацию



































 RUметрика 3.0 – новые возможности
RUметрика 3.0 – новые возможности Свойство биссектрисы равнобедренного треугольника
Свойство биссектрисы равнобедренного треугольника границы россии (2)
границы россии (2) Муниципальное дошкольное образовательное учреждение центр развития ребенка детский сад № 111
Муниципальное дошкольное образовательное учреждение центр развития ребенка детский сад № 111 Профессия Продажник в директ блогера (урок №12)
Профессия Продажник в директ блогера (урок №12) Дети до года
Дети до года Презентация на тему Китайская Народная Республика
Презентация на тему Китайская Народная Республика  ADENSYA.RU ПРЕДСТАВЛЯЕТ ВИРТУАЛЬНЫЙ ТОРГОВЫЙ ЦЕНТР ОДЕЖДЫ, ОБУВИ И АКСЕССУАРОВ МАРКЕТ
ADENSYA.RU ПРЕДСТАВЛЯЕТ ВИРТУАЛЬНЫЙ ТОРГОВЫЙ ЦЕНТР ОДЕЖДЫ, ОБУВИ И АКСЕССУАРОВ МАРКЕТ Методическое объединение учителей математики и информатики
Методическое объединение учителей математики и информатики Немає недосяжної мети
Немає недосяжної мети Презентация на тему Алгоритм построения модели вала в системе КОМПАС
Презентация на тему Алгоритм построения модели вала в системе КОМПАС  Понятие и сущность универсальных учебных действий (УУД)
Понятие и сущность универсальных учебных действий (УУД) Игра Веселый Новый Год
Игра Веселый Новый Год Гонки на тандемах
Гонки на тандемах Бумагорезательное оборудование
Бумагорезательное оборудование Киндер-неваляшки
Киндер-неваляшки Задачи развития речи как комплекс проблем Корзун А.В.
Задачи развития речи как комплекс проблем Корзун А.В. Лазертаг (лазерный пейнтбол)
Лазертаг (лазерный пейнтбол) Международные автомобильные перевозки
Международные автомобильные перевозки Построение перспективы объекта способом сетки (3 способ архитекторов)
Построение перспективы объекта способом сетки (3 способ архитекторов) Опыты в картинках
Опыты в картинках «BioMouse»
«BioMouse» КВН ПО АНГЛИЙСКОМУ ЯЗЫКУ
КВН ПО АНГЛИЙСКОМУ ЯЗЫКУ Облiк основних засобiв i нематерiальних активiв. Амортизація
Облiк основних засобiв i нематерiальних активiв. Амортизація Тема: Повторение «Решение треугольников» Геометрия 9 класс Рублёвская СШ Аккайынский район Прохорова Л.В.
Тема: Повторение «Решение треугольников» Геометрия 9 класс Рублёвская СШ Аккайынский район Прохорова Л.В. «Parallel Pro Control»
«Parallel Pro Control» Муниципальное образовательное учреждение дополнительного образования детей
Муниципальное образовательное учреждение дополнительного образования детей Моделирование работы фундаментов, состоящих из свай, не погруженных до проектных отметок
Моделирование работы фундаментов, состоящих из свай, не погруженных до проектных отметок