Содержание
- 2. Теория Аррениуса Кислота: HCI ⮀ H+ + CI- Основание: NaOH ⮀ Na+ + OH- Амфолит: H2O
- 3. Несоответствие теории Аррениуса CaO + CO2 = CaCO3 HCI(г) + NH3 = NH4CI CH3COOH + H2O
- 4. Протолитическая теория Определение кислоты и основания включает в себя молекулы и ионы, способные принимать и отдавать
- 5. Классификация кислот Нейтральные кислоты (HCI, HNO3, CH3COOH, H2SO4, H3PO4) HCI → H+ + CI- Анионные кислоты
- 6. Классификация оснований Нейтральные (NH3, H2O, C2H5OH) NH3 + H+ → NH4+ H2O + H+ → H3O+
- 7. Сопряженная протолитическая пара HCI + NH3 = CI- + NH4+ HCI – кислота CI- - сопряженное
- 8. Роль растворителя Растворитель влияет на проявление кислотных и основных свойств Протогенный (вода, спирты, уксусная, серная кислоты,
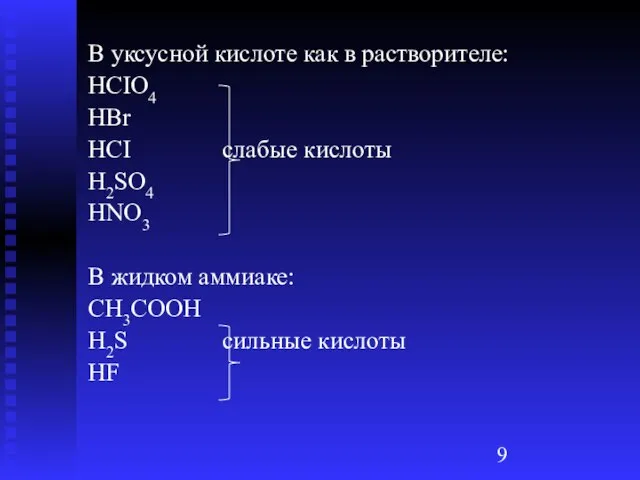
- 9. В уксусной кислоте как в растворителе: HCIO4 HBr HCI слабые кислоты H2SO4 HNO3 В жидком аммиаке:
- 10. Протолитические реакции Диссоциации Нейтрализации Гидролиза
- 11. Диссоциация воды Диссоциация воды H2O ⮀ H3O+ + OH- 2H2O ⮀ H+ + OH- В состоянии
- 12. Ионное произведение воды Величина постоянная для растворов кислот, оснований и солей при постоянной температуре Концентрации [H+]
- 13. Водородный показатель рН = - lg [H+] Если [H+] = 1⋅10-5; рН = -lg 10-5 =
- 14. Кислотность Активная – концентрация ионов водорода в растворе CH3COOH ⮀ H+ + CH3COO- Потенциальная – концентрация
- 15. Значения рН различных сред организма
- 16. Роль активной реакции среды Определяет активность ферментов Действие клеточных мембран Устойчивость коллоидных растворов организма Определение рН
- 17. Методы определения рН Колориметрический – основан на изменении цвета раствора в зависимости от реакции среды. При
- 18. Индикаторы Сложные органические вещества, которые в химическом плане представляют собой слабые кислоты или основания и обладают
- 19. Теория Оствальда HInd – индикатор-кислота IndOH – индикатор-основание HInd ⮀ H+ + Ind- IndOH ⮀ OH-
- 20. Изменение окраски индикатора Метилрот Кислота H+: HInd ← H+ + Ind- красная Основание OH-: HInd →
- 21. Диссоциация индикатора Индикаторы – слабые электролиты [H+][Ind-] Кд = ------------- [HInd] [HInd] [H+] = Кд------------ [Ind-]
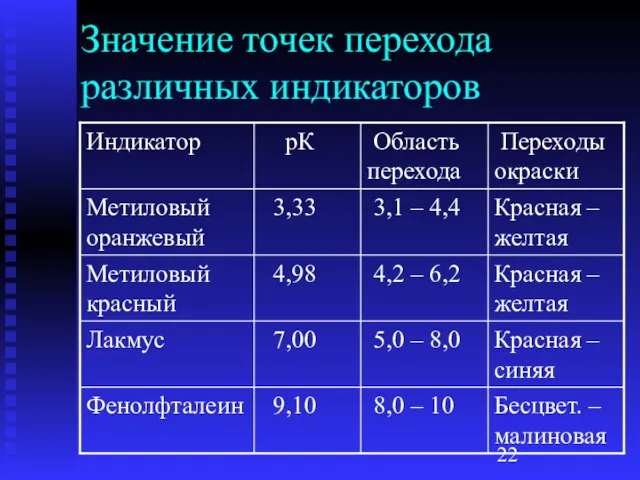
- 22. Значение точек перехода различных индикаторов
- 23. Зона перемены окраски индикатора Та область значений рН, в которой происходит различимое глазом изменение цвета индикатора
- 24. Универсальный индикатор Смеси различных индикаторов с разными, но примыкающими друг к другу или перекрывающими зонами перемены
- 25. Безбуферный метод определения рН (метод Михаэлиса) Основан на использовании набора одноцветных индикаторов нитрофенолового ряда. Окраска исследуемого
- 26. Буферный метод определения рН Основан на сравнении окраски индикатора в исследуемом растворе с цветной шкалой, получаемой
- 28. Скачать презентацию










![Водородный показатель рН = - lg [H+] Если [H+] = 1⋅10-5; рН](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378499/slide-12.jpg)







![Диссоциация индикатора Индикаторы – слабые электролиты [H+][Ind-] Кд = ------------- [HInd] [HInd]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378499/slide-20.jpg)




 Глагол have to
Глагол have to Усі знаки зодіаку
Усі знаки зодіаку Новое свойство квадратных уравнений
Новое свойство квадратных уравнений Бандитизм как социальная опасность
Бандитизм как социальная опасность Декоративно-прикладное искусство в современном мире
Декоративно-прикладное искусство в современном мире Занятие 14
Занятие 14 Недвижимость Санкт-Петербурга и Ленинградской области
Недвижимость Санкт-Петербурга и Ленинградской области Хлеб
Хлеб Музыкальные обработки
Музыкальные обработки Что такое гостиничный бизнес?
Что такое гостиничный бизнес? Анонимные Наркоманы
Анонимные Наркоманы  Презентация на тему Литература 18 века Классицизм в России
Презентация на тему Литература 18 века Классицизм в России  ФГОС ООО: особенности содержания, назначение
ФГОС ООО: особенности содержания, назначение Debaty_v_textovom_formate
Debaty_v_textovom_formate КОМПЬЮТЕР И ВИДЕОКАМЕРА КАК ИНСТРУМЕНТЫ ОБУЧЕНИЯ ФИЗИКЕ
КОМПЬЮТЕР И ВИДЕОКАМЕРА КАК ИНСТРУМЕНТЫ ОБУЧЕНИЯ ФИЗИКЕ Подготовленная аварийная посадка на воду
Подготовленная аварийная посадка на воду Ранняя профилактика социального неблагополучия и жестокого обращения с детьми в семьях
Ранняя профилактика социального неблагополучия и жестокого обращения с детьми в семьях Средства защиты информации
Средства защиты информации The strategic interests of the United States in the Balkans in the late 20th and early 21st centuries
The strategic interests of the United States in the Balkans in the late 20th and early 21st centuries Презентация на тему День победы
Презентация на тему День победы  Праздник Троицы
Праздник Троицы Кодирование информации
Кодирование информации Металлургический комплекс
Металлургический комплекс Финансы бюджетных учреждений
Финансы бюджетных учреждений Презентация1
Презентация1 Будь благословен
Будь благословен Презентация на тему Система и структура трудового права
Презентация на тему Система и структура трудового права  Графический дизайн. Азбука журналистики
Графический дизайн. Азбука журналистики