Содержание
- 2. План Відхилення реальних газів від законів для ідеальних газів. Сили міжмолекулярної взаємодії. Рівняння Ван-дер-Ваальса та його
- 3. Література: 1. Кучерук І.М., Горбачук І.Т., Луцик П.П. Загаль-ний курс фізики: Навч. посібник. – Т.1.: Механіка.
- 4. Відхилення реальних газів від законів для ідеальних газів Експериментально доведено, що закони ідеального газу виконуються при
- 5. Чи можна не враховувати розмір молекул в реальному газі ? Якщо створити тиск в 100 атм,
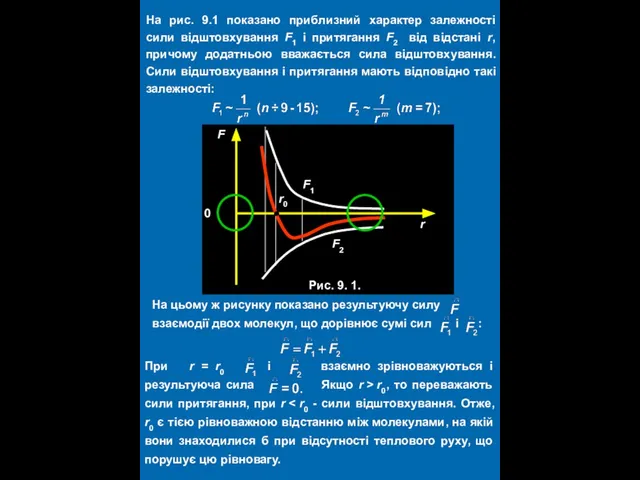
- 6. Сили міжмолекулярної взаємодії При низьких температурах або при високих тисках, коли молекули знаходяться близько одна до
- 7. На цьому ж рисунку показано результуючу силу взаємодії двох молекул, що дорівнює сумі сил і :
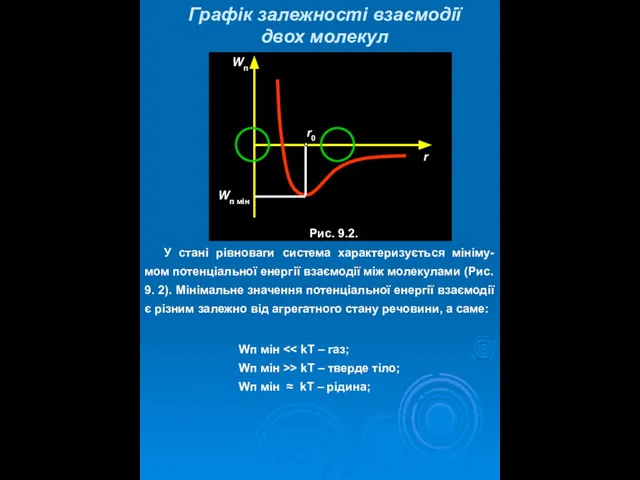
- 8. Графік залежності взаємодії двох молекул У стані рівноваги система характеризується мініму-мом потенціальної енергії взаємодії між молекулами
- 9. Рівняння Ван-дер-Ваальса та його аналіз Вперше врахував вплив молекулярних сил і, користуючись моделлю молекул, як твердих
- 10. Рівняння Ван-дер-Ваальса та його аналіз. Знайдемо значення об’єму b. Уявимо собі посудину в формі куба, об’ємом
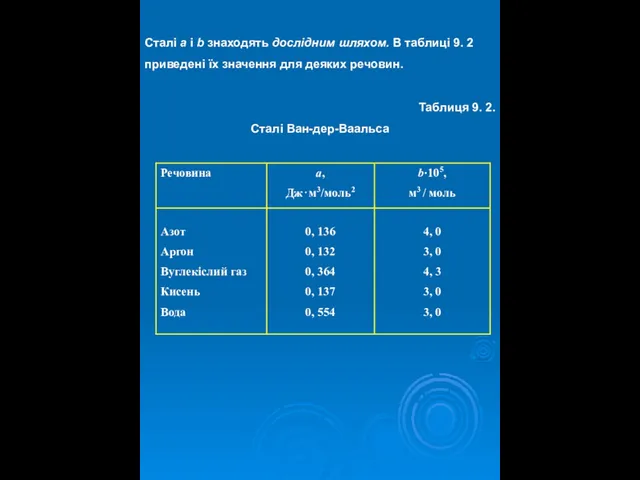
- 13. Сталі a і b знаходять дослідним шляхом. В таблиці 9. 2 приведені їх значення для деяких
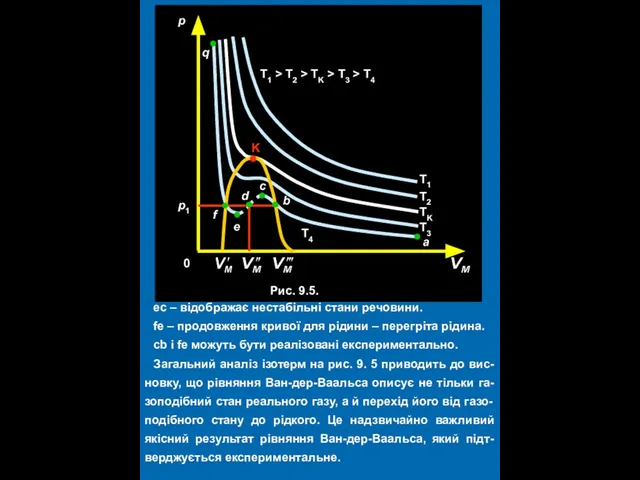
- 15. ес – відображає нестабільні стани речовини. fе – продовження кривої для рідини – перегріта рідина. сb
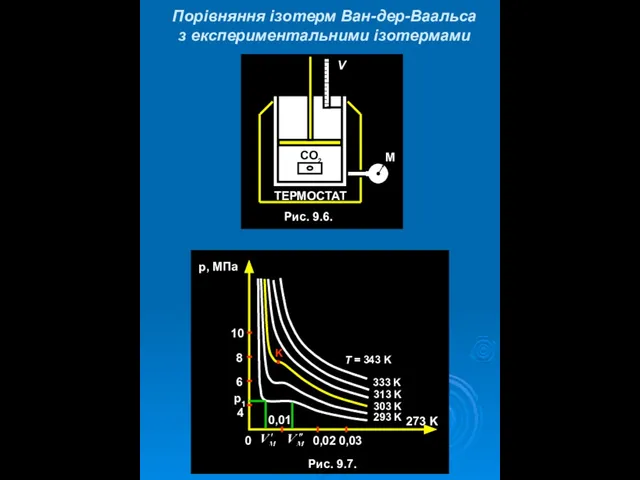
- 16. Порівняння ізотерм Ван-дер-Ваальса з експериментальними ізотермами
- 18. Скачать презентацию










 Фестиваль успехаВыступление 23. 04. 2012
Фестиваль успехаВыступление 23. 04. 2012 Состояние и показатели тренированности спортсмена
Состояние и показатели тренированности спортсмена Состав предметов
Состав предметов Сделаем нашу планету чистой!
Сделаем нашу планету чистой! Стресс – разрушитель нашего организма
Стресс – разрушитель нашего организма Психологическая подготовка боксеров-юношей
Психологическая подготовка боксеров-юношей День Хлеба! 4 класс
День Хлеба! 4 класс Исследовательское обучение учащихся во внеурочной деятельности по ФГОС - презентация для начальной школы_
Исследовательское обучение учащихся во внеурочной деятельности по ФГОС - презентация для начальной школы_ Город-герой Киев
Город-герой Киев ОРГАНИЗАЦИЯ СЛУЖБЫ ЭКСТРАКОРПОРАЛЬНОЙ КОРРЕКЦИИ ГОМЕОСТАЗА ВВ МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ
ОРГАНИЗАЦИЯ СЛУЖБЫ ЭКСТРАКОРПОРАЛЬНОЙ КОРРЕКЦИИ ГОМЕОСТАЗА ВВ МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ The Police in Britain
The Police in Britain Викторина по финансовой грамотности
Викторина по финансовой грамотности Публичный отчёт о работе ГОУ СОШ «Школа здоровья» № 568 за 2009 -2010 учебный год
Публичный отчёт о работе ГОУ СОШ «Школа здоровья» № 568 за 2009 -2010 учебный год Презентация на тему ПРОИСХОЖДЕНИЕ СОЛНЕЧНОЙ СИСТЕМЫ ПЕРВЫЕ РАЗМЫШЛЕНИЯ И НАУЧНОЕ ОБЪЯСНЕНИЕ
Презентация на тему ПРОИСХОЖДЕНИЕ СОЛНЕЧНОЙ СИСТЕМЫ ПЕРВЫЕ РАЗМЫШЛЕНИЯ И НАУЧНОЕ ОБЪЯСНЕНИЕ  Методические проблемы проектирования образовательной среды ВУЗа
Методические проблемы проектирования образовательной среды ВУЗа Подзаконные акты, действующие в сфере туризма
Подзаконные акты, действующие в сфере туризма Информационное обеспечение арбитражных судов и участников судебного процесса
Информационное обеспечение арбитражных судов и участников судебного процесса Народный промысел – Гжель
Народный промысел – Гжель Международный опыт реформы организации управления общественными финансами
Международный опыт реформы организации управления общественными финансами ШКОЛЬНОЕ МЕТОДИЧЕСКОЕ ОБЪЕДИНЕНИЕ УЧИТЕЛЕЙ ТЕХНОЛОГИИ И ЧЕРЧЕНИЯ
ШКОЛЬНОЕ МЕТОДИЧЕСКОЕ ОБЪЕДИНЕНИЕ УЧИТЕЛЕЙ ТЕХНОЛОГИИ И ЧЕРЧЕНИЯ Внутриорганизационные конфликты
Внутриорганизационные конфликты Период развития италийских племён
Период развития италийских племён  Система работы с текстом на уроках русского языка как средство формирования коммуникативной компетентности
Система работы с текстом на уроках русского языка как средство формирования коммуникативной компетентности День Святого Миколая
День Святого Миколая Проект “На одной волне”
Проект “На одной волне” Урок по истории Древнего мира в 5 классе.
Урок по истории Древнего мира в 5 классе. Литургия Преждеосвящённых Даров
Литургия Преждеосвящённых Даров Паломничества и святыни (4 класс)
Паломничества и святыни (4 класс)