Содержание
- 2. Часть А 2009 ГОД – 64,78% 2010 ГОД – 74,53% 2011 ГОД – 70%
- 3. -современные представления о строении атома -общая характеристика неметаллов главных подгрупп 4-7 групп -степень окисления и валентность
- 4. -периодический закон и ПСХЭ Д.И.Менделеева -характерные химические свойства оснований и солей -взаимосвязь неорганических веществ -фактически все
- 5. -химическая связь и строение вещества -классификация неорганических и органических веществ -классификация химических реакций -гидролиз солей -окислительно-восстановительные
- 6. ЧАСТЬ В ВЫПОЛНЕНИЕ ЗАДАНИЙ СОСТАВИЛО ПО ОБЛАСТИ 61,11% РЕКОМЕНДАЦИИ: освоить с учащимися метод «стаканчиков» при решении
- 7. ПРИМЕР1 Определите массы 10%-ного и 50%-го (по массе) растворов, необходимые для получения 200г 20%-го раствора. Х
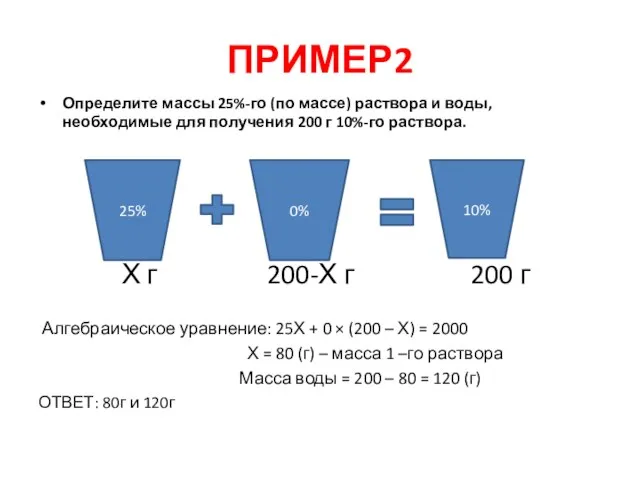
- 8. ПРИМЕР2 Определите массы 25%-го (по массе) раствора и воды, необходимые для получения 200 г 10%-го раствора.
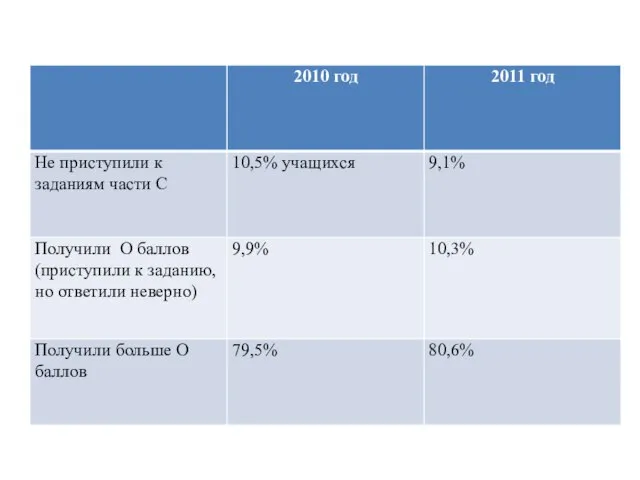
- 9. ЗАДАНИЯ ЧАСТИ С В задании С1 от 1 до 3 баллов набрали более 75,23% (2010г. –
- 10. ЗАДАНИЯ ЧАСТИ С С заданием С2 полностью справились только 9,51% (в 2010г. – 9,15%) выпускников, что
- 11. ЗАДАНИЯ ЧАСТИ С Задание С3 полностью выполнило 22,45% (в2010г. – 10,28%) выпускников. Типичные ошибки при выполнении
- 12. ЗАДАНИЯ ЧАСТИ С Заданием С4 была комбинированная расчетная задача. С заданием справилось полностью 19,2% (в 2010г.
- 13. ЗАДАНИЯ ЧАСТИ С Задания С5 – нахождение молекулярной формулы вещества по данным качественного и количественного анализа.
- 14. РАЗНОВИДНОСТИ ЗАДАЧ НА НАХОЖДЕНИЕ МОЛЕКУЛЯРНОЙ ФОРМУЛЫ ВЕЩЕСТВА. По массовым долям элементов (класс вещества не указан, указаны
- 15. КОДИФИКАТОР 1) перечень элементов содержания, проверяемых на ЕГЭ по химии 2) перечень требований к уровню подготовки
- 16. СПЕЦИФИКАЦИЯ КИМ 1) назначение КИМ ЕГЭ 2) документы, определяющие содержание КИМ ЕГЭ 3) общие подходы к
- 17. ДЕМОНСТРАЦИОННЫЙ ВАРИАНТ КИМ
- 18. Структура КИМ ЕГЭ 2012 года Каждый вариант экзаменационной работы, составлен по единому плану: состоит из трех
- 19. Продолжительность ЕГЭ по химии Примерное время, отводимое на выполнение отдельных заданий, составляет: 1) для каждого задания
- 20. Дополнительные материалы и оборудование К каждому варианту экзаменационной работы прилагаются следующие материалы: − Периодическая система химических
- 21. Изменения в КИМ ЕГЭ 2012 г. по сравнению с 2011 г. А3 А3 А4
- 22. А18 А17 А19
- 23. ПРИМЕР ЗАДАНИЯ С-2 2011 ГОДА С 2.1 Даны растворы четырех веществ: KNO2, HBr, Cl2, KMnO4. Напишите
- 24. ПРИМЕР ЗАДАНИЯ С-2 2012 ГОДА С 2.2 Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный
- 25. ЗАДАНИЕ С-5 составление схемы химической реакции определение стехиометрических соотношений реагирующих веществ вычисления на их основе, приводящие
- 26. ПРИМЕР ЗАДАНИЯ С-5 2012 ГОДА C5 В результате полной дегидратации предельного одноатомного спирта массой 11,1 г
- 28. C1 Используя метод электронного баланса, составьте уравнение реакции: I2 + K2S03+ ... → K2SO4 + ...
- 29. Задание С 4 (расчетная задача) Медь массой 6,4 г обработали 100 мл 30%- ного раствора азотной
- 30. ПРИМЕР ЗАДАНИЙ В 5 ПРОШЛЫХ ЛЕТ Установите соответствие между реагирующими веществами и продуктами реакций. РЕАГИРУЮЩИЕ ВЕЩЕСТВА
- 31. ПРИМЕР ЗАДАНИЯ В 5 2012 ГОДА B5 Установите соответствие между сложным веществом и простыми веществами, с
- 32. ЧАСТЬ С ДИАГНОСТИЧЕСКОГО ВАРИАНТА ЕГЭ 2012 г. С 1. Используя метод электронного баланса, составьте уравнение реакции:
- 33. С 2 Оксид меди (2) нагревали в токе угарного газа. Полученное вещество сожгли в атмосфере хлора.
- 34. С 3 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: t0, кат. Cl2,6000C KOH,H2O,t
- 35. С 4 При нагревании 11,9г бромида калия и 147г 10% фосфорной кислоты выделился газ, который был
- 37. Скачать презентацию































 Расчет дуговой сталеплавильной печи емкостью 60 т, кислый процесс
Расчет дуговой сталеплавильной печи емкостью 60 т, кислый процесс Развитие умения писать большую букву в именах сказочных героев
Развитие умения писать большую букву в именах сказочных героев Презентація Івкової Ольги ФГН-1,філологія, група 2
Презентація Івкової Ольги ФГН-1,філологія, група 2 Обособление несогласованных определений
Обособление несогласованных определений Источник_опасностей_и_причины_их_возникновения
Источник_опасностей_и_причины_их_возникновения Результати першого випуску за програмою підготовки Школа професійного розвитку інженерів-конструкторів
Результати першого випуску за програмою підготовки Школа професійного розвитку інженерів-конструкторів фрейм_12 ур
фрейм_12 ур Южная Америка. Знакомство с живым миром
Южная Америка. Знакомство с живым миром Отряд Мозоленогие. Верблюды
Отряд Мозоленогие. Верблюды Фотодело. Работы Татаевой Карины
Фотодело. Работы Татаевой Карины Материнство глазами художников
Материнство глазами художников Соединение деталей шурупами
Соединение деталей шурупами ПРОБЛЕМЫ АДАПТАЦИИ ПЯТИКЛАССНИКОВ
ПРОБЛЕМЫ АДАПТАЦИИ ПЯТИКЛАССНИКОВ Herbst
Herbst Рост беларусской интернет-аудитории за 2010 год
Рост беларусской интернет-аудитории за 2010 год Электронная математическая газета Анисовка-Сити
Электронная математическая газета Анисовка-Сити Презентация на тему 1 декабря – День Первого Президента Казахстана
Презентация на тему 1 декабря – День Первого Президента Казахстана Ткацкие переплетения
Ткацкие переплетения Открытка ко Дню Учителя
Открытка ко Дню Учителя Класса неорганических соединений
Класса неорганических соединений Автострахование Каско
Автострахование Каско Презентация на тему 22 июня 1941 год
Презентация на тему 22 июня 1941 год Системы энергоснабжения на основе тепловых труб для объектов АПК
Системы энергоснабжения на основе тепловых труб для объектов АПК Вера, Надежда, Любовь и мать их София
Вера, Надежда, Любовь и мать их София В ателието на художника част 2 Изобразително изкуство (Л. Ангелова, П. Легкоступ) 4 клас
В ателието на художника част 2 Изобразително изкуство (Л. Ангелова, П. Легкоступ) 4 клас Роллеты от
Роллеты от STM
STM Игровые технологии в процессе психологического сопровождения ребенка в школе
Игровые технологии в процессе психологического сопровождения ребенка в школе