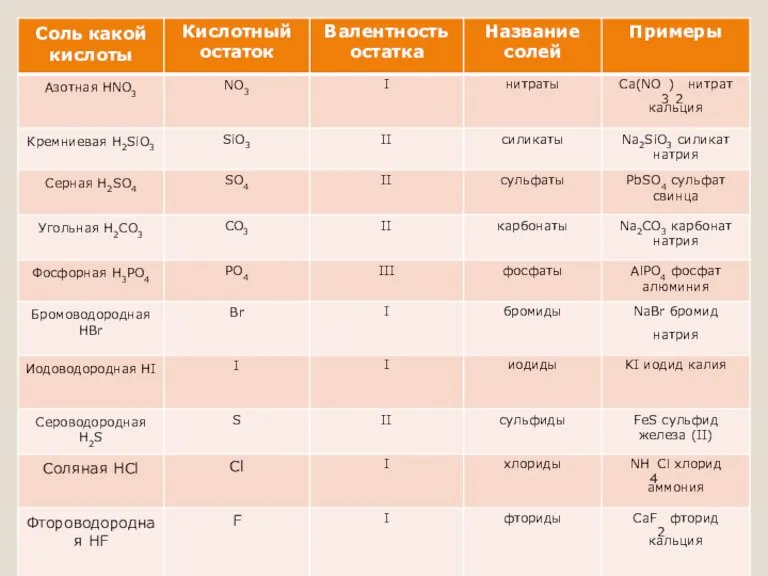
Слайд 3Соли-…
Соли – вещества, состоящие из атомов металла и кислотного остатка

Слайд 7Типы солей
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на

атомы металла. Пример.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример.
Осно́вные соли — гидроксогруппы основания (OH-) частично замещены кислотными остатками. Пример.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример.
Смешанные соли — в их составе присутствует два различных аниона. Пример.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример.
Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Слайд 9Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли

взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
Некоторые соли разлагаются при нагревании:
Слайд 11Применение солей
Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и

хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.
Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Слайд 12Применение солей
Соли серной кислоты. В строительстве и в медицине широко используют полуводный

гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Слайд 13Применение солей
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в

сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.











 Этика делового общения
Этика делового общения Информационная технология хранения данных
Информационная технология хранения данных Центр AFT представляет
Центр AFT представляет Решения компании «Электронные архивы Украины»
Решения компании «Электронные архивы Украины» В.В. Растрелли
В.В. Растрелли Все согласны
Все согласны Политическая система общества
Политическая система общества Осторожно: ядовитые растения
Осторожно: ядовитые растения dog breeds
dog breeds Фракталы))
Фракталы)) Мототакси. Особенности и преимущества
Мототакси. Особенности и преимущества занятие6 Азалия
занятие6 Азалия Геннадий Михасенко «Кандаурские мальчишки»
Геннадий Михасенко «Кандаурские мальчишки» Презентация на тему Антарктида, история открытия и исследования
Презентация на тему Антарктида, история открытия и исследования Пушкин в Лицее
Пушкин в Лицее СОЛСТИК РЕВАЙВ Solstic Revive
СОЛСТИК РЕВАЙВ Solstic Revive  МЕЖДУНАРОДНЫЙ ЖУРНАЛ О МОБИЛЬНОЙ ТЕХНИКЕ
МЕЖДУНАРОДНЫЙ ЖУРНАЛ О МОБИЛЬНОЙ ТЕХНИКЕ Районное методическое объединение классных руководителей Нормативно-законодательная база ученического самоуправления
Районное методическое объединение классных руководителей Нормативно-законодательная база ученического самоуправления kochetkova
kochetkova Пятно как средство выражения. Композиция, как ритм пятна
Пятно как средство выражения. Композиция, как ритм пятна Метан и его свойства
Метан и его свойства Презентация на тему Защита окружающей среды
Презентация на тему Защита окружающей среды Презентация на тему История государственных символов России
Презентация на тему История государственных символов России Тепловизор
Тепловизор Положительные и отрицательные числа
Положительные и отрицательные числа Chopaev Islam 8(3) Класс
Chopaev Islam 8(3) Класс Рекомендации по заполнению технологической карты межведомственного взаимодействия (ТКМВ)
Рекомендации по заполнению технологической карты межведомственного взаимодействия (ТКМВ) Movie Quiz
Movie Quiz