Содержание
- 2. ПЛАН Свойства твердого состояния вещества. Строение кристаллов. Типы кристаллических решеток. Упаковка атомов в кристаллах. Аморфное состояние
- 3. Твердое тело сохраняет и свою форму и свой объем, т.к. молекулы или атомы в кристаллах не
- 4. кристаллические вещества состоят из огромного количества очень маленьких кристалликов, имеющих абсолютно одинаковое строение. кристаллические вещества характеризуются
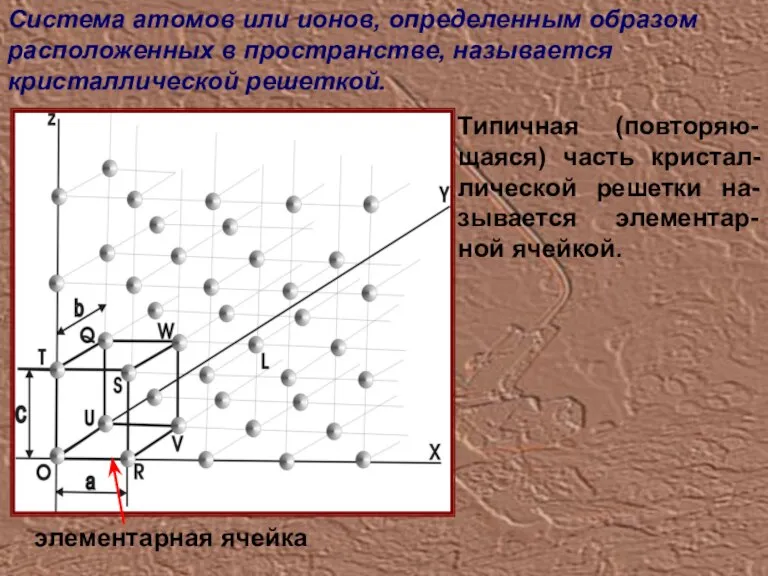
- 5. Система атомов или ионов, определенным образом расположенных в пространстве, называется кристаллической решеткой. Типичная (повторяю-щаяся) часть кристал-лической
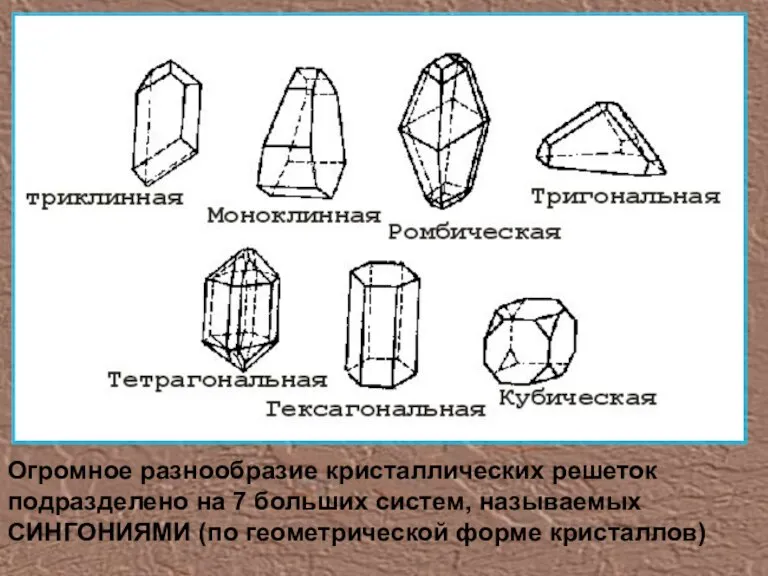
- 6. Огромное разнообразие кристаллических решеток подразделено на 7 больших систем, называемых СИНГОНИЯМИ (по геометрической форме кристаллов)
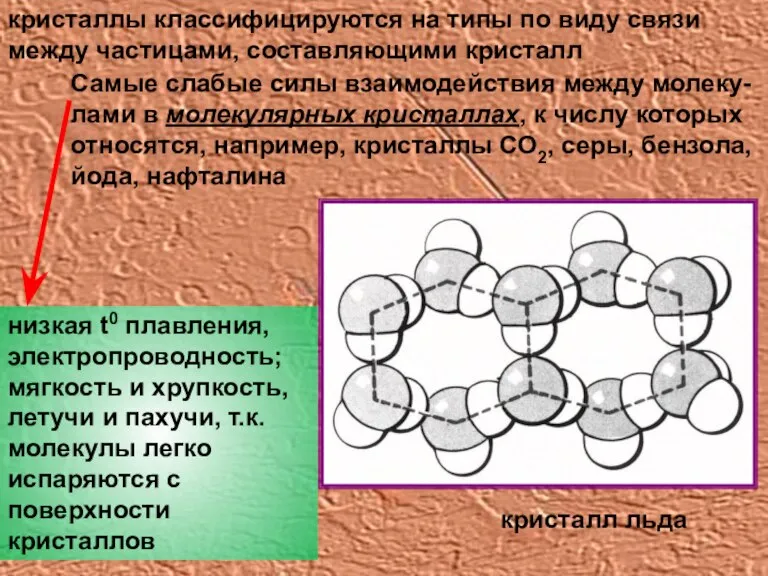
- 7. кристаллы классифицируются на типы по виду связи между частицами, составляющими кристалл Самые слабые силы взаимодействия между
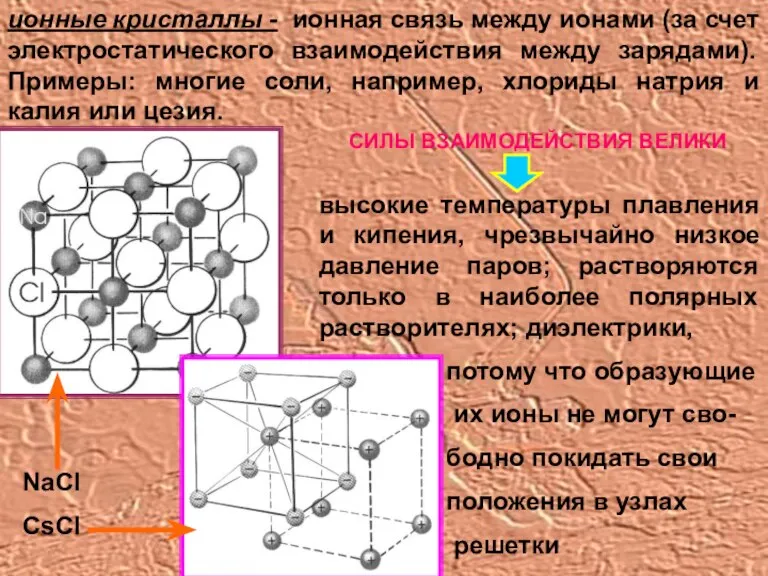
- 8. ионные кристаллы - ионная связь между ионами (за счет электростатического взаимодействия между зарядами). Примеры: многие соли,
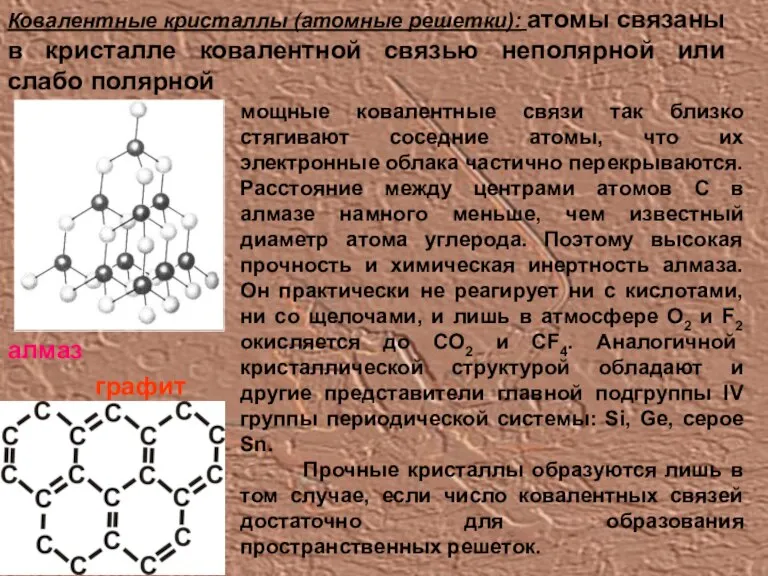
- 9. Ковалентные кристаллы (атомные решетки): атомы связаны в кристалле ковалентной связью неполярной или слабо полярной мощные ковалентные
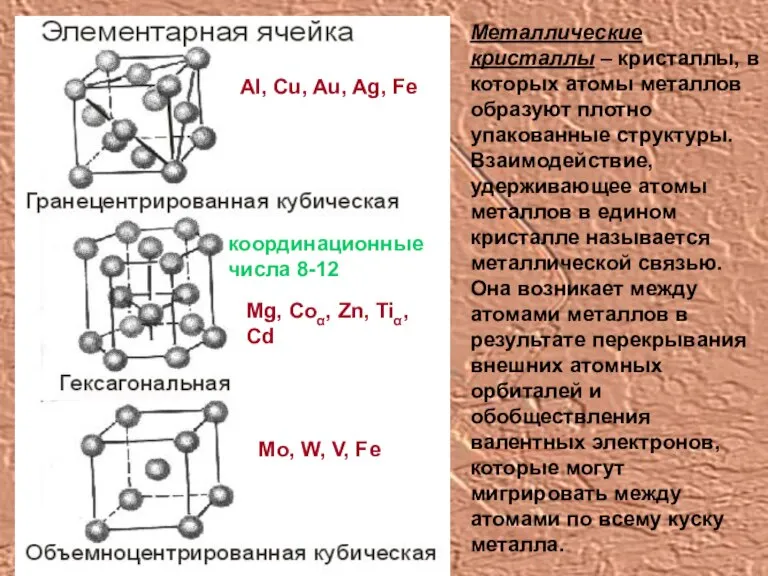
- 10. Металлические кристаллы – кристаллы, в которых атомы металлов образуют плотно упакованные структуры. Взаимодействие, удерживающее атомы металлов
- 11. Взаимосвязь между положением металлов в ПСЭ и их кристаллическим строением
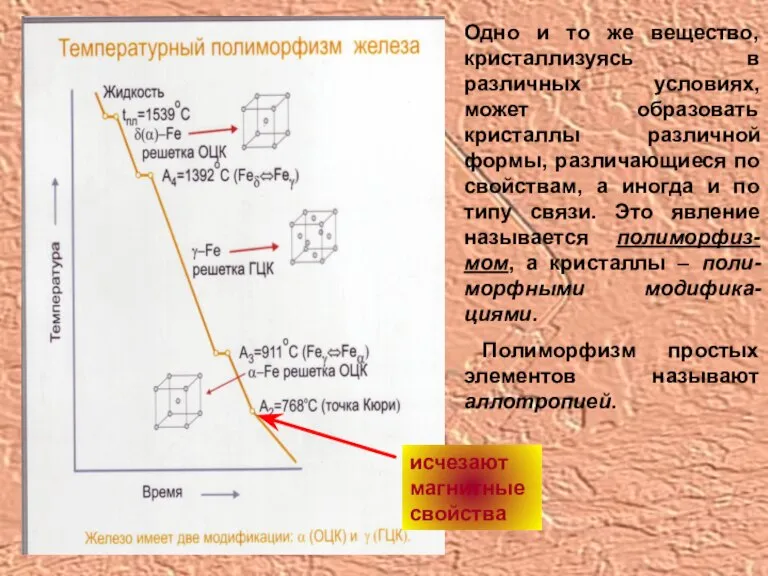
- 12. Одно и то же вещество, кристаллизуясь в различных условиях, может образовать кристаллы различной формы, различающиеся по
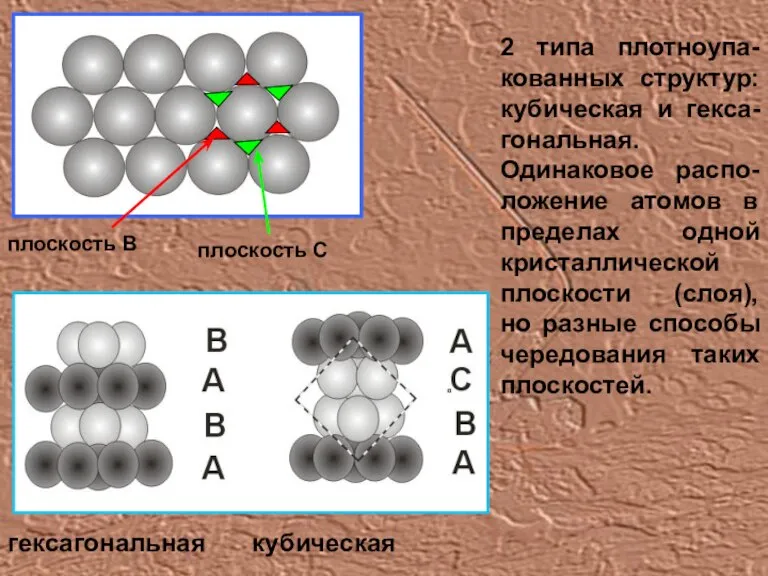
- 13. 2 типа плотноупа-кованных структур: кубическая и гекса-гональная. Одинаковое распо-ложение атомов в пределах одной кристаллической плоскости (слоя),
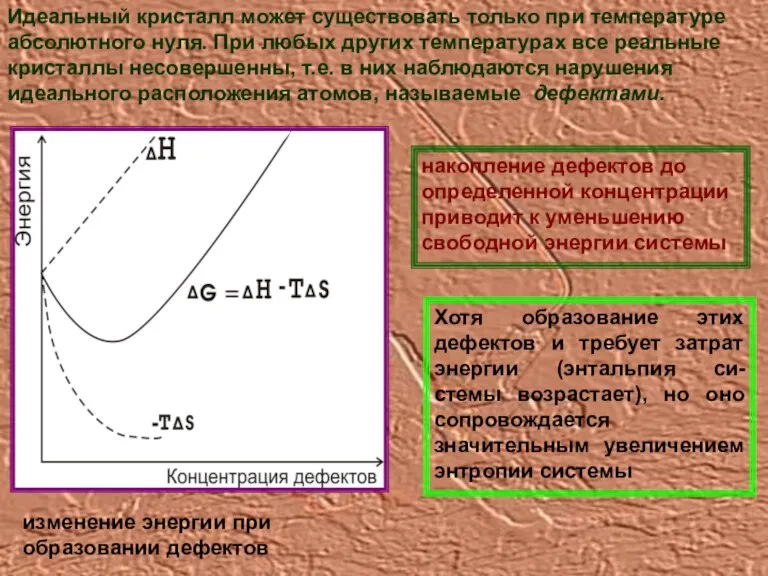
- 14. Идеальный кристалл может существовать только при температуре абсолютного нуля. При любых других температурах все реальные кристаллы
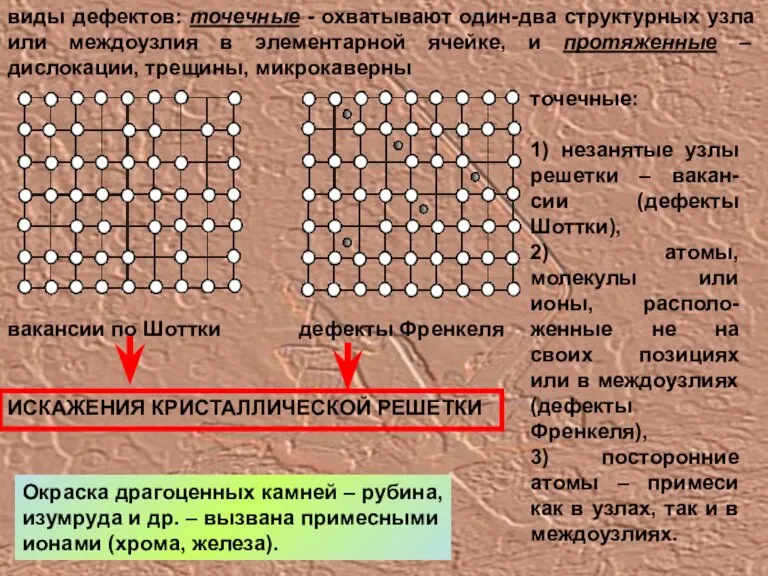
- 15. виды дефектов: точечные - охватывают один-два структурных узла или междоузлия в элементарной ячейке, и протяженные –
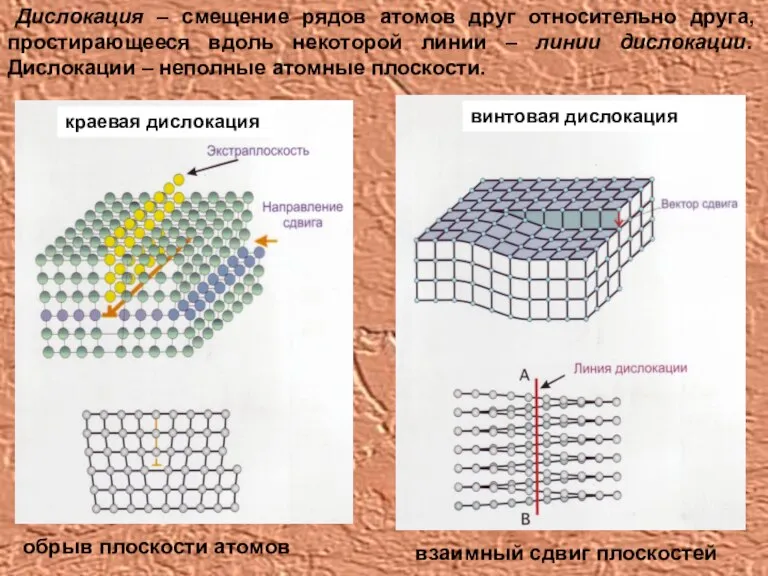
- 16. Дислокация – смещение рядов атомов друг относительно друга, простирающееся вдоль некоторой линии – линии дислокации. Дислокации
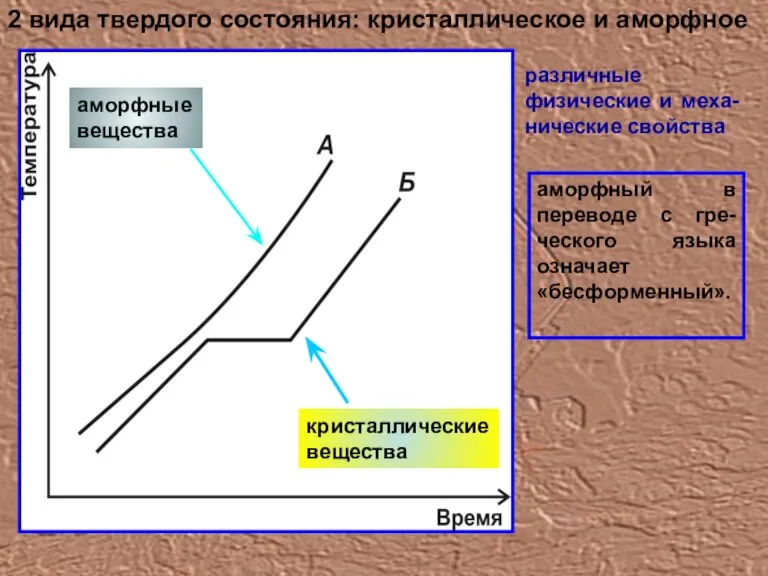
- 17. аморфный в переводе с гре-ческого языка означает «бесформенный». 2 вида твердого состояния: кристаллическое и аморфное различные
- 19. Скачать презентацию




 Философские проблемы социо-гуманитарного знания Типология гуманитарного знания
Философские проблемы социо-гуманитарного знания Типология гуманитарного знания Окружающий мир 4 класс
Окружающий мир 4 класс Система передачи данных по силовым кабельным линиям
Система передачи данных по силовым кабельным линиям Особенности приема документов в ПК ПДВ 3.0
Особенности приема документов в ПК ПДВ 3.0 Операторы в Turbo Pascal
Операторы в Turbo Pascal Дата город Место проведения
Дата город Место проведения Строение и свойства географической оболочки. Круговорот веществ и энергии
Строение и свойства географической оболочки. Круговорот веществ и энергии Плоскость. Прямая. Луч.
Плоскость. Прямая. Луч. Презентация на тему Политический процесс в России весной-летом 1917 г
Презентация на тему Политический процесс в России весной-летом 1917 г  Третий путь продолжается
Третий путь продолжается Психологические причины трудного поведения младших школьников
Психологические причины трудного поведения младших школьников Половое воспитание дошкольников
Половое воспитание дошкольников Click to edit Master title style Click to edit Master subtitle style
Click to edit Master title style Click to edit Master subtitle style  Водоёмы родного края
Водоёмы родного края Работа с таблицами
Работа с таблицами ANIMALS at the FARM
ANIMALS at the FARM Самые необычные деньги разных стран мира
Самые необычные деньги разных стран мира Технологии организации самостоятельной работы
Технологии организации самостоятельной работы В мире много сказок...
В мире много сказок... Представления древних народов о форме Земли
Представления древних народов о форме Земли Адресаты любовной лирики
Адресаты любовной лирики Цифровые образовательные ресурсы
Цифровые образовательные ресурсы Как возникла Земля
Как возникла Земля Модуль A: основы работы электропривода
Модуль A: основы работы электропривода Презентация Партии
Презентация Партии История праздника 8 марта
История праздника 8 марта Формы размножения организмов
Формы размножения организмов Презентация на тему звёздное небо 1 класс
Презентация на тему звёздное небо 1 класс