Содержание
- 2. Цель работы: Установление закономерностей механизма и кинетики ионного переноса в твердофазных электрохимических системах металл | твердый
- 3. Химические формулы и названия органических полупроводников (298 К) 3
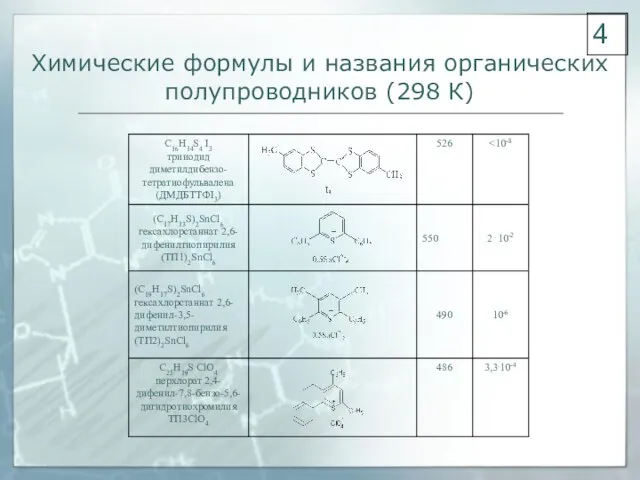
- 4. Химические формулы и названия органических полупроводников (298 К) 4
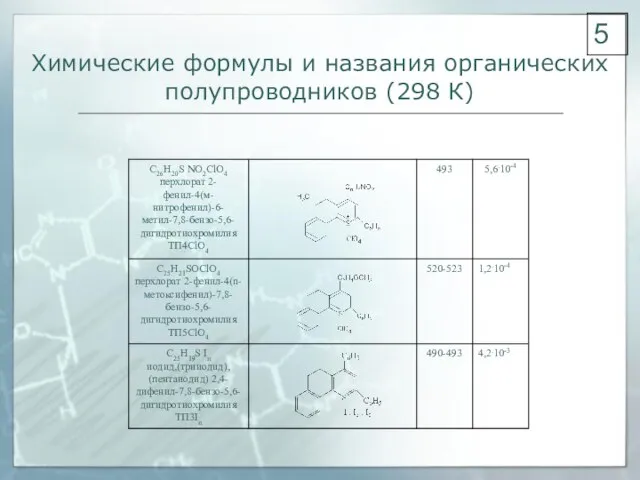
- 5. Химические формулы и названия органических полупроводников (298 К) 5
- 6. Химические формулы и названия органических полупроводников (298 К) 6 ТКЦ - 3,3-диэтилтиокарбоцианин; ТЦХМ - 7,7`,8,8`-тетрацианохиноиметан; ТФ
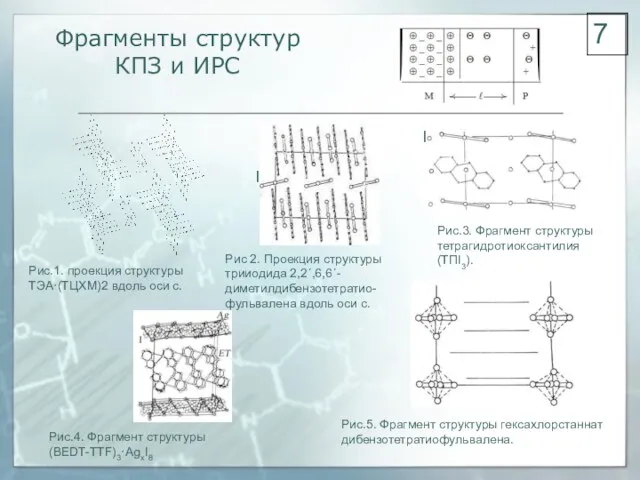
- 7. Фрагменты структур КПЗ и ИРС Рис.1. проекция структуры ТЭА·(ТЦХМ)2 вдоль оси с. Рис.3. Фрагмент структуры тетрагидротиоксантилия
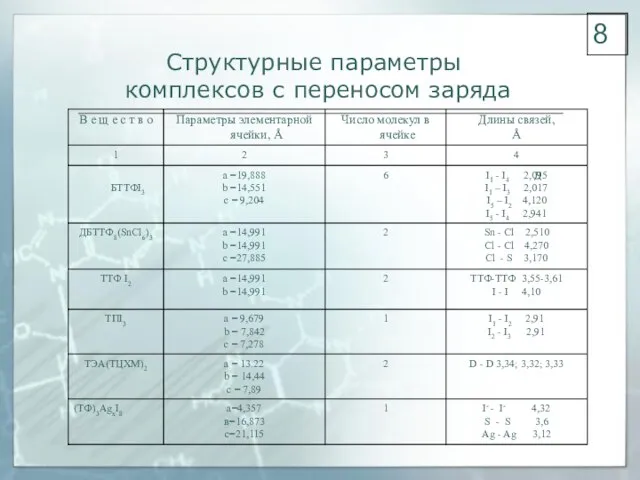
- 8. Структурные параметры комплексов с переносом заряда 8
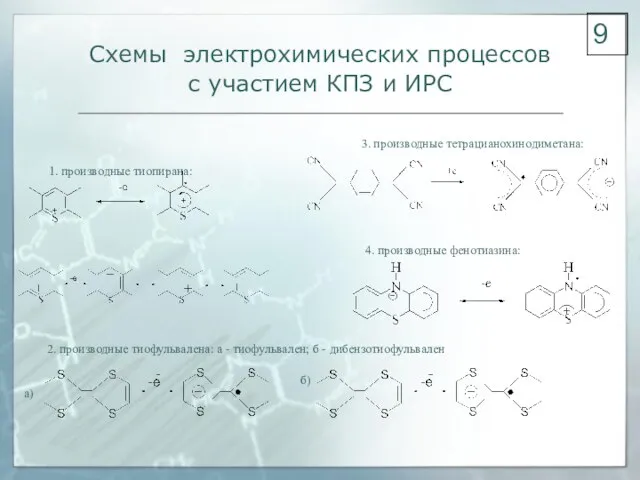
- 9. Схемы электрохимических процессов с участием КПЗ и ИРС 1. производные тиопирана: 2. производные тиофульвалена: а -
- 10. Уравнения температурной зависимости э.д.с. систем Na|Na+-β-Al2O3 | йодный КПЗ 10 1 2
- 11. Энергия Гиббса и направленность химических реакций в системе: Na|β-Аl2O3|I2;С Состав β-глинозема: Na2O·5Al2O3·0,1TiO2·0,8CoO. Энергия Гиббса образования NaI,
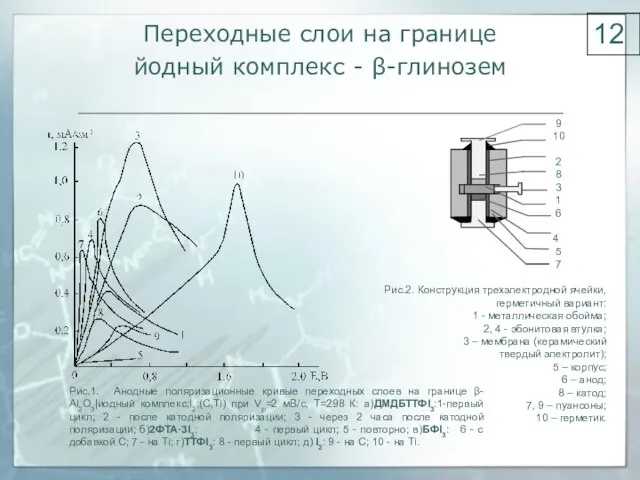
- 12. Переходные слои на границе йодный комплекс - β-глинозем Рис.1. Анодные поляризационные кривые переходных слоев на границе
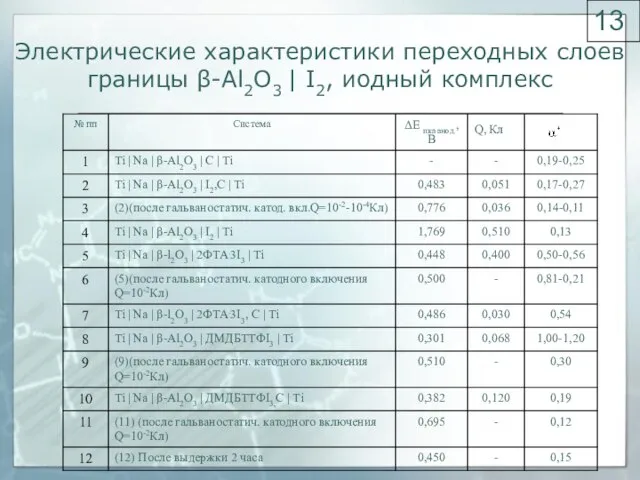
- 13. Электрические характеристики переходных слоев границы β-Al2O3 | I2, иодный комплекс Q, Кл 13
- 14. Поляризационные кривые границы: а: ФТАI3 / β-Al2O3; б, в: ДМДБТТФIх / β-Al2O3 а б в а
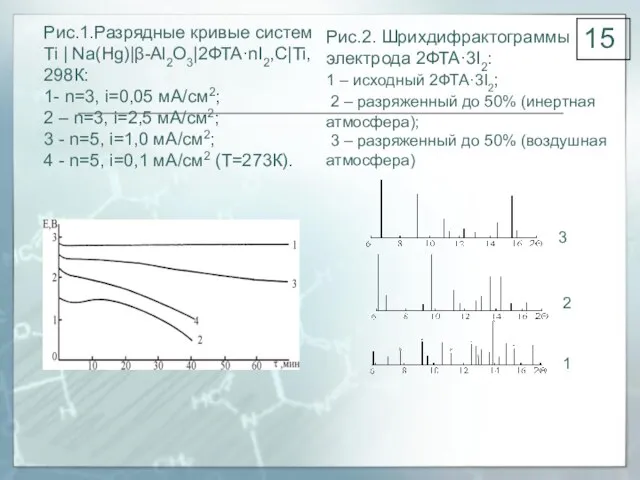
- 15. Рис.2. Шрихдифрактограммы электрода 2ФТА·3I2: 1 – исходный 2ФТА·3I2; 2 – разряженный до 50% (инертная атмосфера); 3
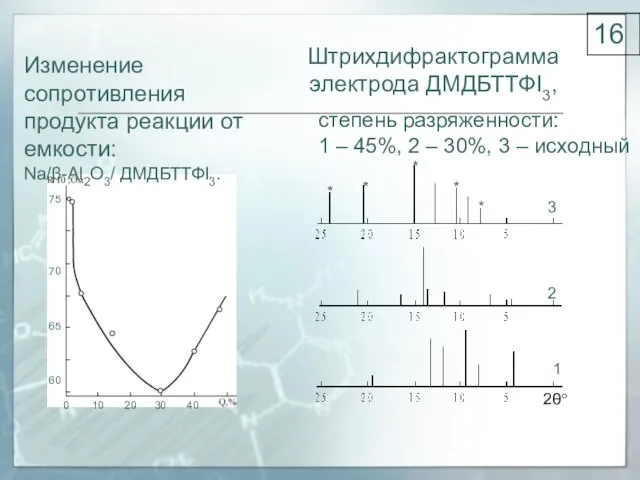
- 16. Изменение сопротивления продукта реакции от емкости: Na/β-Al2O3/ ДМДБТТФI3. 75 70 65 60 0 10 20 30
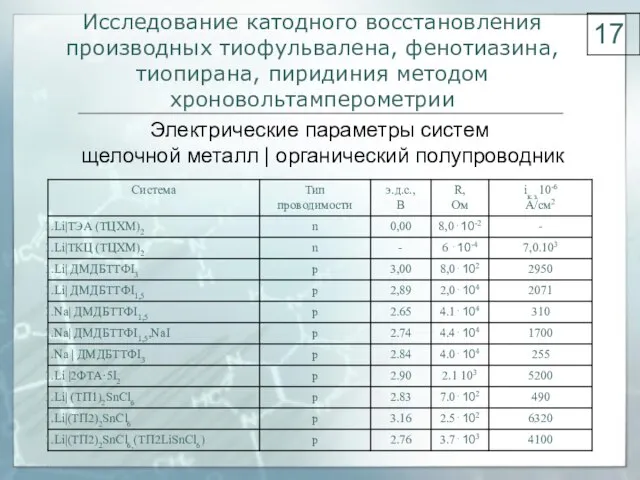
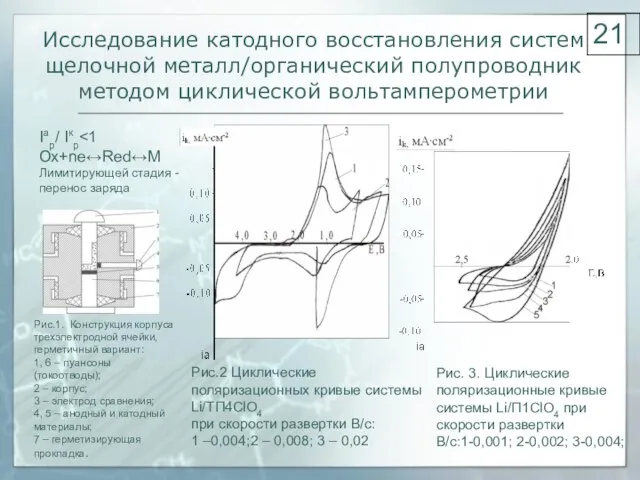
- 17. Исследование катодного восстановления производных тиофульвалена, фенотиазина, тиопирана, пиридиния методом хроновольтамперометрии Электрические параметры систем щелочной металл |
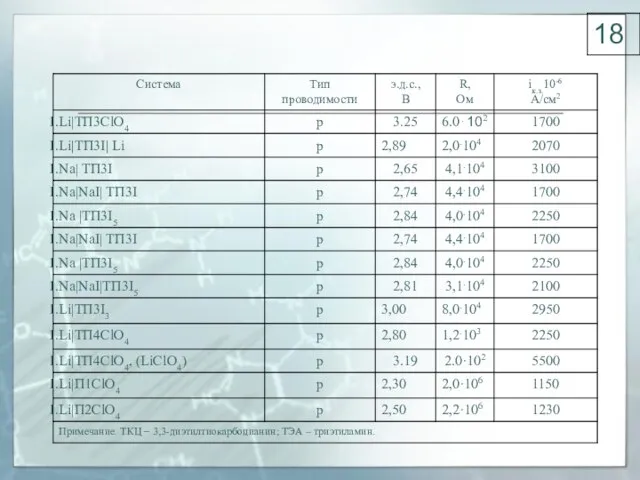
- 18. 18
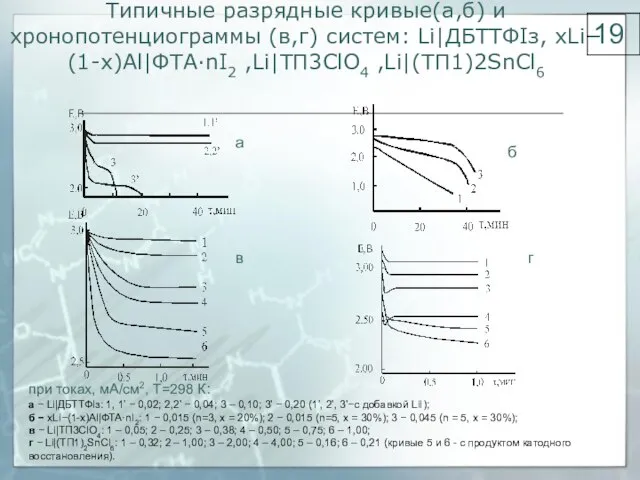
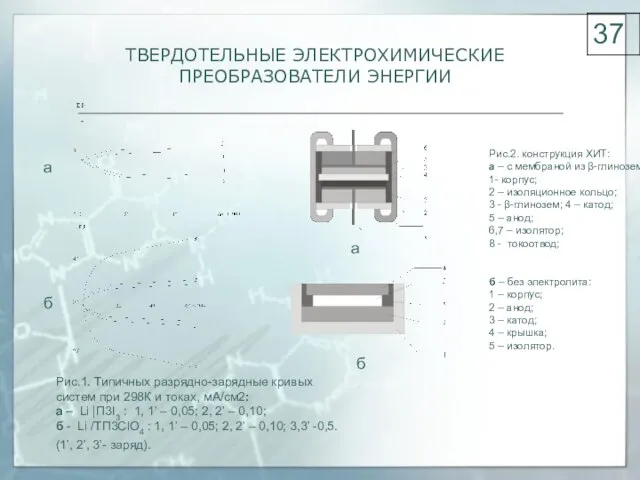
- 19. Типичные разрядные кривые(а,б) и хронопотенциограммы (в,г) систем: Li|ДБТТФIз, xLi−(1-х)Аl|ФТА·nI2 ,Li|ТП3ClO4 ,Li|(ТП1)2SnCl6 при токах, мА/см2, Т=298 К:
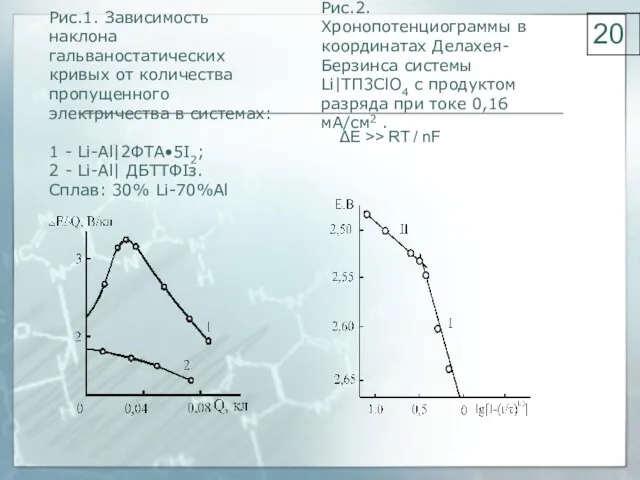
- 20. Рис.1. Зависимость наклона гальваностатических кривых от количества пропущенного электричества в системах: 1 - Li-Al|2ФTA•5I2; 2 -
- 21. Исследование катодного восстановления систем щелочной металл/органический полупроводник методом циклической вольтамперометрии Рис.2 Циклические поляризационных кривые системы Li/ТП4СlO4
- 22. Рис. 1. Зависимость константы скорости электрохимической реакции от потенциала системы Li|БФIз . Рис.2. Приложимость уравнения Ерофеева-Колмогорова-Аврами
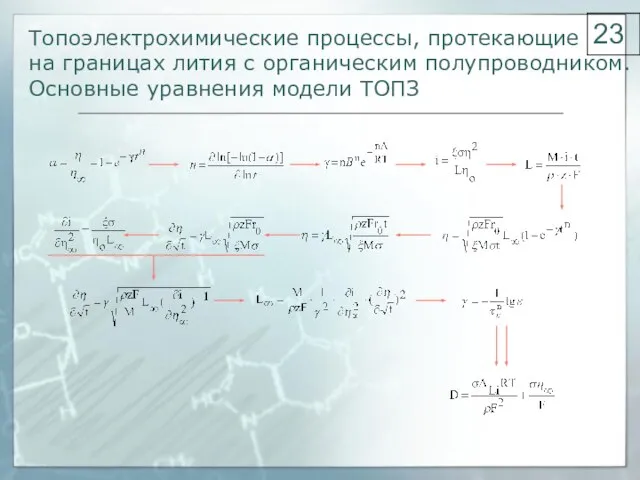
- 23. Топоэлектрохимические процессы, протекающие на границах лития с органическим полупроводником. Основные уравнения модели ТОПЗ 23
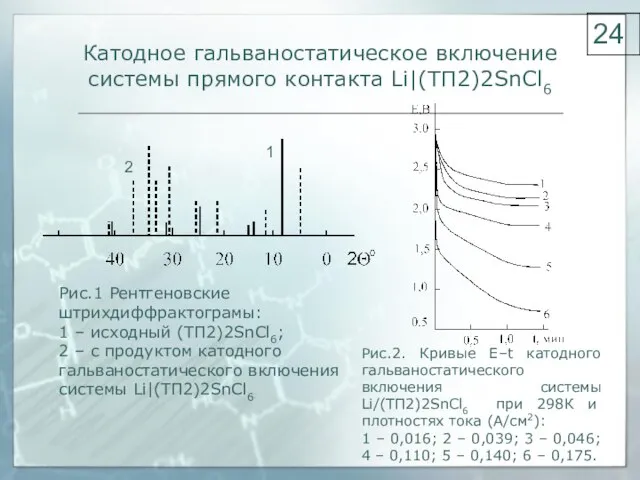
- 24. Катодное гальваностатическое включение системы прямого контакта Li|(ТП2)2SnCl6 Рис.1 Рентгеновские штрихдиффрактограмы: 1 – исходный (ТП2)2SnCl6; 2 –
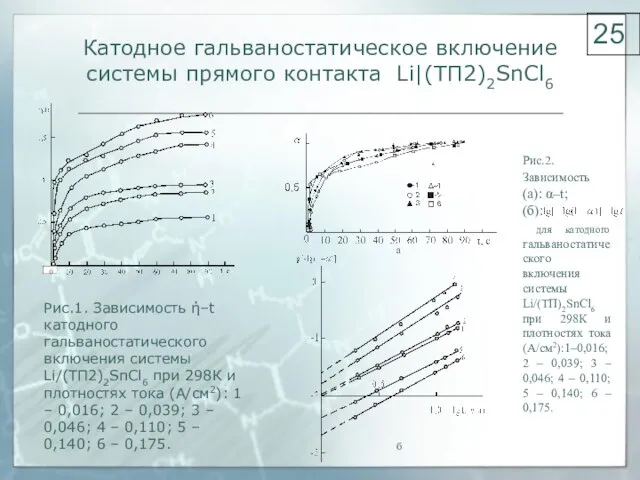
- 25. Катодное гальваностатическое включение системы прямого контакта Li|(ТП2)2SnCl6 Рис.1. Зависимость ή–t катодного гальваностатического включения системы Li/(ТП2)2SnCl6 при
- 26. Катодное гальваностатическое включение системы прямого контакта Li|(ТП2)2SnCl6 Рис.1. Зависимость стационарной толщины слоя переходной интерфазы от плотности
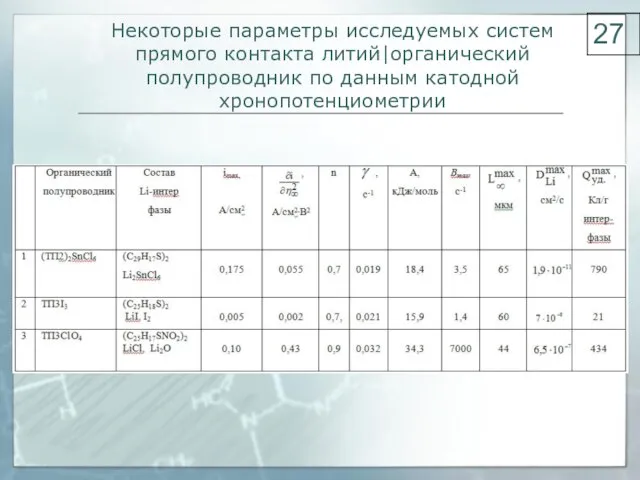
- 27. Некоторые параметры исследуемых систем прямого контакта литий|органический полупроводник по данным катодной хронопотенциометрии 27
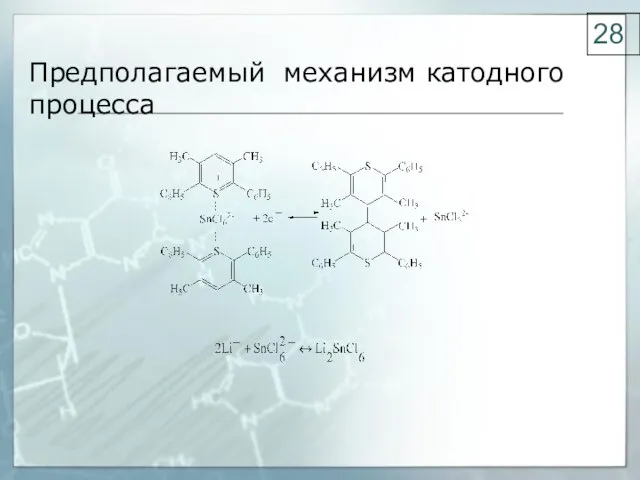
- 28. Предполагаемый механизм катодного процесса 28
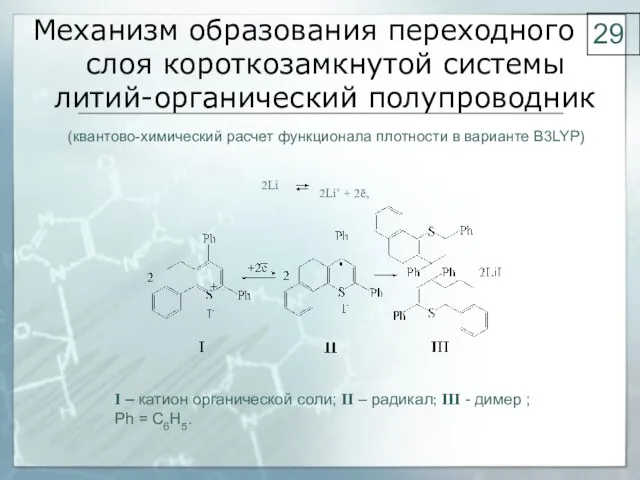
- 29. Механизм образования переходного слоя короткозамкнутой системы литий-органический полупроводник 2Li 2Li+ + 2ē, (квантово-химический расчет функционала плотности
- 30. Температурная зависимость электропроводности (σ0) синтезированных продуктов 30
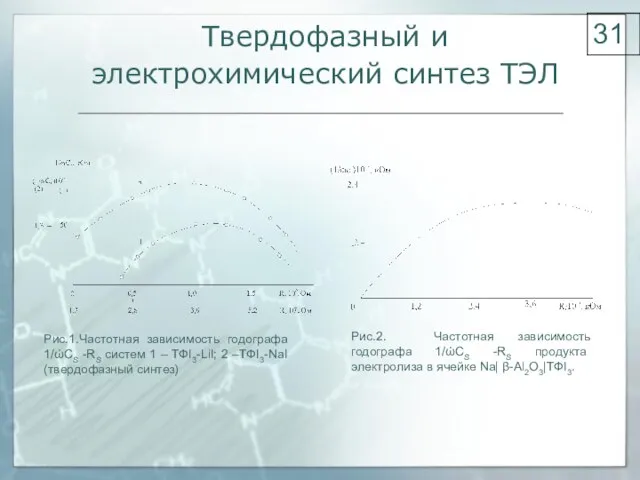
- 31. Твердофазный и электрохимический синтез ТЭЛ Рис.2. Частотная зависимость годографа 1/ώCS -RS продукта электролиза в ячейке Na|
- 32. Параметры общей (σобщ.) и электронной (σе) проводимостей продуктов электрохимических реакций короткозамкнутых систем (298 К) 32
- 33. Рис.1. Изменение сопротивления во времени при твердофазном синтезе (Т=298 К) в системах: 1 – LiI -ТПI;
- 34. Схемы механизмов реакций [R Me+] + MeA (I) R+A- + Me [R Me+]A- ; R -
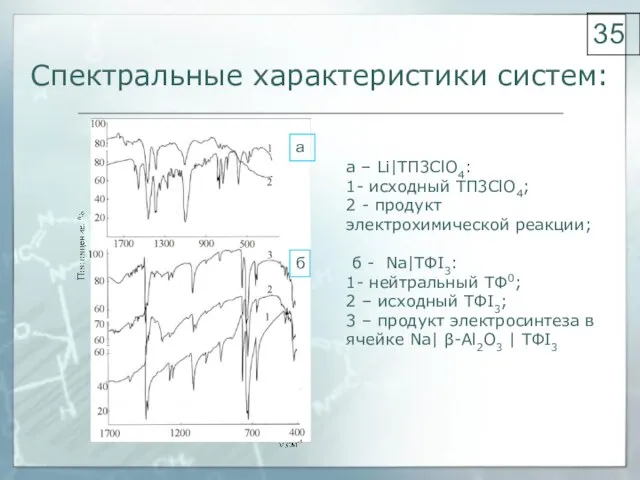
- 35. Спектральные характеристики систем: а – Li|ТП3ClO4: 1- исходный ТП3ClО4; 2 - продукт электрохимической реакции; б -
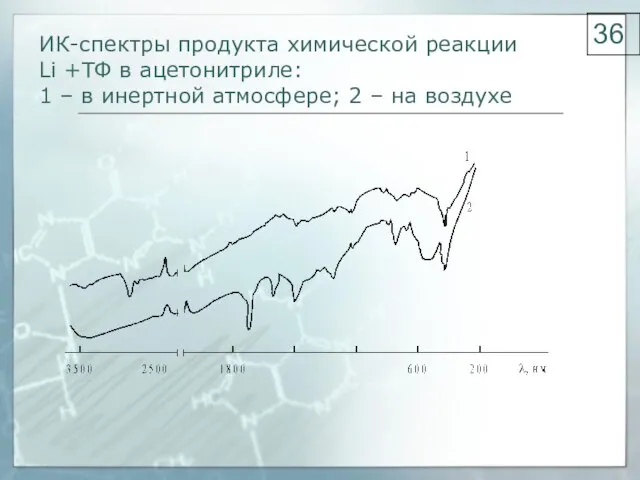
- 36. ИК-спектры продукта химической реакции Li +ТФ в ацетонитриле: 1 – в инертной атмосфере; 2 – на
- 37. ТВЕРДОТЕЛЬНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ ЭНЕРГИИ Рис.2. конструкция ХИТ: а – с мембраной из β-глинозема: 1- корпус; 2
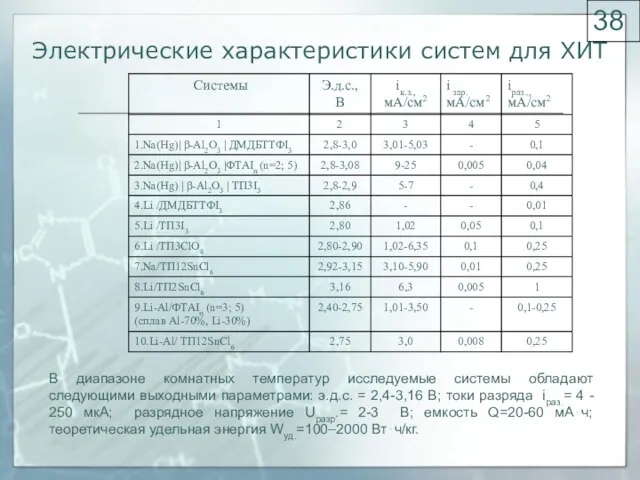
- 38. Электрические характеристики систем для ХИТ В диапазоне комнатных температур исследуемые системы обладают следующими выходными параметрами: э.д.с.
- 40. Скачать презентацию











![Схемы механизмов реакций [R Me+] + MeA (I) R+A- + Me [R](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/385297/slide-33.jpg)
 Презентация на тему Формирование современной образовательной инфраструктуры: новые подходы, модели
Презентация на тему Формирование современной образовательной инфраструктуры: новые подходы, модели Алканы
Алканы ЦКП «Курчатовский центр синхротронного излучения и нанотехнологий (КЦСИиНТ)»
ЦКП «Курчатовский центр синхротронного излучения и нанотехнологий (КЦСИиНТ)» Глобальные экологические проблемы
Глобальные экологические проблемы Кастинг телеведущих
Кастинг телеведущих ЦЕНТР ОБРАЗОВАНИЯ №2045
ЦЕНТР ОБРАЗОВАНИЯ №2045 Презентация на тему Исследовние функций мозга. Физиология мозгового ствола
Презентация на тему Исследовние функций мозга. Физиология мозгового ствола  Выполнение вышивки двусторонней гладью
Выполнение вышивки двусторонней гладью Презентация на тему Числовые выражения 6-7 класс
Презентация на тему Числовые выражения 6-7 класс  ОБУЧЕНИЕ РАБОТАЮЩЕГО НАСЕЛЕНИЯ
ОБУЧЕНИЕ РАБОТАЮЩЕГО НАСЕЛЕНИЯ Аренда. Определение, понятие и юридическая характеристика договора аренды
Аренда. Определение, понятие и юридическая характеристика договора аренды Урок русского языка в 5 классе
Урок русского языка в 5 классе МОУ«Основная общеобразовательная школа № 3» г. Оренбурга 2008-2009
МОУ«Основная общеобразовательная школа № 3» г. Оренбурга 2008-2009 Презентация проекта по теме: «Творческий портрет М.Танаевой»
Презентация проекта по теме: «Творческий портрет М.Танаевой» Мы за все в ответе…
Мы за все в ответе… Презентация на тему Атомная энергетика и ее экологические проблемы
Презентация на тему Атомная энергетика и ее экологические проблемы Основы информатики и программирования
Основы информатики и программирования Теория фирмы и теория транзакционных издержек
Теория фирмы и теория транзакционных издержек Портфолио
Портфолио Естественный отбор и его формы
Естественный отбор и его формы Физическая культура в наших семьях
Физическая культура в наших семьях Презентация на тему Дети блокадного Ленинграда
Презентация на тему Дети блокадного Ленинграда Совещание 29 марта 2012 года Исполнение действующего законодательства и нормативных актов при предоставлении платных образователь
Совещание 29 марта 2012 года Исполнение действующего законодательства и нормативных актов при предоставлении платных образователь Задачи на вычисление импульса тела.
Задачи на вычисление импульса тела. Мини волейбол в школе
Мини волейбол в школе Физкультурно-оздоровительная работа детского сада
Физкультурно-оздоровительная работа детского сада Слова, которые имеют общую часть и общее значение, называются родственными
Слова, которые имеют общую часть и общее значение, называются родственными ПЛОТНИКОВА ЕЛЕНА ВЛАДИМИРОВНА
ПЛОТНИКОВА ЕЛЕНА ВЛАДИМИРОВНА