Содержание
- 2. План урока: 1. Почему алюминий так нужен человеку? 2. Алюминий как химический элемент: а) положение в
- 3. Почему алюминий так нужен человеку? Запишите три характерных свойства алюминия, благодаря которым металл широко применяется в
- 4. Алюминий как химический элемент: а) положение в периодической системе и строение атома; 1. Химический знак (металл
- 5. - Al (металл) Ar= 27 -13 III Нечётный III А Алюминий как химический элемент: а) положение
- 6. Металлические Mg>Al 3 13 ē нет 3 +13
- 7. Алюминий как химический элемент: б) нахождение в природе. Li,K,Ba,Ca,Na,Mg,Al,Mn,Cr,Zn,Fe,Co,Sn,Pb,H2,Cu,Hg,Au Рассмотрите диаграмму. Сделайте вывод о распространенности алюминия
- 8. Алюминий как химический элемент: б) нахождение в природе. Алюминий в природе встречается в виде алюмосиликатов, боксита,
- 9. Алюминий как простое вещество: а) физические свойства (общие и индивидуальные); Возьмите алюминиевую проволоку, рассмотрите ее, попробуйте
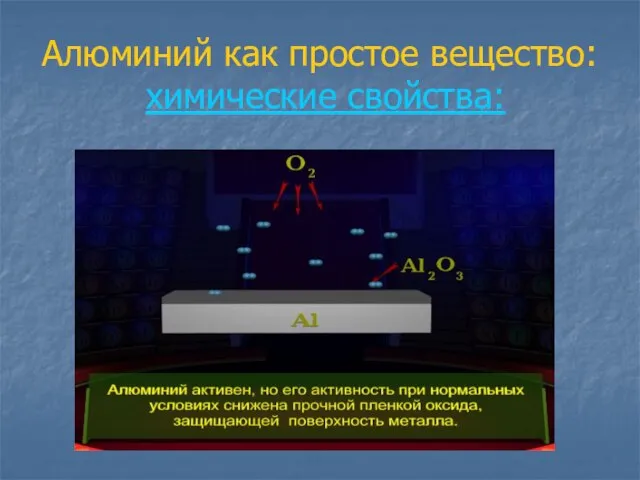
- 10. Алюминий как простое вещество: химические свойства:
- 11. Алюминий как простое вещество: химические свойства: -Взаимодействие с простыми веществами (О2, Br2 , S); 1. 2Аl
- 12. Алюминий как простое вещество: химические свойства: -Взаимодействие со сложными веществами (H2O, кислотой, щелочью); 2Al+6HСl=2АlCl3+3H2
- 13. Алюминий как простое вещество: получение.
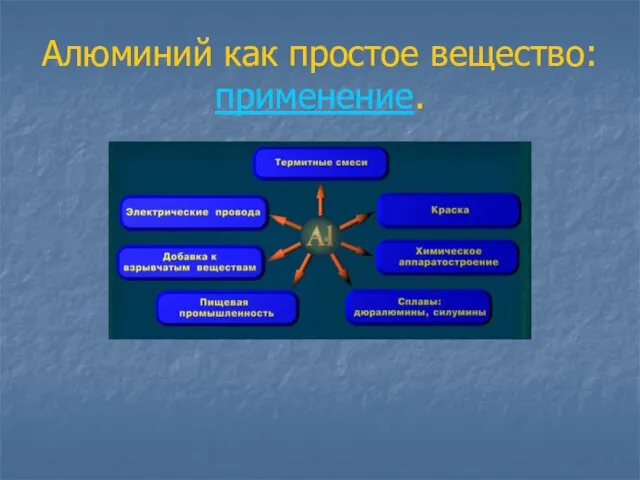
- 14. Алюминий как простое вещество: применение.
- 16. Скачать презентацию











 Главные члены предложения
Главные члены предложения Презентация на тему Автостат
Презентация на тему Автостат  Целевые показатели при реализации мероприятий по формированию современных механизмов в дополнительном образовании детей
Целевые показатели при реализации мероприятий по формированию современных механизмов в дополнительном образовании детей Мастер-класс
Мастер-класс Экоклуб Друзей WWF и Природного парка Зона покоя Укок ИРБИЗЕК
Экоклуб Друзей WWF и Природного парка Зона покоя Укок ИРБИЗЕК ДЕТИ ВОЕННОЙ ПОРЫ
ДЕТИ ВОЕННОЙ ПОРЫ Класс Птицы
Класс Птицы ВКР: Реставрация секретера
ВКР: Реставрация секретера Древние Соборы
Древние Соборы Основания отказа в возбуждении уголовного дела. Подготовила: Студентка юридического факультета Учебной группы Ю-113б Кочеткова Е
Основания отказа в возбуждении уголовного дела. Подготовила: Студентка юридического факультета Учебной группы Ю-113б Кочеткова Е Натуральный каучук
Натуральный каучук Элементы ландшафтного дизайна
Элементы ландшафтного дизайна Введение
Введение Botanical Effects
Botanical Effects Радуга
Радуга Learn to read maps
Learn to read maps Диаграмма связей MindMap. Инфографика. Лекция 3
Диаграмма связей MindMap. Инфографика. Лекция 3 Prezentatsia_dlya_vvodnogo_uroka_v_10_klasse_Russkiy_yazyk_v_sovremennom_mire
Prezentatsia_dlya_vvodnogo_uroka_v_10_klasse_Russkiy_yazyk_v_sovremennom_mire Федеральный государственный образовательный стандарт начального общего образования по литературному чтению
Федеральный государственный образовательный стандарт начального общего образования по литературному чтению Еволюція BMW
Еволюція BMW Политические партии
Политические партии агро-туры
агро-туры Русский язык3 класс
Русский язык3 класс Деление с остатком Головкова Анастасия
Деление с остатком Головкова Анастасия Михайловская Елена Викторовна
Михайловская Елена Викторовна Москва – центр борьбы с ордынским владычеством
Москва – центр борьбы с ордынским владычеством Разновидности колон
Разновидности колон Восточный базар
Восточный базар