Содержание
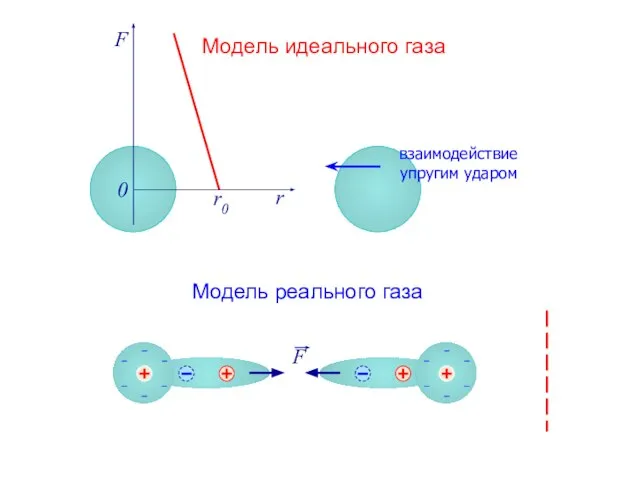
- 2. F r r0 0 Модель идеального газа Модель реального газа взаимодействие упругим ударом
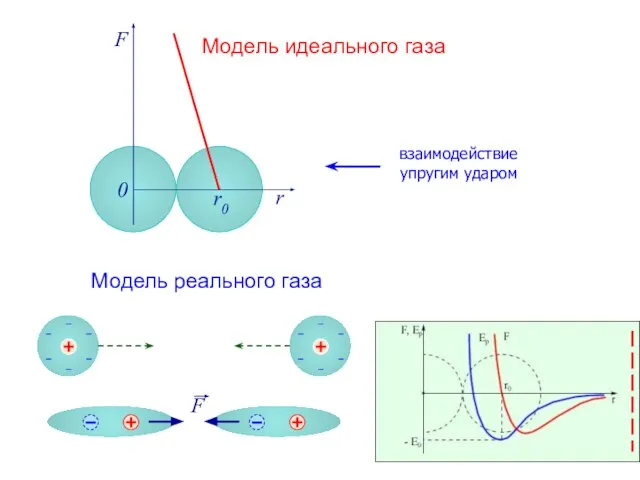
- 3. F r r0 0 Модель идеального газа Модель реального газа взаимодействие упругим ударом
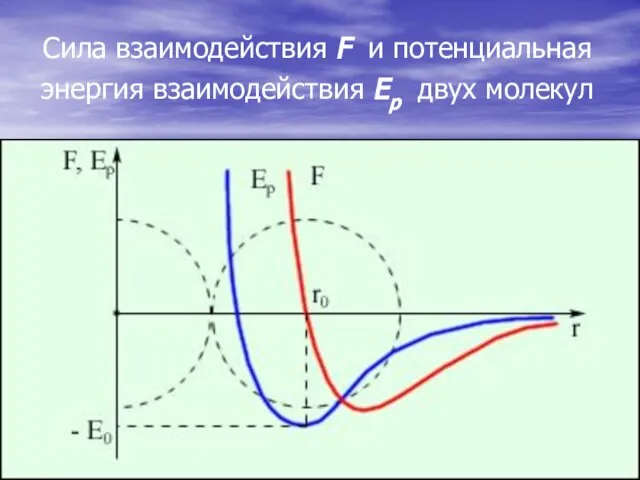
- 4. Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул
- 5. Модель Ван-дер-Ваальса Уравнение Ван-дер-Ваальса Ван-дер-Ваальс (van der Waals) Ян (1837 – 1923) Модель идеального газа:
- 6. Тема 5. Реальные газы. Жидкости. Твердые тела §5.2. Конденсация реального газа. Изотермы Ван-дер-Ваальса
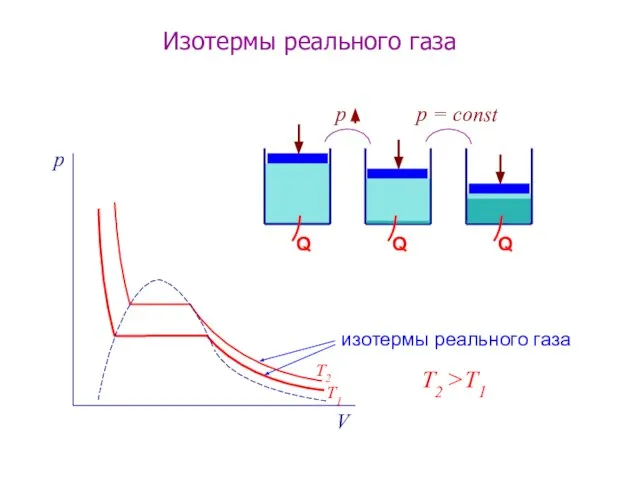
- 7. изотермы реального газа р = const Изотермы реального газа T2 >T1
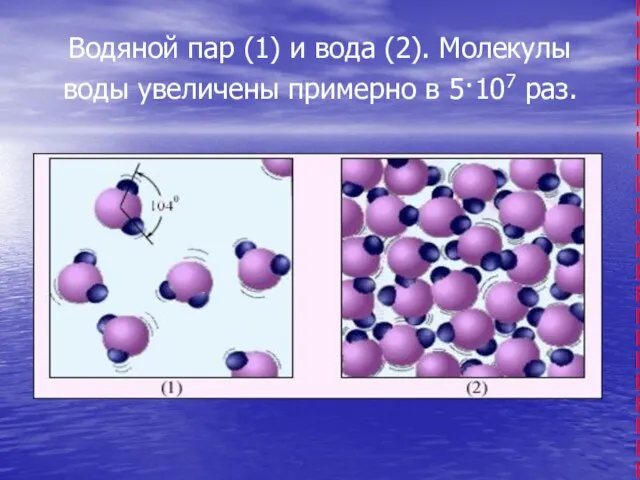
- 8. Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5·107 раз.
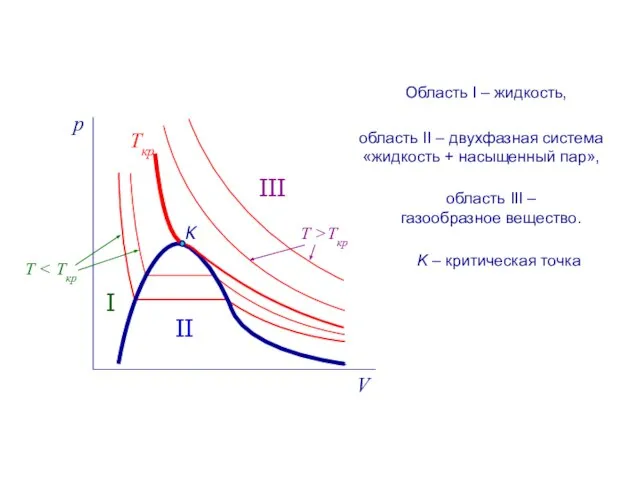
- 9. Ткр K I II III область II – двухфазная система «жидкость + насыщенный пар», Область I
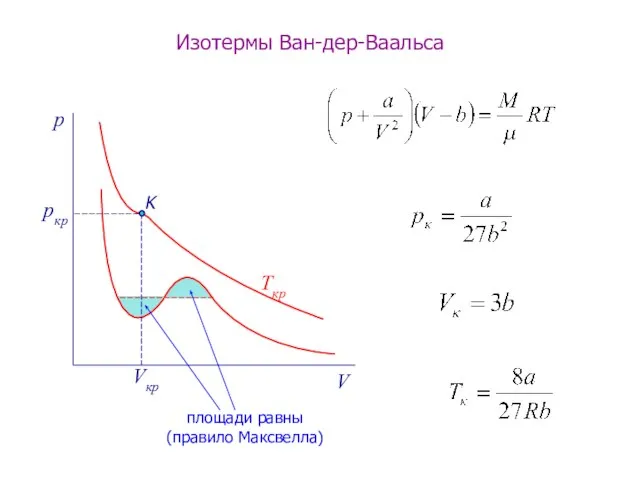
- 10. p V pкр Vкр Ткр Изотермы Ван-дер-Ваальса K площади равны (правило Максвелла)
- 11. Тема 5. Реальные газы. Жидкости . Твердые тела §5.3. Область двухфазных состояний. Равновесие фаз. Критическое состояние
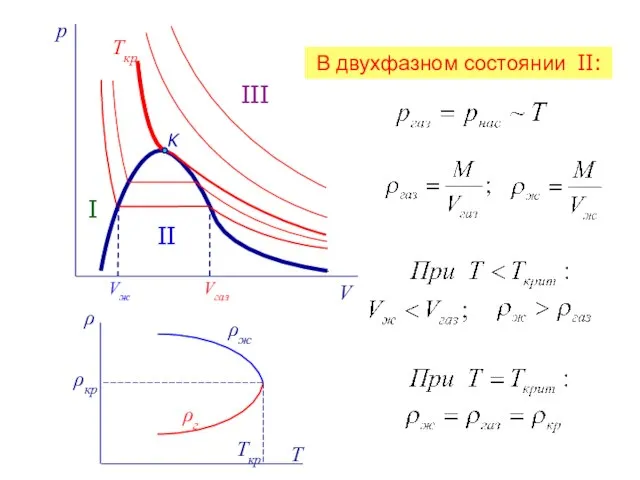
- 12. Ткр K I II III Tкр ρкр ρж ρг В двухфазном состоянии II:
- 13. Тема 5. Реальные газы. Жидкости . Твердые тела §5.4. Область двухфазных состояний. Уравнение Клапейрона-Клаузиуса
- 14. Определение: теплота, идущая на изменение фазового состояния вещества, называется теплотой фазового превращения или скрытой теплотой перехода
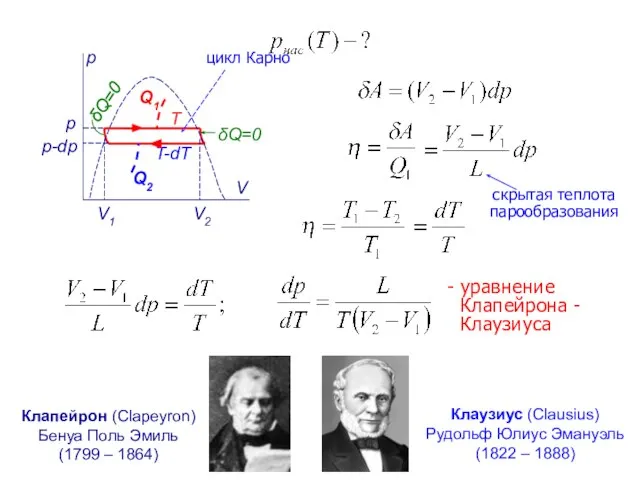
- 15. p V V1 V2 p p-dp δQ=0 δQ=0 T T-dT Q2 Q1 - уравнение Клапейрона -
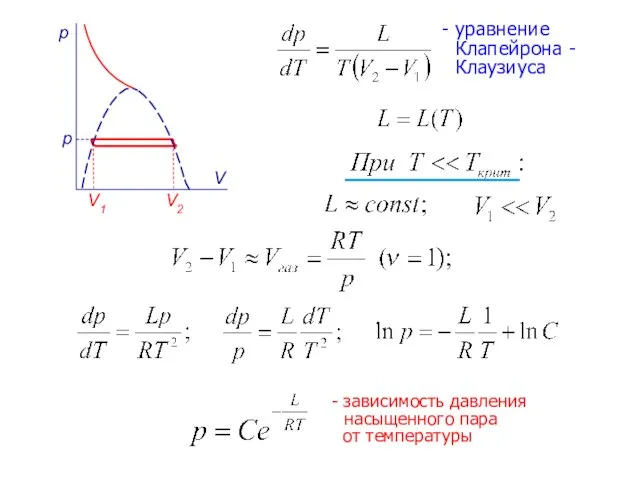
- 16. - уравнение Клапейрона - Клаузиуса - зависимость давления насыщенного пара от температуры
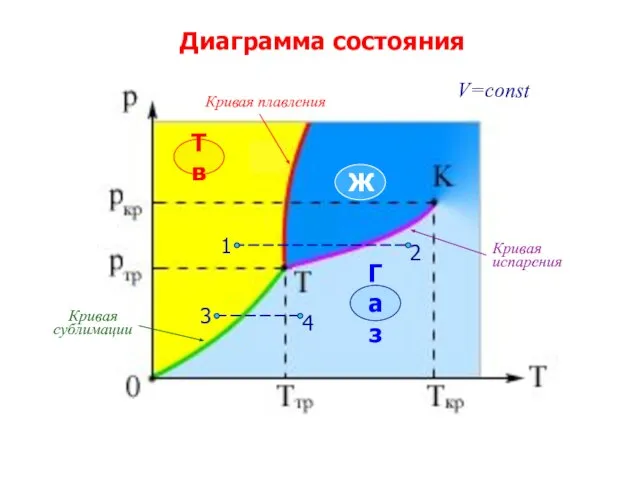
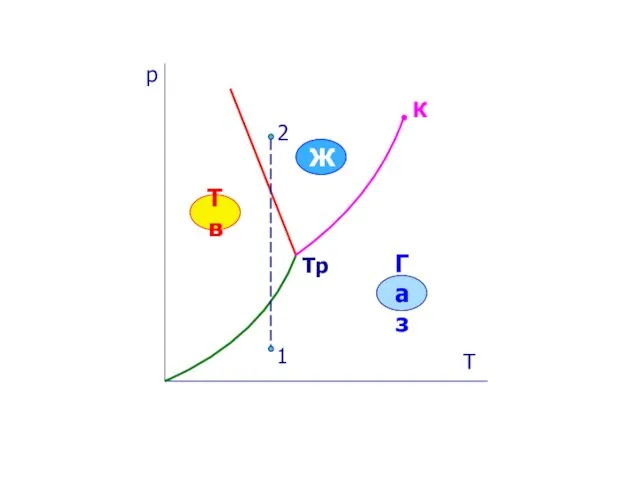
- 17. Тема 5. Реальные газы. Жидкости . Твердые тела §5.5. Тройная точка. Диаграмма состояния
- 18. Диаграмма состояния Тв Ж Газ V=const
- 19. р Т К Тр Тв Ж Газ
- 20. Тема 5. Реальные газы. Жидкости . Твердые тела §5.6. Дырочная модель жидкости
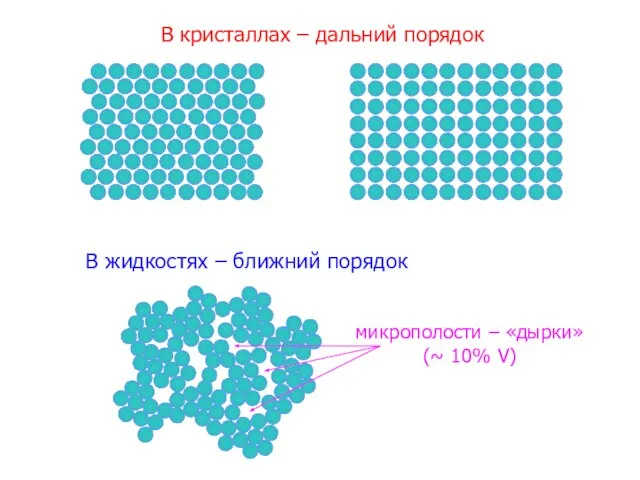
- 21. В кристаллах – дальний порядок В жидкостях – ближний порядок микрополости – «дырки» (~ 10% V)
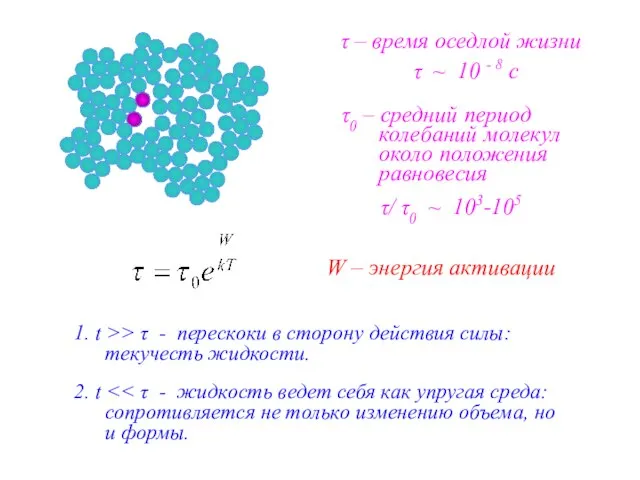
- 22. τ – время оседлой жизни τ0 – средний период колебаний молекул около положения равновесия W –
- 23. Тема 5. Реальные газы. Жидкости . Твердые тела §5.7. Кристаллы. Классическая теория теплоемкости кристаллов. Закон Дюлонга-Пти
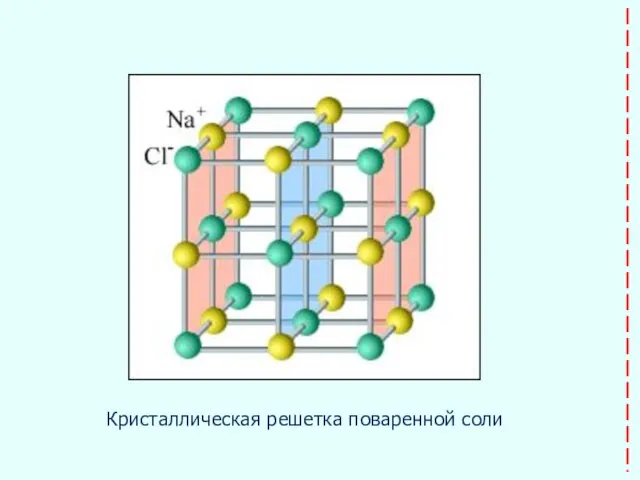
- 24. Кристаллическая решетка поваренной соли
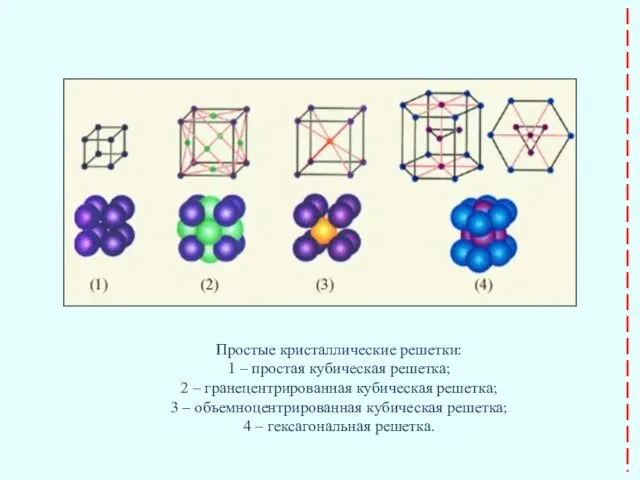
- 25. Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная
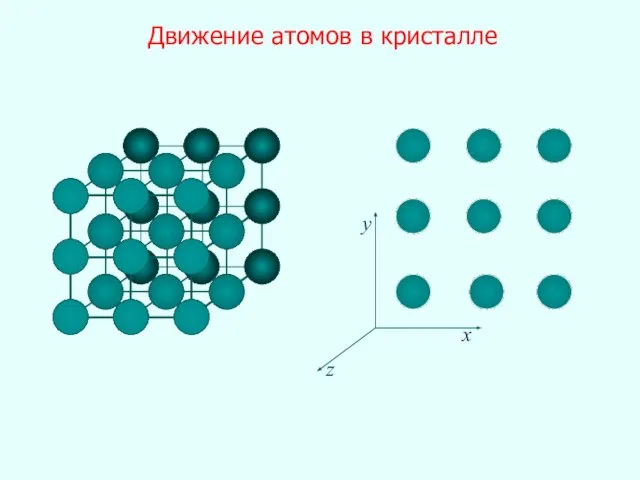
- 26. Движение атомов в кристалле x y z
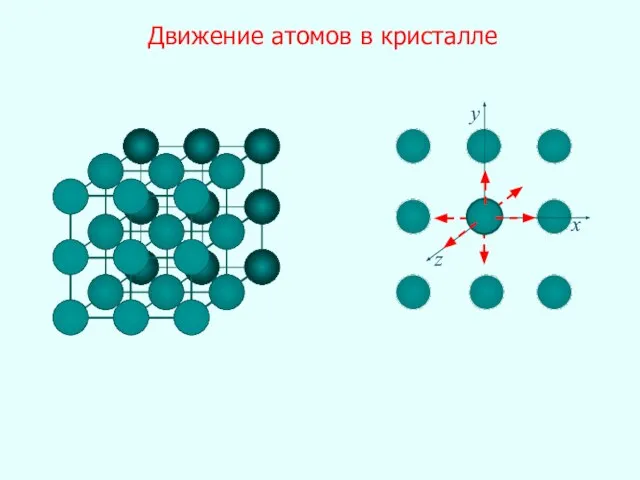
- 27. x y z Движение атомов в кристалле
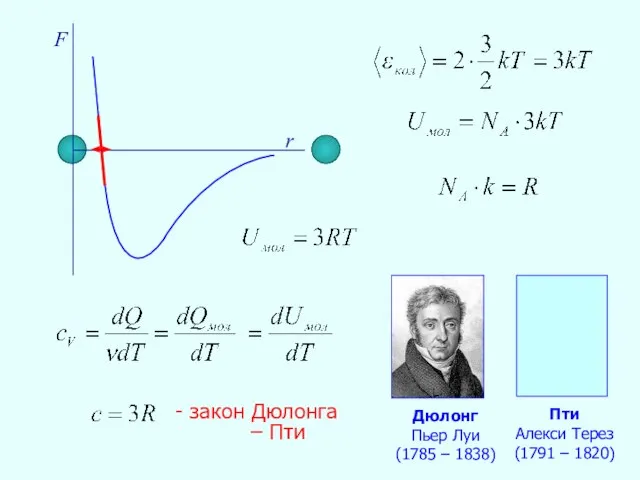
- 28. F r - закон Дюлонга – Пти Дюлонг Пьер Луи (1785 – 1838) Пти Алекси Терез
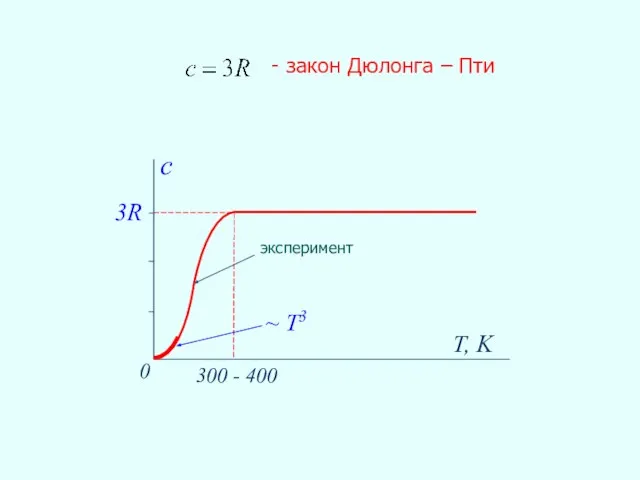
- 29. 3R T, K 0 300 - 400 c - закон Дюлонга – Пти ~ Т3 эксперимент
- 31. Скачать презентацию








 Активизация деятельности учащихся с помощью интерактивных технологий
Активизация деятельности учащихся с помощью интерактивных технологий ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ
ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ Грибы. Общая характеристика грибов. Шляпочные грибы
Грибы. Общая характеристика грибов. Шляпочные грибы Правила устройства и безопасной эксплуатации сосудов, работающих под давлением
Правила устройства и безопасной эксплуатации сосудов, работающих под давлением Санкт-Петербургский государственный университетинформационных технологий, механики и оптики
Санкт-Петербургский государственный университетинформационных технологий, механики и оптики Геометрия корпуса судна
Геометрия корпуса судна Ознакомление с технологией изготовления витража
Ознакомление с технологией изготовления витража Достопримечательности Зарубежной Азии - Япония
Достопримечательности Зарубежной Азии - Япония Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека
Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека УСТРОЙСТВА ПЛАВНОГО ПУСКА
УСТРОЙСТВА ПЛАВНОГО ПУСКА Презентация на тему Теллур
Презентация на тему Теллур  Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны
Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны Художник в театре
Художник в театре VoevodinskaiaIndustrijaMesa
VoevodinskaiaIndustrijaMesa Творческое объединение лего-мастерская Шелезяка. Робототехника
Творческое объединение лего-мастерская Шелезяка. Робототехника Александр Иванович Куприн
Александр Иванович Куприн Рассказ на свободную тему
Рассказ на свободную тему Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Дворцово-парковые ансамбли
Дворцово-парковые ансамбли Статистические методы в параметрическом анализе
Статистические методы в параметрическом анализе Параллельное и последовательное соединения проводников
Параллельное и последовательное соединения проводников Зерновые культуры (7 класс)
Зерновые культуры (7 класс) Ой, да Краснодарский край!
Ой, да Краснодарский край! Россия в условиях Первой мировой войны и общенационального кризиса
Россия в условиях Первой мировой войны и общенационального кризиса Кроссворд по сказкамГанса Христиана Андерсена
Кроссворд по сказкамГанса Христиана Андерсена Проект Free Way Кучер Максим Краснодар
Проект Free Way Кучер Максим Краснодар Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот
Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот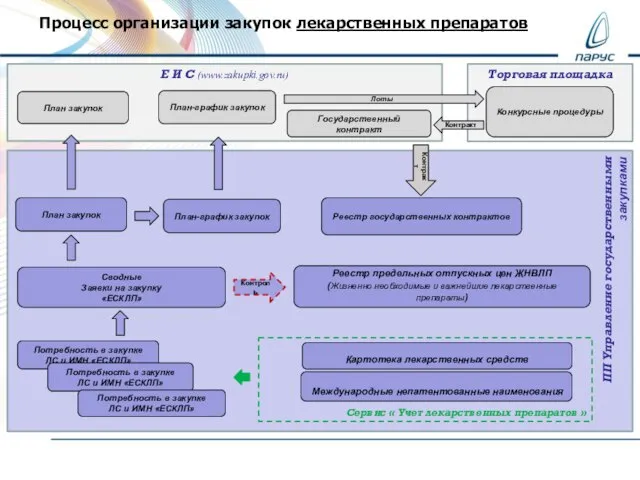 ПФХД_Закуупки_Бухгалтерия
ПФХД_Закуупки_Бухгалтерия