Содержание
- 2. ОТНОШЕНИЕ ТЕПЛОЕМКОСТЕЙ ср И сv ОПРЕДЕЛЕНИЕ qv И qp ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ ПО ТАБЛИЦАМ ТЕПЛОЕМКОСТЕЙ ТЕПЛОЕМКОСТЬ
- 3. 1. ОПРЕДЕЛЕНИЯ УДЕЛЬНОЙ (МАССОВОЙ), ОБЪЕМНОЙ И МОЛЯРНОЙ ТЕПЛОЕМКОСТИ ГАЗОВ Сообщение телу теплоты в каком-либо процессе вызывает
- 4. Общее количество теплоты, полученное в данном процессе: (6.2) Поскольку количество теплоты зависит от характера процесса, то
- 5. Удельная (массовая) теплоемкость сх — величина, равная отношению теплоемкости однородного тела к его массе. Единица удельной
- 6. Молярной теплоемкостью сm называют величину, равную произведению удельной теплоемкости вещества на молярную массу этого вещества. Единицей
- 7. 2. АНАЛИТИЧЕСКИЕ ВЫРАЖЕНИЯ ДЛЯ ТЕПЛОЕМКОСТЕЙ сv И сp теплоемкость при постоянном объеме равная отношению количества теплоты
- 8. теплоемкость при постоянном давлении равная отношению количества теплоты δqp в процессе при постоянном давлении к изменению
- 9. Так как из уравнения (5.3): (6.4’) При v=const (dv=0): (6.5) - теплоемкость cv при v =
- 10. Из уравнений (6.3) и (6.5) следует, что в процессе при v = const, в котором тело
- 11. Для идеального газа, внутренняя энергия которого является функцией только температуры, частная производная: Тогда, независимо от характера
- 12. Для любого конечного процесса изменения состояния идеального газа: Подставляя значение в основное уравнение первого закона термодинамики
- 13. Отсюда при р = const : или, поскольку (6.8) Применяя уравнение (6.5), получаем: (6.9) Уравнение (6.9)
- 14. Для идеального газа, так как , а из уравнения состояния или (6.10) Для 1 моль: Следовательно,
- 15. Уравнение для теплоемкости ср можно получить, если в качестве независимых параметров взять давление р и температуру
- 16. Уравнение первого закона термодинамики: Для идеального газа: (6.13) Первый закон термодинамики при независимых переменных v и
- 17. С помощью последнего уравнения можно найти зависимость между теплоемкостями ср и cv. Для изобарного процесса (при
- 18. Для реальных газов Это неравенство объясняется тем, что при расширении реальных газов (при p = const)
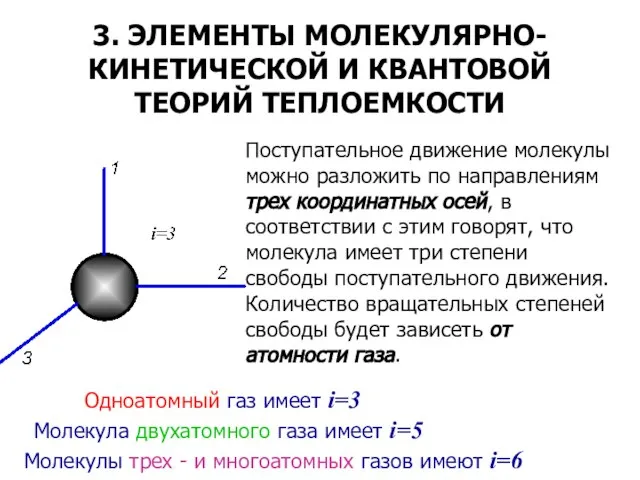
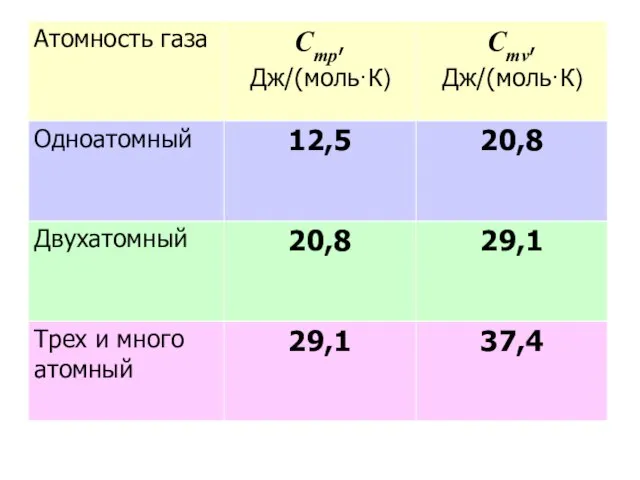
- 19. 3. ЭЛЕМЕНТЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ И КВАНТОВОЙ ТЕОРИЙ ТЕПЛОЕМКОСТИ Поступательное движение молекулы можно разложить по направлениям трех координатных
- 20. Расчет доли внутренней энергии, приходящуюся на одну степень свободы одноатомного идеального газа: (6.17) Умножая обе части
- 21. Величина представляет собой среднюю кинетическую энергию поступательного движения одного атома газа, а так как общее число
- 22. Так как Rm = 8,3142 Дж/(моль·К), то для одноатомного газа: (6.20) Взяв из уравнения (6.19) производную
- 23. Отсюда на каждую степень свободы движения в одноатомном газе расходуется энергия — 12,5:3 = 4,16 Дж/(моль·К).
- 24. Эйнштейн, пользуясь квантовой теорией Планка, получил следующее выражение для молярной теплоемкости, достаточно точное для температур, применяемых
- 26. 4. ИСТИННАЯ И СРЕДНЯЯ ТЕПЛОЕМКОСТИ Теплоемкость, определяемая уравнениями (6.1), (6.3), (6.4) при данных значениях параметров состояния
- 27. Первое слагаемое cx0 представляет собой теплоемкость данного газа в разреженном (идеально газовом) состоянии (при p→0 или
- 28. Средней теплоемкостью данного процесса в интервале температур от t1 до t2 называют отношение количества теплоты q1-2
- 29. Если средние теплоемкости даны в таблице для интервала температур от 0 до t°С, то средняя теплоемкость
- 30. Таким образом, если в каком-либо процессе идеальный газ был нагрет от температуры t1 до t2, то
- 31. 5. ОТНОШЕНИЕ ТЕПЛОЕМКОСТЕЙ ср И сv Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме,
- 32. Если считать сx = const, то получаем: для одноатомного газа k = 1,66; для двухатомного газа
- 33. 6. ОПРЕДЕЛЕНИЕ qv И qp ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ ПО ТАБЛИЦАМ ТЕПЛОЕМКОСТЕЙ Следовательно, для определения теплоты qp
- 34. 7. ТЕПЛОЕМКОСТЬ СМЕСЕЙ ИДЕАЛЬНЫХ ГАЗОВ Если смесь газов задана массовыми долями, то удельная теплоемкость смеси определяется
- 35. Если смесь газов задана объемными долями, то объемная теплоемкость смеси равна сумме произведений объемных долей на
- 36. Молярная теплоемкость смеси газов равна произведению объемных долей на молярные теплоемкости составляющих смесь газов: Удельная теплоемкость
- 37. 8. ЭНТРОПИЯ. ВЫЧИСЛЕНИЕ ЭНТРОПИИ ИДЕАЛЬНОГО ГАЗА ДЛЯ ОБРАТИМЫХ И НЕОБРАТИМЫХ ПРОЦЕССОВ (6.36) Отсюда выражение δq/T при
- 38. Дифференциал энтропии для обратимого изменения состояния определяется как Удельная энтропия есть однозначная функция состояния газа, принимающая
- 39. Так как удельная энтропия обладает свойством аддитивности, то алгебраическая сумма изменений энтропии отдельных тел, составляющих термодинамическую
- 40. Интегрируя, при cv=const найдем для идеального газа: (6.39) Для получения изменения энтропии как функции Т и
- 41. Для получения изменения удельной энтропии как функции р и v следует из уравнения (6.38) исключить Т,
- 42. Удельная теплоемкость сх любого процесса х равна произведению абсолютной температуры Т на частную производную удельной энтропии
- 43. Если в термодинамической системе кроме работы изменения объема совершается работа δlv, не связанная с изменением объема
- 45. Скачать презентацию








































 Происхождение фамилии моей мамы - Тур
Происхождение фамилии моей мамы - Тур Голодні ігри
Голодні ігри Исторические типы и формы государства и политические режимы
Исторические типы и формы государства и политические режимы Работа выполнена в рамках проекта «Повышение квалификаций различных категорий работников образования и формирование у них базов
Работа выполнена в рамках проекта «Повышение квалификаций различных категорий работников образования и формирование у них базов CFD Analsis Report for Lotte PJT in RUSSIA
CFD Analsis Report for Lotte PJT in RUSSIA Модель взаимодействия ЛК и ВУЗа
Модель взаимодействия ЛК и ВУЗа Художественный образ и сценическое движение
Художественный образ и сценическое движение Трудоустроенные лица с инвалидностью в 2021 году
Трудоустроенные лица с инвалидностью в 2021 году Осуществление закупок
Осуществление закупок Экологический проект « Создание сети школьного мониторинга родников, находящихся вблизи города Ступино» Авторы: Шевелёв Але
Экологический проект « Создание сети школьного мониторинга родников, находящихся вблизи города Ступино» Авторы: Шевелёв Але Вирусные дерматозы. Лечение
Вирусные дерматозы. Лечение Риски и перспективы развития оптового и розничного рынков электроэнергии – взгляд потребителя
Риски и перспективы развития оптового и розничного рынков электроэнергии – взгляд потребителя Правила составления натюрморта из бытовых предметов
Правила составления натюрморта из бытовых предметов Школа № 167Октябрьский район
Школа № 167Октябрьский район Сапёр
Сапёр Результаты исследования кремов с антивозрастным эффектом
Результаты исследования кремов с антивозрастным эффектом 2_Gosudarstvo_i_ego_funktsii
2_Gosudarstvo_i_ego_funktsii Презентація_Письмо
Презентація_Письмо Art Nouveau. Painting/ Graphics Art Nouveau
Art Nouveau. Painting/ Graphics Art Nouveau Тенденции использования мотивов удовольствия в рекламе
Тенденции использования мотивов удовольствия в рекламе Карта развития сотрудника КЦ
Карта развития сотрудника КЦ Презентация на тему Владимир Егорович Маяковский
Презентация на тему Владимир Егорович Маяковский Научно-исследовательский институт развития профессионального образования
Научно-исследовательский институт развития профессионального образования Rekomendatsii_po_perekhodu_na_lineynuyu_sistemu_istoricheskogo_obrazovania
Rekomendatsii_po_perekhodu_na_lineynuyu_sistemu_istoricheskogo_obrazovania Анимация
Анимация Самостоятельная работа студентов. Логический анализ текста
Самостоятельная работа студентов. Логический анализ текста Мой путь к успеху(Экскурсия)
Мой путь к успеху(Экскурсия) Гражданская война в США
Гражданская война в США