Слайд 2План лекции
Обратимые и необратимые процессы
Понятие энтропии
Второй закон термодинамики
Уравнение Больцмана
Энергия Гиббса
Применение второго закона

термодинамики к живым системам
Слайд 3Первый закон термодинамики позволяет количественно оценить энергетические характеристики природных, технологических и биологических

процессов, но не может определить возможен ли тот или иной процесс и в каком направлении он пойдет
Слайд 4Химические реакции
Обратимые
Na2CO3 + H2O ⮀ NaHCO3 + NaOH
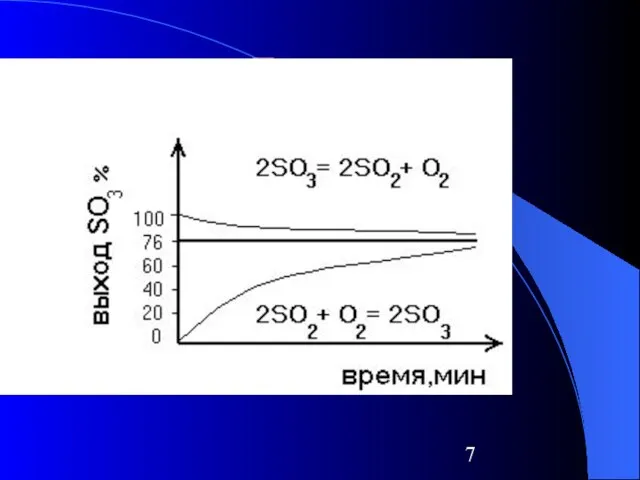
SO2 + O2 ⮀ 2SO3
N2

+ 3H2 ⮀ 2NH3
Необратимые
Zn + H2SO4 = ZnSO4 + H2↑
CuSO4 + 2KOH = K2SO4 + Cu(OH)2↓
NaOH + HCl = NaCl + H2O
Слайд 5Условия состояния равновесия при обратимом процессе
В системе не происходит видимых изменений при

отсутствии внешнего воздействия
Легкость его смещения в ту или иную сторону при незначительном внешнем воздействии
Независимость состояния системы при равновесии от направления движения к этому состоянию в результате прямой или обратной реакции
Слайд 6Обратимость процесса
Термодинамическим условием обратимости является возможность обратимого превращения масс (веществ) и обратимого

изменения внутренней энергии без ее потери во внешнюю среду в форме теплоты или механической работы
Слайд 8Необратимость процесса
Термодинамическим условием необратимости является невозможность после реакции получить исходные вещества в

первоначальном состоянии без дополнительных затрат энергии
2H2 + O2 2H2O
электролиз
Все процессы жизнедеятельности организмов относятся к необратимым (происходит обмен с окружающей средой массой и энергией)
Слайд 9Принцип Ле Шателье
Если на систему, находящуюся в равновесии, направить внешнее воздействие (изменять

концентрацию, давление или температуру), нарушающее это равновесие, то в ней происходят изменения, уменьшающие это воздействие
↓pO2
Hb + O2 HbO2
↑pO2
Слайд 10Энтропия
(термодинамическое определение)
Функция состояния системы, приращение которой равно теплоте, подведенной к системе в

обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется этот процесс
ΔS = S2 – S1
конеч.состояния нач. состояния
Q
ΔS = ----- Дж/моль⋅К
T
Слайд 11В отличие от энтальпии и внутренней энергии, можно рассчитать абсолютное значение энтропии

всех веществ, в том числе и простых
С(графит) : ΔH°298 = 0 кДж/моль
ΔS°298 = 5,69 Дж/моль⋅К
Абсолютное значение энтропии можно вычислить, исходя из постулата Планка:
Энтропия кристаллического вещества при абсолютном нуле равна 0 («третий закон термодинамики»)
Слайд 12Закрытая система
6000 Дж
ΔS = -------- = 22 -------
273 моль⋅К
6000 Дж – теплота
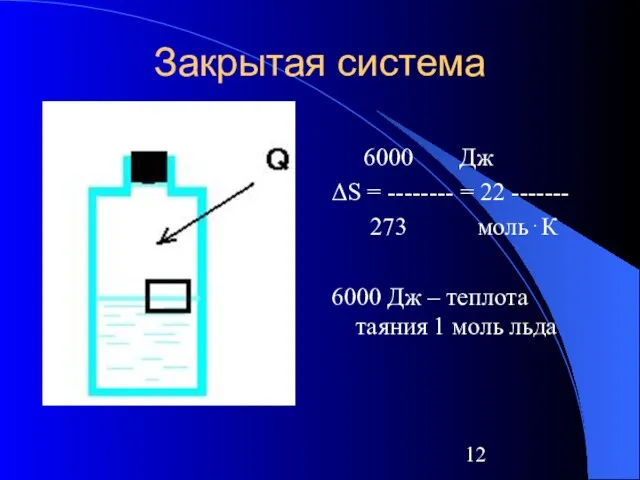
таяния 1 моль льда
Слайд 13Изолированная система
ТА > ТВ
-Q Q
ΔSА = ----- ; ΔSВ = -----

ТА ТВ
ΔS = ΔSА+ ΔSВ
-Q Q Q(ТА – ТВ)
----- + ----- = --------------
ТА ТВ ТА ⋅ ТВ
ΔS > 0
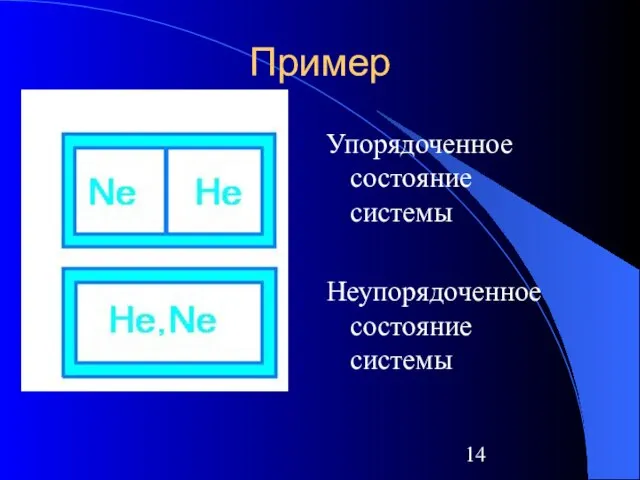
Слайд 14Пример
Упорядоченное состояние системы
Неупорядоченное состояние системы
Слайд 15Молекулярно-кинетическое определение
Энтропия есть мера вероятности пребывания системы в данном состоянии (мера неупорядоченности

системы)
Энтропия возрастает при протекании в изолированной системе необратимого процесса, переводящего систему из менее вероятного состояния в более вероятное
Слайд 16Уравнение Больцмана
S = KlnW, где
S – абсолютное значение энтропии
W – число микросостояний

R
K = ----- = 1,38⋅10-23 Дж/К
NA
Уравнение показывает, что чем больше микросостояний включено в макросистему, тем больше и энтропия
Слайд 17При обратимой химической реакции в состоянии равновесия в изолированной системе вероятность состояния

исходных веществ = вероятности состояния продуктов реакции
Изменение энтропии в состоянии равновесия равно нулю (ΔS = 0)
S(г) > S(ж) > S(аморф) > S(кр)
Энтропия более сложной молекулы > энтропии простой
S°298(СН4) = 186,44 Дж/моль⋅К
S°298(С2Н6) = 229,65 Дж/моль⋅К
Сумма энтропии мономеров > энтропии полимеров
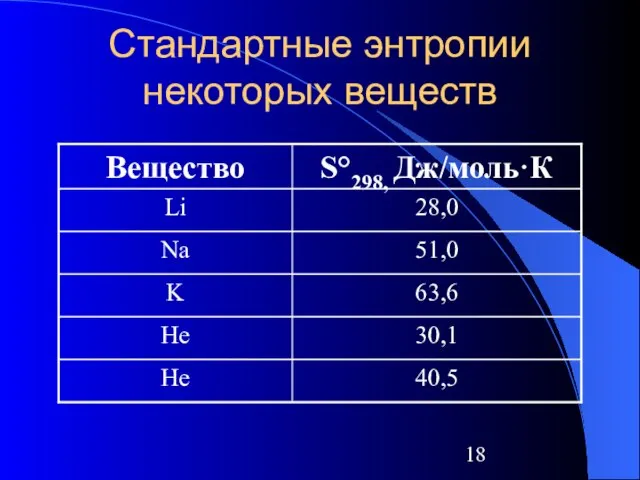
Слайд 18Стандартные энтропии некоторых веществ
Слайд 19Второй закон термодинамики
Любая изолированная система, представленная самой себе, изменяется в направлении состояния,

обладающего максимальной вероятностью
Энтропия изолированной системы возрастает в необратимом процессе и остается неизменной в обратимом; она никогда не убывает
Слайд 20Самопроизвольные процессы идут в направлении от менее вероятного к более вероятному состоянию

системы
Теплота не может самопроизвольно передаваться от холодного тела к горячему (Клаузиус)
Обстоятельства жизни имеют тенденцию развиваться от плохого к худшему (физики шутят)
Слайд 21Теория Клаузиуса
Тепловая смерть Вселенной неизбежна, так как энтропия стремится к максимуму, а

во всем мире будет одна и та же температура
Но:
Вселенная – не изолированная система; она бесконечна
Слайд 22Критерий осуществимости химических реакций
В изолированной системе
ΔS > 0: необратимая реакция
ΔS < 0:

химическая реакция невозможна
ΔS = 0: обратимая химическая реакция, находящаяся в равновесии
Слайд 23Энергия Гиббса (G)
Критерий возможности протекания реакции в закрытых и открытых системах (изобарно-изотермический

потенциал Z)
G = H – TS
ΔG = ΔH – TΔS
В таких системах самопроизвольно протекают только такие процессы, в результате которых ΔG уменьшается
(II закон)
Слайд 24Закон Гесса для энергии Гиббса
Энергия Гиббса для химической реакции равна разности

энергий Гиббса образования продуктов реакции и образования исходных веществ при стандартных условиях
ΔG°298 = ∑ΔG°298 – ∑ΔG°298
реакции обр.продуктов обр.исходных вв.
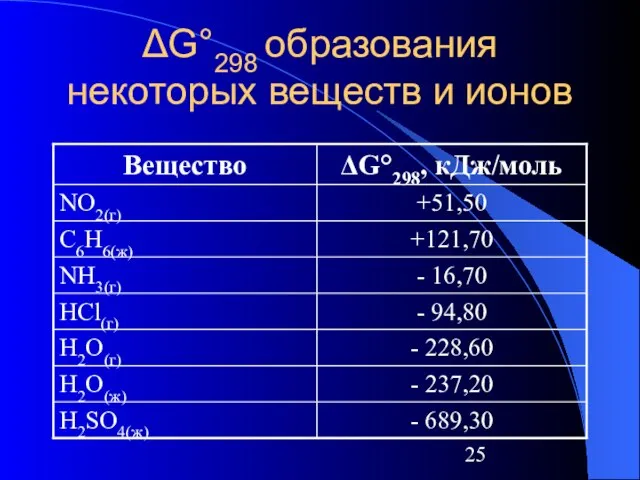
Слайд 25ΔG°298 образования некоторых веществ и ионов
Слайд 26Химические реакции
Экзэргонические – при протекании которых происходит уменьшение энергии Гиббса системы (ΔG

< 0) и совершается работа
Эндэргонические – в результате которых энергия Гиббса возрастает (ΔG > 0) и над системой совершается работа
Слайд 27Движущие силы процессов
ΔG = ΔH – TΔS
Стремление системы к минимальному содержанию внутренней

энергии, т.е. к снижению энтальпии (энтальпийный фактор реакции)
Стремление системы к увеличению энтропии (энтропийный фактор реакции)
Реакция идет самопроизвольно, если ΔG < 0
Слайд 28Влияние факторов на направление процессов

Слайд 29Константа химического равновесия
а А + b В ⮀ d D + c

C
V1 = K1[A]a⋅[B]b ; V2 = K2[D]d⋅[C]c
K1, K2 = const
V1 и V2 изменяются во времени
При V1 = V2; K1[A]a⋅[B]b = K2[D]d⋅[C]c
K1 [D]d⋅[C]c
Кравн. = ----- = -----------
K2 [A]a⋅[B]b
Характеризует степень полноты данной реакции; зависит от температуры и не зависит от начальных концентраций реагирующих веществ
Слайд 30Уравнение изотермы химической реакции
ΔG = –RTlnK , где
R = 8,3146 Дж/моль⋅К
Зная значение

энергии Гиббса, можно рассчитать константу равновесия
Измерив концентрации продуктов реакции и исходных веществ можно определить ΔG процесса
Слайд 31Уравнение изобары химической реакции
d ln Kравн ΔH°
----------- = --------
d T RT2
Повышение

температуры смещает равновесие в сторону реакции, идущей с поглощением тепла (эндотермически) и наоборот, охлаждение сдвигает равновесие в сторону реакции, идущей с выделением тепла
Слайд 32Особенности термодинамики живых систем
Организм обменивается с внешней средой как массой, так и

энергией
Все системы живого организма гетерогенны и многофазны
Процессы в живых системах в конечном итоге необратимы
Живые системы находятся не в равновесном состоянии, а в стационарном
Слайд 33Стационарное состояние
Состояние системы, при котором ее параметры со временем не изменяются, но

происходит обмен веществом и энергией с окружающей средой
Скорость протекания обратимых реакций в одном направлении больше, чем в другом; разница скоростей в обоих направлениях во времени постоянна
Стационарное состояние организма предполагает сохранение гомеостаза
Случаи нестационарного состояния – стрессовые
Слайд 34Принцип Пригожина
В стационарном состоянии, обусловленным протеканием необратимых процессов, скорость возрастания энтропии имеет

положительное и минимальное из возможных значений
Принцип в большей степени применим для зрелого возраста
































 DREAM LAND
DREAM LAND Особенности использования TimesTen In-Memory Database в высоконагруженной среде
Особенности использования TimesTen In-Memory Database в высоконагруженной среде Игра в черное и белое
Игра в черное и белое Вычитание и сказка "Царевна-лягушка" 2 класс
Вычитание и сказка "Царевна-лягушка" 2 класс Органическая химия
Органическая химия Вербальные средства и процесс слушания в деловой коммуникации
Вербальные средства и процесс слушания в деловой коммуникации Літературна_та_загальнонародна_національна_мова
Літературна_та_загальнонародна_національна_мова Лев Толстой и Ясная Поляна
Лев Толстой и Ясная Поляна Центр психологической помощи
Центр психологической помощи БЕЗОПАСНОСТИ ДОРОЖНОГО ДВИЖЕНИЯ – ОСОБОЕ ВНИМАНИЕ
БЕЗОПАСНОСТИ ДОРОЖНОГО ДВИЖЕНИЯ – ОСОБОЕ ВНИМАНИЕ Выход из плоскости в пространство. Способы макетирования из одного листа бумаги
Выход из плоскости в пространство. Способы макетирования из одного листа бумаги На заре человечества
На заре человечества Скульптуры разных эпох и стилей
Скульптуры разных эпох и стилей Закаляйся - если хочешь быть здоров!
Закаляйся - если хочешь быть здоров! Конкурс на «Лучшую процедурную медсестру»
Конкурс на «Лучшую процедурную медсестру» Творчество Александра Блока на примере цикла стихов «Стихи о Прекрасной Даме»
Творчество Александра Блока на примере цикла стихов «Стихи о Прекрасной Даме» Наличные и электронные деньги
Наличные и электронные деньги УЗЧ-
УЗЧ- реализация программы нравственного воспитания
реализация программы нравственного воспитания Британия, Британия, туманная страна…
Британия, Британия, туманная страна… Английские слова
Английские слова Земля хороша собой… (пишем этюды, или зарисовки с натуры)
Земля хороша собой… (пишем этюды, или зарисовки с натуры) Основы работы в ВикиВики (практика) Нацкевич Юлия Попова Светлана Дерябин Александр
Основы работы в ВикиВики (практика) Нацкевич Юлия Попова Светлана Дерябин Александр Презентация на тему Речевая разминка на уроках чтения
Презентация на тему Речевая разминка на уроках чтения Функции науки об управлении персоналом
Функции науки об управлении персоналом Средняя общеобразовательная школа № 17 с углубленным изучением отдельных предметов
Средняя общеобразовательная школа № 17 с углубленным изучением отдельных предметов Lection 14 tanini skzbnaxbjurner
Lection 14 tanini skzbnaxbjurner Атомные аварии
Атомные аварии