Содержание
- 2. Элементы IA-группы Li, Na, K, Rb, Cs, Fr – щелочные металлы Общая электронная формула: [Э]ns1np0 Э
- 3. Характеристика атомов элементов IA-группы Увеличение числа электронов в атоме и размеров орбиталей, занимаемых последними электронами Потеря
- 4. Единственный электрон на внешнем энергетическом уровне атома щелочного металла слабо связан с ядром (I1) . Атомы
- 5. Электроотрицательность уменьшается с возрастанием атомного номера элемента В ОВР s-элементы выполняют только роль восстановителей
- 6. Особенности химии лития Li3N – устойчивый >600°C 2LiOH → Li2O + H2O LiCl, LiBr, LiI, LiClO4
- 7. Физические свойства Простые вещества – легкоплавкие серебристо-белые (Li, Na, K, Rb) или золотисто-желтые (Cs) металлы, обладающие
- 8. Наличие в атомах элементов одного валентного электрона обусловливает низкие значения энергии атомизации, низкие tплавл и tкип
- 9. В кристаллическом виде металлы имеют объемно-центрированную кристаллическую решетку с металлическим типом химической связи
- 10. Распространенность в природе Na и K – наиболее широко распространены, встречаются исключительно в виде соединений Щелочные
- 11. Минералы NaCl Галит (каменная соль) Na2SO4*10H2O Мирабилит
- 12. KCl Сильвин KCl*NaCl Сильвинит
- 13. KCl*MgCl26H2O Карналлит Li2O*Al2O3*4SiO2 Сподумен
- 14. Получение Na: электролиз расплава NaCl. катод: Na+ + e- =Na анод: 2Cl- - 2e- =Cl2 Li:
- 15. 2RbCl + Ca → CaCl2 + 2Rb↑ Li этим способом получать нельзя из-за высокой устойчивости Li3N
- 16. Применение Li, Na - теплоносители в ядерных реакторах Na и K – применяются для осушки органических
- 17. Качественный анализ на s-металлы по окрашиванию пламени Li+ Na+ Rb+ K+ Cs+
- 18. Химические свойства Взаимодействие с простыми веществами 2M + 2H2O→2MOH + H2↑ K + 2HNO3(конц.)→KNO3+ NO2↑ +
- 19. Соединения с неметаллами NaCl + H2SO4→NaHSO4+ HCl↑ Cs2C2 + 2H2O→2CsOH + C2H2↑ Li3N + 3H2O→3LiOH +
- 20. Кислородные соединения 4Li+O2→2Li2O 2M+M2O2→2M2O 2NaOH+2Na→2Na2O+H2↑ 2LiOH+2H2O2+H2O→2LiOOH·3H2O 2LiOOH·3H2O→Li2O2+4H2O+½O2 KO2+O3→KO3+O2 Li2O Na2O K2O Rb2O Cs2O
- 21. M2O2+2H2O→2MOH+H2O2 (на холоду) 2M2O2 +2H2O →4MOH+O2↑(при нагрев.) 2NaO2+H2O → NaOH+NaH+O2↑(на холоду) 4NaO2+2H2O → 4NaOH+3O2↑ (при нагрев.)
- 22. Гидроксиды 2LiOH→Li2O + H2O Rb2SO4 + Ba(OH)2→BaSO4↓ + 2RbOH 2NaOH + SiO2→Na2SiO3 + H2O NaOH +
- 23. Растворимость гидроксидов в воде Гидроксиды щелочных металлов прекрасно растворимы в воде, хорошо растворимы в этаноле (растворимость
- 24. Соли Твердые кристаллические вещества с ионным типом кристаллической решетки Почти все соли хорошо растворимы Водные растворы
- 25. Сода (карбонат натрия-кальцинированная сода) В природе встречается в виде минерала троны Na2CO3 *NaHCO3* 2H2O Первый промышленный
- 26. Комплексные соединения В разбавленных водных растворах катионы существуют в форме аквакомплексов Наиболее устойчивы комплексы с полидентатными
- 28. Скачать презентацию

























 Новая европейская живопись
Новая европейская живопись Всероссийский День ходьбы
Всероссийский День ходьбы Путешествие по Волге
Путешествие по Волге Глагол have to и must
Глагол have to и must Рейтинг добывающих компаний и местной власти: оценка населения
Рейтинг добывающих компаний и местной власти: оценка населения Высшие, или Плацентарные, звери,Отряды: Насекомоядные и Рукокрылые, Грызуны и Зайцеобразные ,Хищные
Высшие, или Плацентарные, звери,Отряды: Насекомоядные и Рукокрылые, Грызуны и Зайцеобразные ,Хищные Презентация на тему Франция в середине XIX века
Презентация на тему Франция в середине XIX века Служение ''Мое Поколение''
Служение ''Мое Поколение''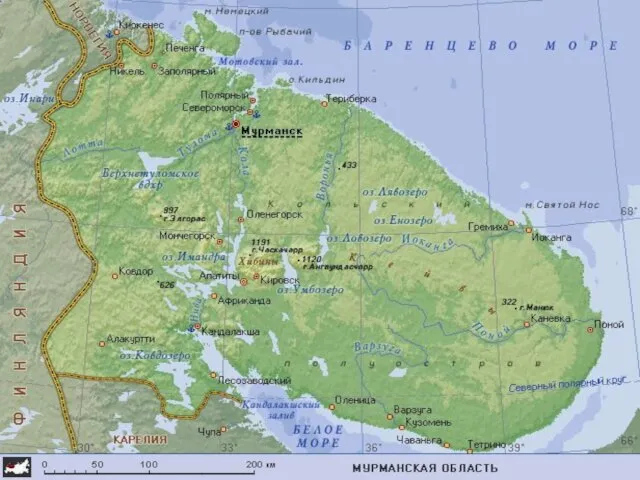 Мурманская область
Мурманская область Общие сведения об электротехнологии. Энергетические основы электротехнологии. Лекция №2
Общие сведения об электротехнологии. Энергетические основы электротехнологии. Лекция №2 Lecture3
Lecture3 «Актуальная информация о международной стандартизации в области сварки и родственных процессов» „State of the art of International Standardisation in th
«Актуальная информация о международной стандартизации в области сварки и родственных процессов» „State of the art of International Standardisation in th Рисунок основа изобразительного творчества
Рисунок основа изобразительного творчества Действие магнитного поля на проводник с током
Действие магнитного поля на проводник с током ФИЗИОЛОГИЯ ПИЩЕВАРЕНИЯ
ФИЗИОЛОГИЯ ПИЩЕВАРЕНИЯ Есенин и Россия
Есенин и Россия Апрелевский завод теплоизделий
Апрелевский завод теплоизделий Глаголы застывшие и изменяющиеся в арабском языке
Глаголы застывшие и изменяющиеся в арабском языке Николай Алексеевич Заболоцкий
Николай Алексеевич Заболоцкий Людей неинтересных в мире нет. Их судьбы – как истории планет. У каждой всё особое, свое, И нет планет, похожих на нее. Е.Евтушенко
Людей неинтересных в мире нет. Их судьбы – как истории планет. У каждой всё особое, свое, И нет планет, похожих на нее. Е.Евтушенко Устройство и содержание бесстыкового пути ОАО РЖД
Устройство и содержание бесстыкового пути ОАО РЖД Презентация на тему Правописание НЕ с причастиями
Презентация на тему Правописание НЕ с причастиями Этические нормы коллектива
Этические нормы коллектива Генетический анализ вместо химиотерапии
Генетический анализ вместо химиотерапии Алгоритм и его формальное исполнение
Алгоритм и его формальное исполнение Цели: Активизация деятельности учащихся; Развитие творческого интереса к математике; Воспитание стойкости, находчивости и любозн
Цели: Активизация деятельности учащихся; Развитие творческого интереса к математике; Воспитание стойкости, находчивости и любозн Презентация на тему Economic Community of West African States (ECOWAS)
Презентация на тему Economic Community of West African States (ECOWAS)  Лыжная база Саломаты
Лыжная база Саломаты