Содержание
- 2. Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение
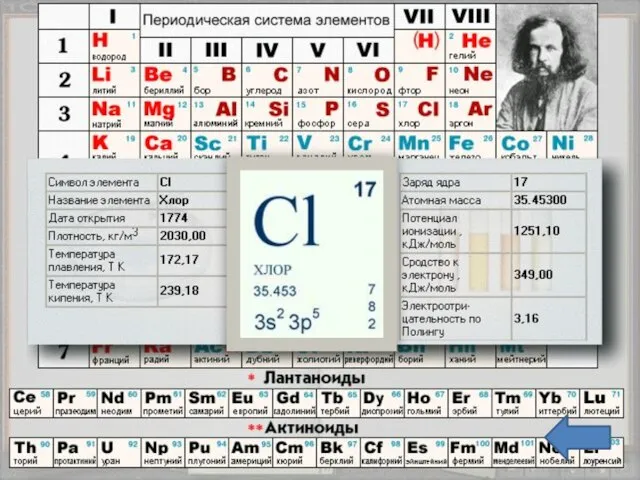
- 3. Положение в таблице Хлор - химический элемент седьмой группы, главной подгруппы, третьего периода периодической системы элементов
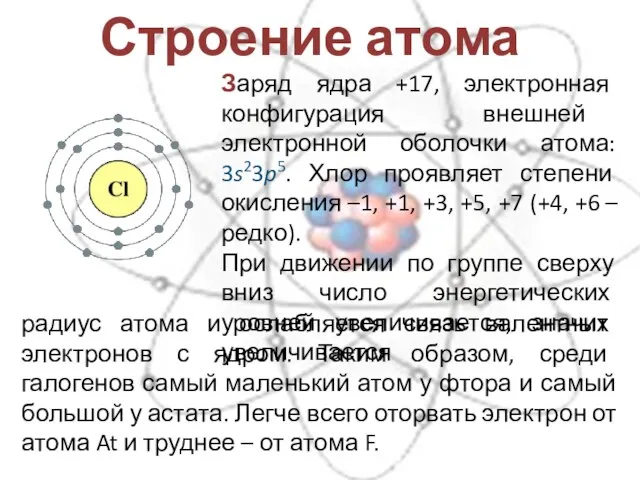
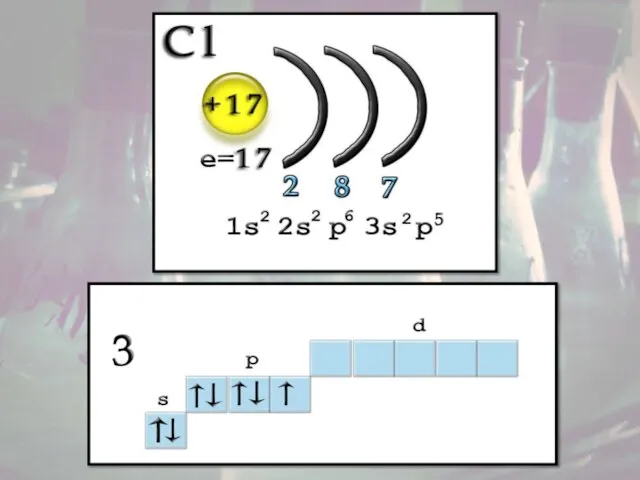
- 5. Строение атома Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома: 3s23p5. Хлор проявляет степени окисления
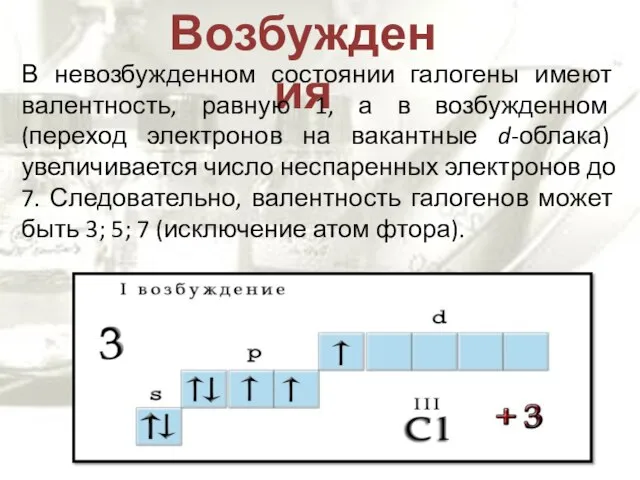
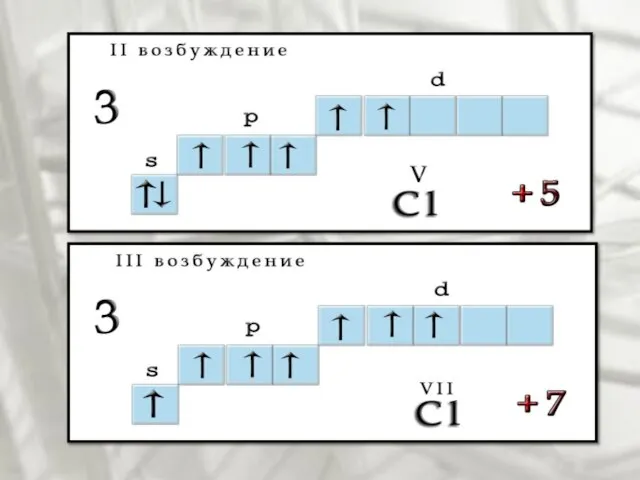
- 7. Возбуждения В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные
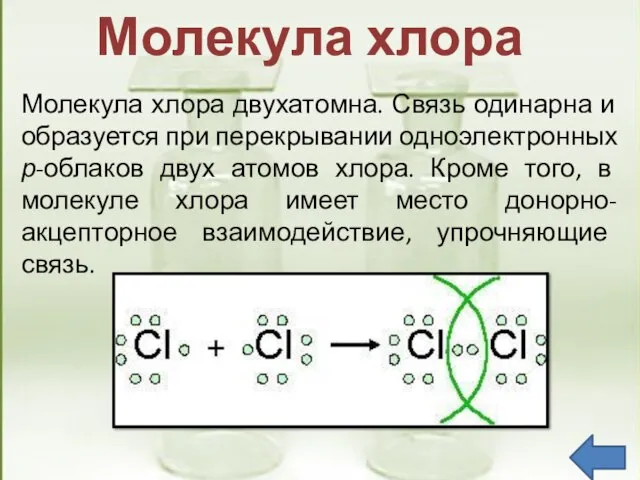
- 9. Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р-облаков двух атомов хлора. Кроме того,
- 10. Физические свойства С возрастанием молекулярной массы температуры плавления и кипения веществ, состоящих из молекул одинакового строения,
- 11. Физические свойства Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое химическое оружие. Во
- 12. Физические свойства
- 13. История открытия Первым из галогенов был открыт хлор (К. Шееле, 1774 год). Полученный желто-зеленый газ шведский
- 14. В природе встречается два стабильных изотопа хлора:35Cl (75,77%) и 37Cl (24,23%). Содержание хлора в земной коре
- 15. Минералы Каменная соль = поваренная соль = галит Карналлит Сильвин
- 16. Получение Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов (NaCl, KCl). Также его получают
- 17. Получение 2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
- 18. Химические свойства Хлор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O2,
- 19. Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr)
- 20. Cu+Cl2=CuCl2 2Fe+3Cl2 = 2FeCl3
- 21. H2 + Cl2 = 2 HCl(на свету) С Неметаллами 2Cl2 + C = CCl4 3Cl2 +
- 22. Образует соединения с другими галогенами: Cl2 + F2 = 2ClF Cl2 + 3F2 = 2ClF3, t
- 23. Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl2
- 24. С Бескислородными Кислотами Cl2 + HBr = 2HCl + Br2 Cl2 + HI = 2HCl +
- 25. Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул
- 26. Применение хлора Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является
- 27. Для обеззараживания воды — «хлорирования». В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов,
- 29. Скачать презентацию




















 Из книжной сокровищницы Древней Руси
Из книжной сокровищницы Древней Руси Ур 5 (1)
Ур 5 (1) Искусство Европы рубежа 19-20 веков
Искусство Европы рубежа 19-20 веков Орнаментальные мотивы в художественном текстиле Индии. Часть 1
Орнаментальные мотивы в художественном текстиле Индии. Часть 1 Самоподготовка в школе полного дня
Самоподготовка в школе полного дня Мероприятия по ликвидации мест концентрации ДТП. Проект №3
Мероприятия по ликвидации мест концентрации ДТП. Проект №3 Федор Петрович Толстой (1783-1873). Натюрморт
Федор Петрович Толстой (1783-1873). Натюрморт Презентация без названия
Презентация без названия Полимеразная цепная реакция(ПЦР)
Полимеразная цепная реакция(ПЦР) Документознавство
Документознавство Рынок капитала
Рынок капитала Вкусный воскресный завтрак
Вкусный воскресный завтрак Несколько значений глаголов
Несколько значений глаголов Презентация на тему Три поросенка
Презентация на тему Три поросенка  Снайперские винтовки
Снайперские винтовки Презентация на тему Кошки
Презентация на тему Кошки Балансир Герасимова
Балансир Герасимова Кот-д’Ивуар
Кот-д’Ивуар Защита банковских карт
Защита банковских карт 656049, Алтайский край, г. Барнаул, ул. Ядринцева, 76 ?(385-2) 383684 @ sс
656049, Алтайский край, г. Барнаул, ул. Ядринцева, 76 ?(385-2) 383684 @ sс Презентация на тему: Внешнеэкономические связи ведущих развитых стран
Презентация на тему: Внешнеэкономические связи ведущих развитых стран Классы и объекты в Java
Классы и объекты в Java Технические открытия на рубеже XV-XVI вв
Технические открытия на рубеже XV-XVI вв Семя и проросток
Семя и проросток Сельское хозяйство России. Земледелие
Сельское хозяйство России. Земледелие Интергация детских деятельностей
Интергация детских деятельностей День биологического разнообразия
День биологического разнообразия Марциальные воды: первый русский курорт
Марциальные воды: первый русский курорт