Содержание
- 2. Введение В пещерах спелеологи встречаются с красивейшими известковыми образованиями – свешивающимися со сводов сталактитами и растущими
- 3. Насколько «жестка» жесткая вода? Жёсткость воды – это ее свойство, связанное с содержанием растворимых в ней
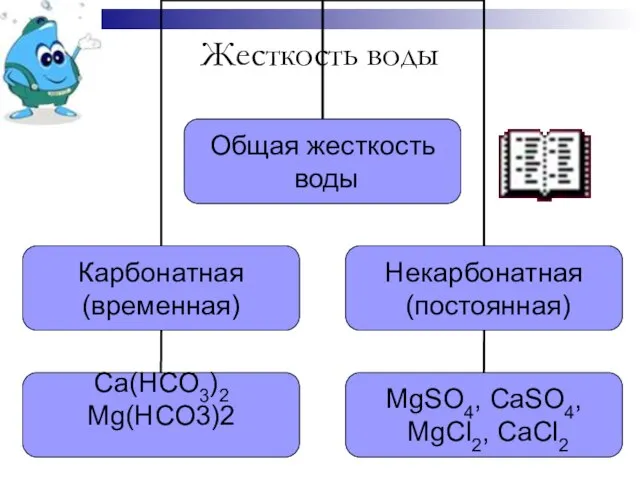
- 4. Жесткость воды
- 5. Влияние жесткости воды на здоровье человека Повышенная жесткость воды негативно сказывается на здоровье человека при умывании.
- 6. Химия жесткости воды Осадок и накипь (соли жесткости) образуются в результате взаимодействия катионов с анионами. Ниже
- 7. Возникновение Жесткости Ионы кальция и магния, а также прочих щелочноземельных металлов, определяющих жесткость, присутствуют во всех
- 8. Умягчение воды Умягчение воды – процесс снижения жесткости воды, т.е. уменьшение концентрации ионов кальция и магния.
- 9. Методы умягчения воды: Реагентное умягчение воды, при этом способе очистки воды ионы Ca+2 и Mg+2 связываются
- 10. Устранение карбонатной жесткости Кипячение Са(НСО3)2 → СаСО3 ↓+ Н2О + СО2↑; Mg(НСО3)2 → MgСО3 ↓ +
- 11. Действие раствора соды Na2CO3: СaSO4 + Na2СО3 → CaСО3 ↓ + Na2SO4; MgCl2 + Na2СО3 →
- 12. О содержании железа в питьевой воде Высокое содержание железа в воде вызывает отложение осадка в трубах
- 14. Скачать презентацию
Слайд 2 Введение
В пещерах спелеологи встречаются с красивейшими известковыми образованиями – свешивающимися
Введение
В пещерах спелеологи встречаются с красивейшими известковыми образованиями – свешивающимися

Слайд 3 Насколько «жестка» жесткая вода?
Жёсткость воды – это ее свойство, связанное с
Насколько «жестка» жесткая вода?
Жёсткость воды – это ее свойство, связанное с

Слайд 4Жесткость воды
Жесткость воды
Слайд 5Влияние жесткости воды на здоровье человека
Повышенная жесткость воды негативно сказывается на
Влияние жесткости воды на здоровье человека
Повышенная жесткость воды негативно сказывается на

Слайд 6Химия жесткости воды
Осадок и накипь (соли жесткости) образуются в результате взаимодействия
Химия жесткости воды
Осадок и накипь (соли жесткости) образуются в результате взаимодействия

Слайд 7Возникновение Жесткости
Ионы кальция и магния, а также прочих щелочноземельных металлов, определяющих
Возникновение Жесткости
Ионы кальция и магния, а также прочих щелочноземельных металлов, определяющих

Слайд 8Умягчение воды
Умягчение воды – процесс снижения жесткости воды, т.е. уменьшение концентрации ионов
Умягчение воды
Умягчение воды – процесс снижения жесткости воды, т.е. уменьшение концентрации ионов

Глубина умягчения воды
Качество исходной воды
Экономические соображения
Слайд 9Методы умягчения воды:
Реагентное умягчение воды, при этом способе очистки воды ионы
Методы умягчения воды:
Реагентное умягчение воды, при этом способе очистки воды ионы

Электромагнитное воздействие на воду. Данный метод очистки воды не снижает ее жесткость, а предотвращает выпадение накипи, карбонатных отложений. Данный метод используется, где умягчение воды не является самоцелью.
Подробнее о химии жесткости воды.
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок. Ca2 + 2HCO3- = CaCO3v + H2O + CO2^
С постоянной жесткостью бороться труднее. Один из вариантов: вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лед превратить обратно в воду. Все соли, которые образую жесткость, остаются в не замершей воде. Еде один способ – испарение воды с последующие ее конденсацией. Так как соли относятся к нелетучим соединениям, они остаются, а вода испаряется. Но такие методы, как замораживание и перегонка пригодны только для смягчения небольшого количества воды. С последствием жесткости воды - накипью, с точки зрения химии можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной.
Слайд 10Устранение карбонатной жесткости
Кипячение
Са(НСО3)2 → СаСО3 ↓+ Н2О + СО2↑; Mg(НСО3)2
Устранение карбонатной жесткости
Кипячение
Са(НСО3)2 → СаСО3 ↓+ Н2О + СО2↑; Mg(НСО3)2

Действие известкового молока или соды:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 ↓ + 2Н2О ; Mg(НСО3)2 + Na2СО3 → MgСО3 ↓ + 2NaHCO3
Слайд 11Действие раствора соды Na2CO3:
СaSO4 + Na2СО3 → CaСО3 ↓ + Na2SO4;
СaSO4 + Na2СО3 → CaСО3 ↓ + Na2SO4;

MgCl2 + Na2СО3 → MgСО3 ↓ + 2NaCl;
Устранение некарбонатной (постоянной) жесткости
Слайд 12О содержании железа в питьевой воде
Высокое содержание железа в воде вызывает
О содержании железа в питьевой воде
Высокое содержание железа в воде вызывает

Соединения железа в воде присутствуют в растворенной и нерастворенной форме.
1. Для удаления ржавчины используют так называемые "механические" фильтры. Фильтрующие элементы представлены в виде промывающейся сетки из нержавеющей стали, также используются кварцевый песок, керамическая крошка. 2. Растворенное железо бывает в трехвалентной и в двухвалентной формах. Трехвалентная форма - это желтый раствор, двухвалентная - бесцветный раствор. В присутствии кислорода в воде двухвалентное железо очень быстро переходит в трехвалентную форму и образует малорастворимый гидроксид железа .
4Fe 2+ + O2 +2H2O = 4Fe(OH)3
При аэрировании происходит окисление двухвалентного железа в трехвалентную форму по следующей суммарной реакции:
4Fe2+ + O2 +10H2O = 4Fe (OH) 3 + 8H+
Также вместо кислорода воздуха для перевода Fe2+ в Fe3+ можно использовать и другие окислители, например, перманганат калия. Этими способами производят очистку воды от марганца (Mn2+), который часто сопутствует двухвалентному железу:
3Fe (HCO3)3 + KMnO3 + 2H2O = 3Fe (OH)3 + MnO2 + 5CO2 + KHCO3
В случае двухвалентного марганца происходит такая реакция окисления:
3Mn2+ + 2MnO4- + 2H2O = 5MnO2 + 4H+
 ОБЛАКА (6 класс)
ОБЛАКА (6 класс) Язык программирования Pascal. Процедуры и функции
Язык программирования Pascal. Процедуры и функции Поговорим об этикете
Поговорим об этикете Всемирный Банк и МолодежьThe Young Professionals Program
Всемирный Банк и МолодежьThe Young Professionals Program Руководство Ernst&Young по составления бизнес-планов
Руководство Ernst&Young по составления бизнес-планов Формированиеруководящих органов Платформы и план работ на I квартал 2011 (представление проектарешения заседания)
Формированиеруководящих органов Платформы и план работ на I квартал 2011 (представление проектарешения заседания) Бакланова Людмила Николаевна, учитель географии высшей квалификационной категории МОУ Чайковская средняя общеобразовательная ш
Бакланова Людмила Николаевна, учитель географии высшей квалификационной категории МОУ Чайковская средняя общеобразовательная ш Русская культура. Предметы русского быта
Русская культура. Предметы русского быта Welcome to 2011:что ждет рекламодателей
Welcome to 2011:что ждет рекламодателей Наука как деятельность. Спорт как объект научного исследования
Наука как деятельность. Спорт как объект научного исследования Космос, земля, человек.
Космос, земля, человек. Плетение
Плетение Презентация на тему Русская культура
Презентация на тему Русская культура Антибактериальный гель для рук
Антибактериальный гель для рук Испанском художнике Диего Веласкесе
Испанском художнике Диего Веласкесе Использование информационных средств обучения на уроках истории и обществознания
Использование информационных средств обучения на уроках истории и обществознания DIU - Активные виды деятельности
DIU - Активные виды деятельности Неустойка. Формы неустойки
Неустойка. Формы неустойки Презентация на тему Нью-Йорк
Презентация на тему Нью-Йорк Презентация
Презентация Использование опорных схем на уроках русского языка- один из способов формирования информационных и коммуникативных компетентно
Использование опорных схем на уроках русского языка- один из способов формирования информационных и коммуникативных компетентно mdk_02
mdk_02 Идеальная бровь
Идеальная бровь Избирательная система РФ
Избирательная система РФ 2022.10.28_Презентация на Думу
2022.10.28_Презентация на Думу ЦУКУРОВ Олег Анатольевич Заместитель Генерального директора ОАО «Институт сварки России», член Технического комитета по станда
ЦУКУРОВ Олег Анатольевич Заместитель Генерального директора ОАО «Институт сварки России», член Технического комитета по станда Контрперенос и принципы работы бессознательного
Контрперенос и принципы работы бессознательного Рунические формулы на все случаи жизни
Рунические формулы на все случаи жизни