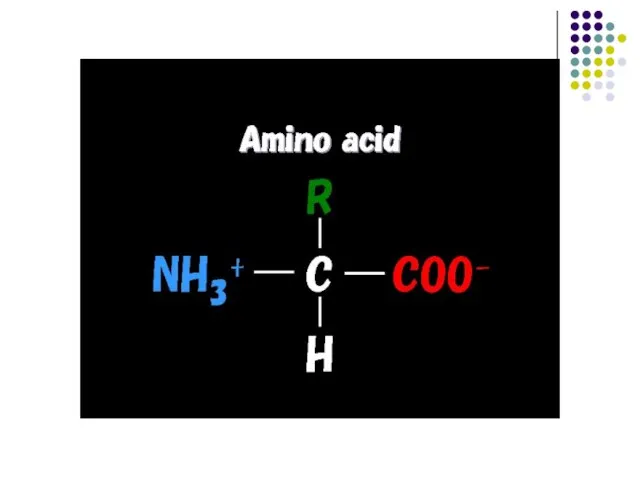
Слайд 2 Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков a-

аминокислот, соединенных между собой пептидными связями.
Слайд 3 Из истории
основу жизни на Земле составляют белки и нуклеиновые кислоты,
белки были

вторичны по отношению к нуклеиновым кислотам.
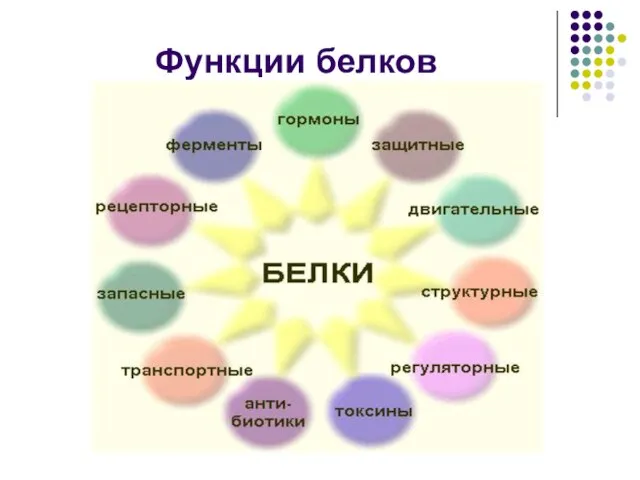
Слайд 4Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов –

катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Слайд 5 Белки - функциональные молекулы, которые могут состоять:
из одного полипептида,
нескольких

полипептидов – одинаковых или разных,
включать в качестве дополнения к полипептидам другое вещество – олигосахарид, нуклеотид или другое.
Слайд 6Вывод:
Полипептиды состоят из аминокислот.

Слайд 7Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают,

что пептиды содержат в молекуле до 100, а белки - свыше 100 аминокислотных остатков.
При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
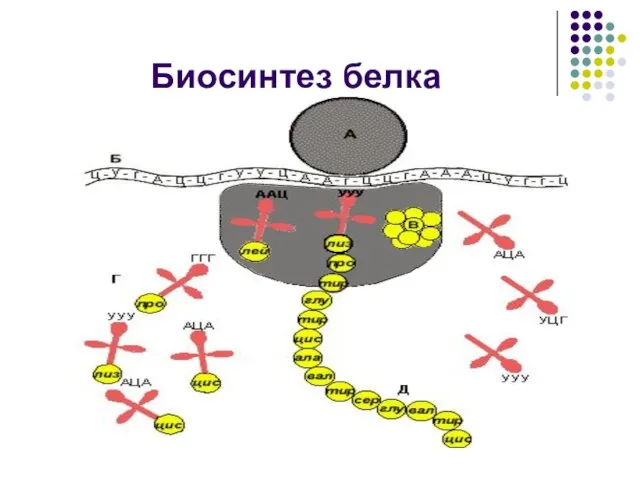
Слайд 8 Аминокислоты объединяются (конденсируются) в белки:
один из двух водородов аминогруппы одной аминокислоты

– OH из гидроксильной группы другой аминокислоты отщепляется с образованием молекулы воды (Н2О);
соответствующие атомы углерода и азота связываются друг с другом с образованием амидной, или пептидной, связи (это прочная ковалентная связь)
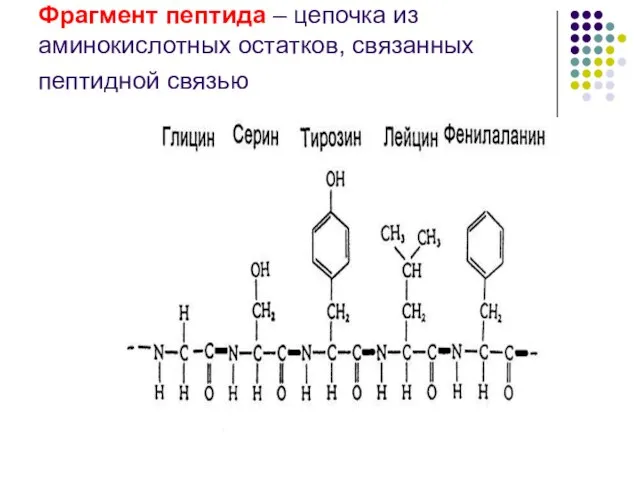
Слайд 9Конструкция полипептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь

имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных (CONH) групп. Различия такой цепи заключаются в боковых радикалах, связанных с метиновой группой, и характеризующих ту или иную аминокислоту.
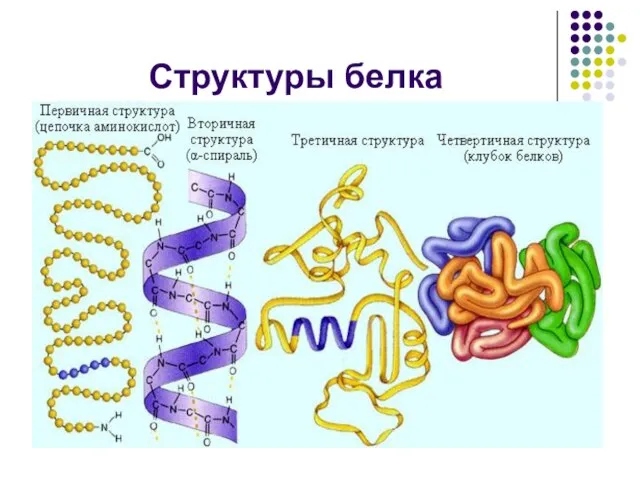
Слайд 10Для полипептидов и белков характерны четыре уровня пространственной организации, которые принято называть

первичной, вторичной, третичной и четвертичной структурами.
Слайд 12Фрагмент пептида – цепочка из аминокислотных остатков, связанных пептидной связью
Слайд 13Структуры белка
Каждая полипептидная цепь расположена в пространстве:
атом водорода, связанный с атомом

азота, образовывает водородную связь с атомом кислорода, пептидную связь.
Слайд 14Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования a- аминокислотных остатков в

полипептидной цепи.
Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – a- спираль.
Слайд 15Третичная структура белка - трехмерная конфигурация закрученной спирали в пространстве, образованная за счет

дисульфидных мостиков –S–S– между цистеиновыми остатками и ионных взаимодействий.
Четвертичная структура белка - структура, образующаяся за счет взаимодействия между разными полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
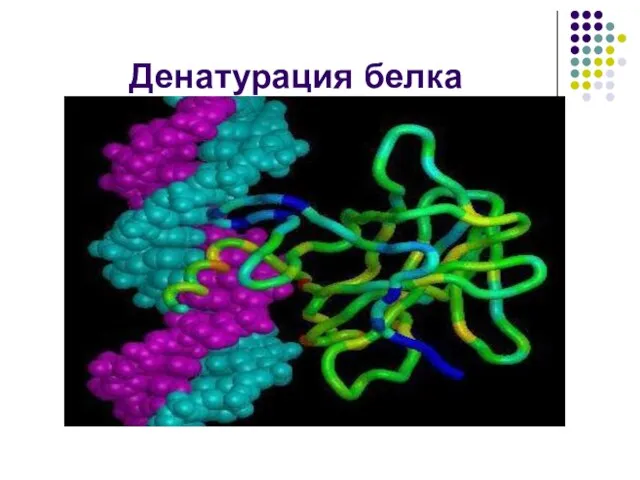
Слайд 22Химические свойства
Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической

функции, называется денатурацией. С точки зрения структуры белка – это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д.
Слайд 23Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или

ферментов, приводящее к образованию a- аминокислот, из которых он был составлен.
Слайд 243) Качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание при действии солей меди

(II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
b) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).



















 Экология на садовом участке. Подготовка рассады
Экология на садовом участке. Подготовка рассады Chromalveolata. Царство Alveolata. Динофитовые водоросли
Chromalveolata. Царство Alveolata. Динофитовые водоросли Селекционеры в годы Великой Отечественной войны
Селекционеры в годы Великой Отечественной войны Презентация на тему Экономика природопользования
Презентация на тему Экономика природопользования  ИССЛЕДОВАТЕЛЬСКИЙ ПРОЕКТ Ученица 1«б» класса Массан Анна Руководитель – Черномурова Нина Александровна МОУ «Ракитянская СО
ИССЛЕДОВАТЕЛЬСКИЙ ПРОЕКТ Ученица 1«б» класса Массан Анна Руководитель – Черномурова Нина Александровна МОУ «Ракитянская СО Нервные ткани
Нервные ткани Синтетическая теория эволюции
Синтетическая теория эволюции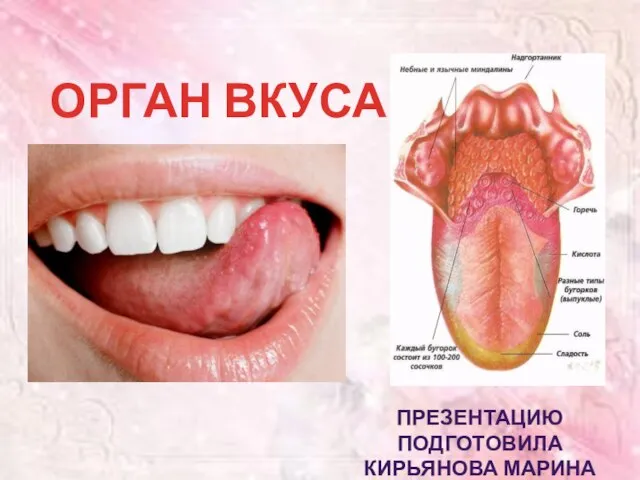 Презентация на тему Орган вкуса
Презентация на тему Орган вкуса  Ткани организма человека
Ткани организма человека Основы анатомии, физиологии и биофизики
Основы анатомии, физиологии и биофизики Происхождение человека
Происхождение человека Мейоз
Мейоз змеи урала
змеи урала История одомашнивания ослов
История одомашнивания ослов Ботанический поезд. Объединение ЭкоВектор
Ботанический поезд. Объединение ЭкоВектор Так образуются мегаспора и яйцеклетка
Так образуются мегаспора и яйцеклетка Garden flowers
Garden flowers Головной мозг
Головной мозг Сказочный овощ тыква
Сказочный овощ тыква Многообразие живых организмов. Урок 1
Многообразие живых организмов. Урок 1 Обмен углеводов. Гликолиз
Обмен углеводов. Гликолиз Дарлингтония калифорнийская
Дарлингтония калифорнийская Ассортимент+хвойных+растений+для+озеленения+в+Сибири
Ассортимент+хвойных+растений+для+озеленения+в+Сибири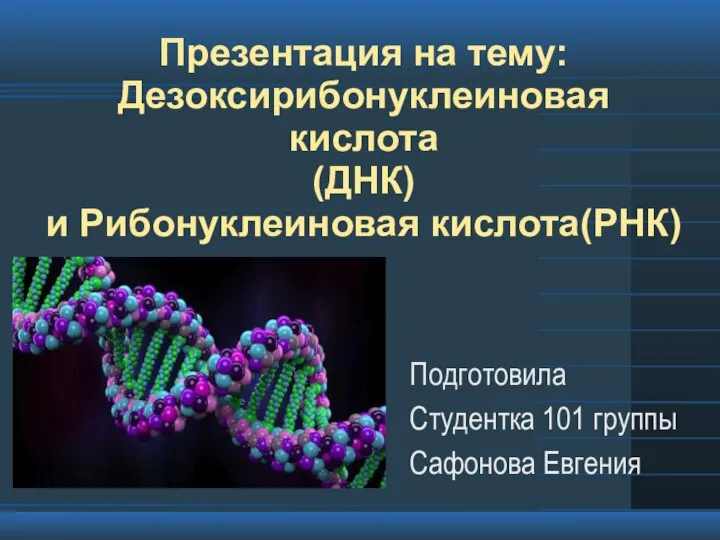 Дезоксирибонуклеиновая кислота (ДНК) и Рибонуклеиновая кислота (РНК)
Дезоксирибонуклеиновая кислота (ДНК) и Рибонуклеиновая кислота (РНК) Дөрес җавапны сайларга
Дөрес җавапны сайларга Империя Клеточные. Надцарство Прокариоты. Царство Дробянки. Подцарство: архебактерии, эубактерии, цианобактерии (с-з)
Империя Клеточные. Надцарство Прокариоты. Царство Дробянки. Подцарство: архебактерии, эубактерии, цианобактерии (с-з) Миология. Мышцы спины поверхностные
Миология. Мышцы спины поверхностные Ткани. Эпителиальные, соединительные, мышечные, нервная ткани. Строение и функция нейрона. Синапс. Образование тканей
Ткани. Эпителиальные, соединительные, мышечные, нервная ткани. Строение и функция нейрона. Синапс. Образование тканей