Содержание
- 2. Метаболизм представляет собой совокупность двух разнонаправленных процессов: катаболизма, анаболизма и энергетический обмен. Обмен веществ включает: поступление
- 3. Экзергонические реакции ΔG 0 1г. белков – 17кДж (4,2ккал) 1г. углеводов ̴ 17кДж (4,1ккал) 1г. жиров
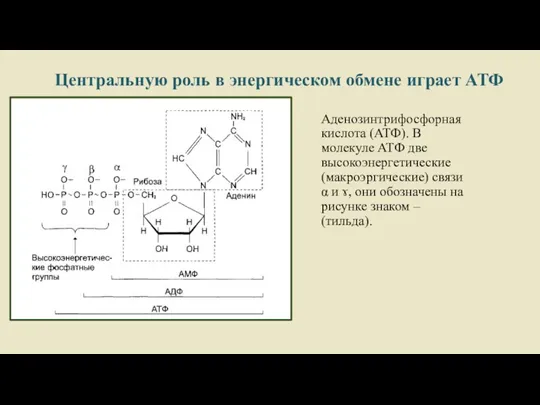
- 4. Центральную роль в энергическом обмене играет АТФ Аденозинтрифосфорная кислота (АТФ). В молекуле АТФ две высокоэнергетические (макроэргические)
- 5. Энергия Гиббса гидролиза некоторых соединений Если энергия, освобождающаяся при реакциях гидролиза превышает 30 кДж/моль, то гидролизуемую
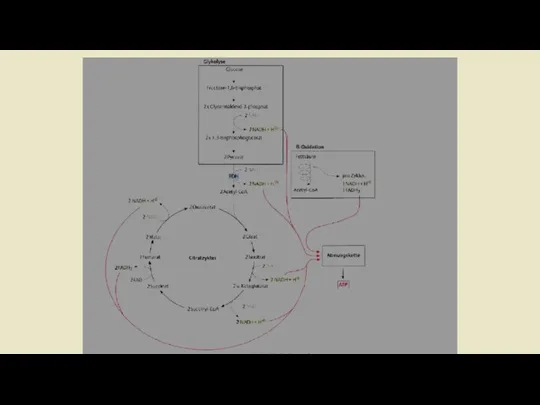
- 6. Наиболее важными экзергоническими реакциями метаболизма являются реакции окисления органических веществ, в которых используется кислород и образуется
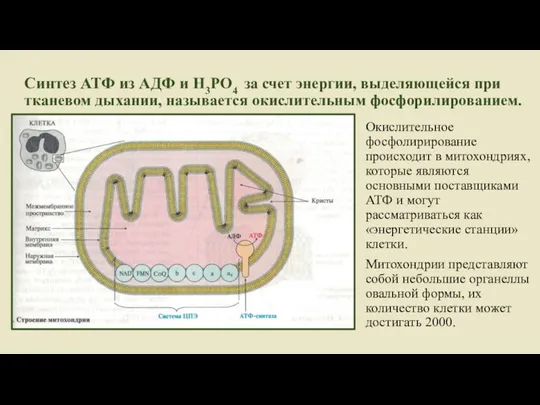
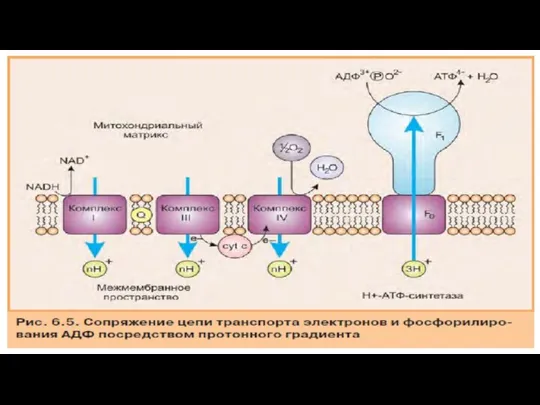
- 7. Синтез АТФ из АДФ и Н3РО4 за счет энергии, выделяющейся при тканевом дыхании, называется окислительным фосфорилированием.
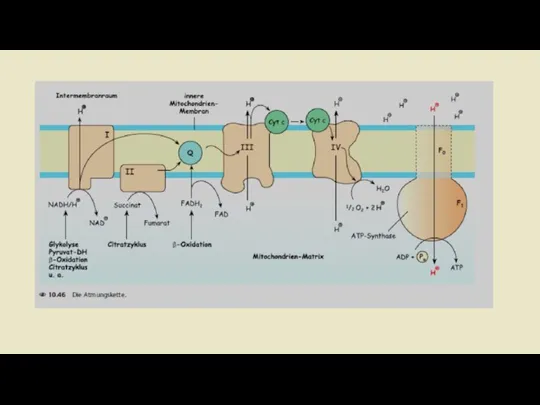
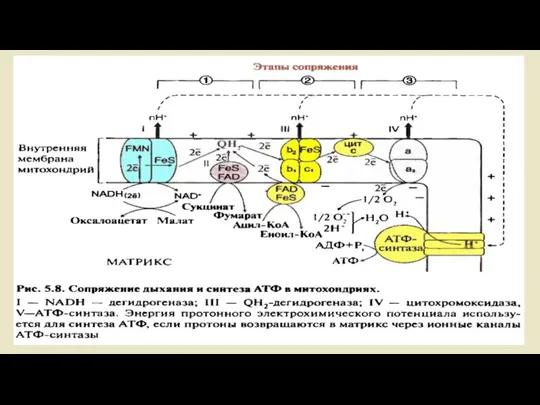
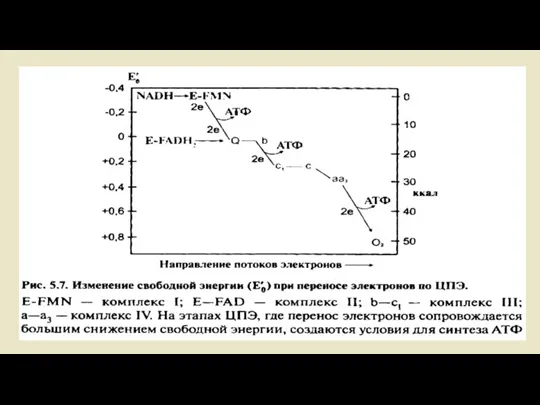
- 8. Функция дыхательной цепи заключается в ситезе АТФ, которая затем может использоваться для энергетически невыгодных реакциях. Хемиосмотическая
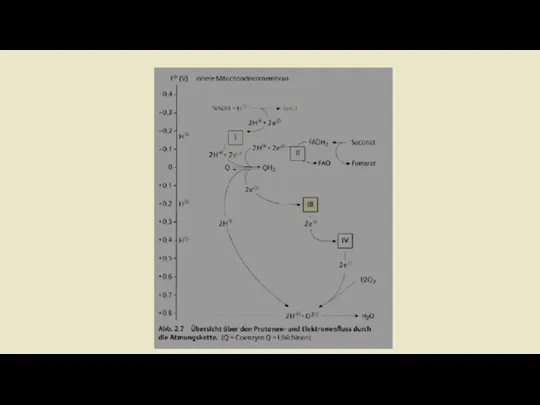
- 10. Дыхательная цепь как цепь переноса электронов -Химическая реакция, лежащая в основе образования воды в дыхательной цепи,
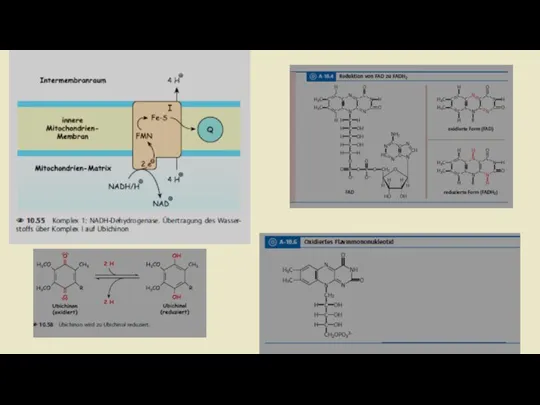
- 13. Комплексы дыхательной цепи Комплекс 1: НАДН-убихинон-редуктаза ln комплекс I происходит перенос электронов от NADH + H
- 15. Кластер железасерный встречаются в разных вариантах. В качестве простетической группы, они координированы с различными остатками цистеинабелка.
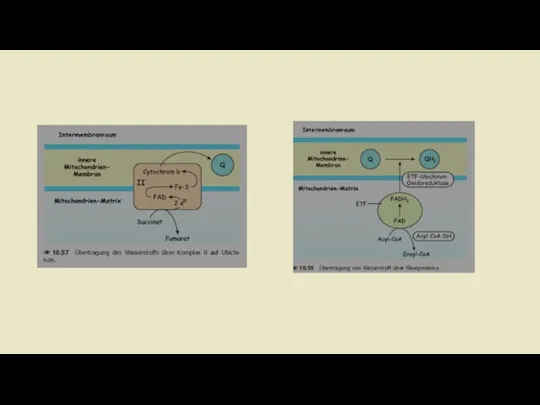
- 16. Комплекс II: Сукцинат-убихинон-редуктаза Комплекс II дыхательной цепи одновременно является ферментом цитратного цикла, а именно сукцинатдегидрогеназой. Это
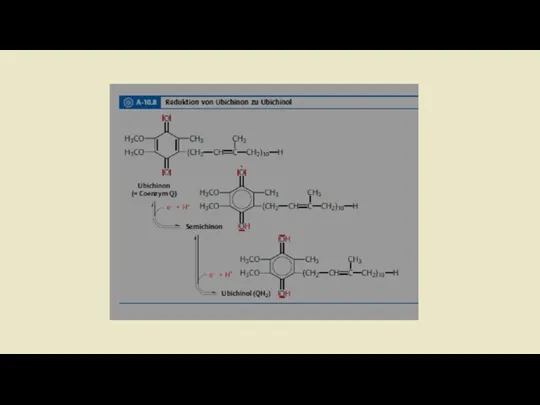
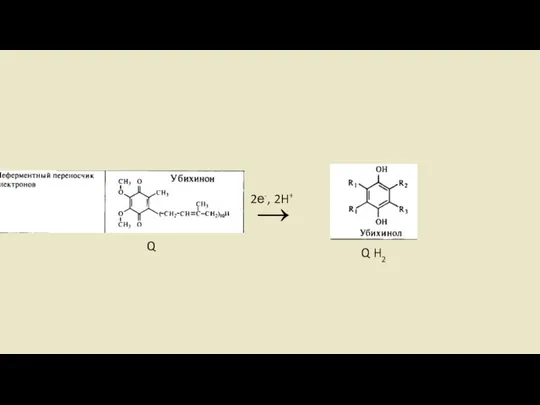
- 18. Ubichinon-Ubichino Системы Убихинон или кофермент Q состоит из одного хинона и одной изопреновая боковой цепи. Структурно
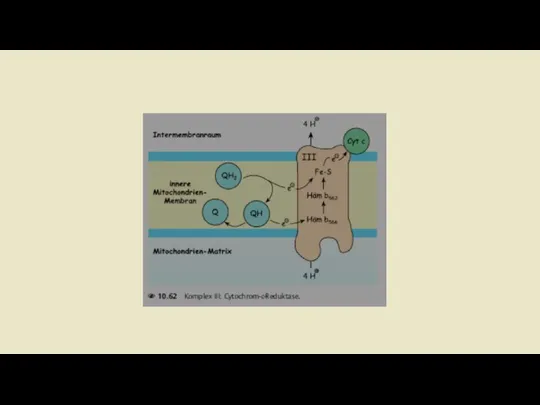
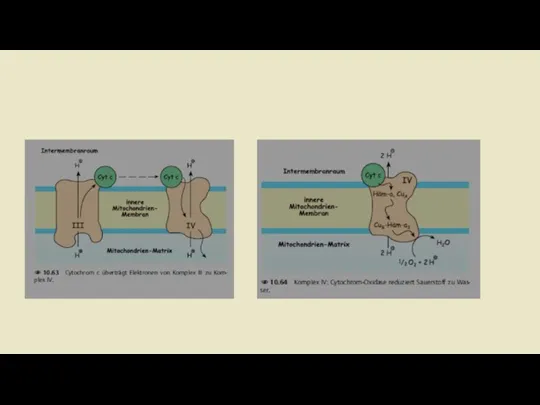
- 20. Комплекс III: Убихинол-цитохром с-редуктаза Задача комплекса 3 теперь заключается в передаче электронов убихинола на цитохром С.
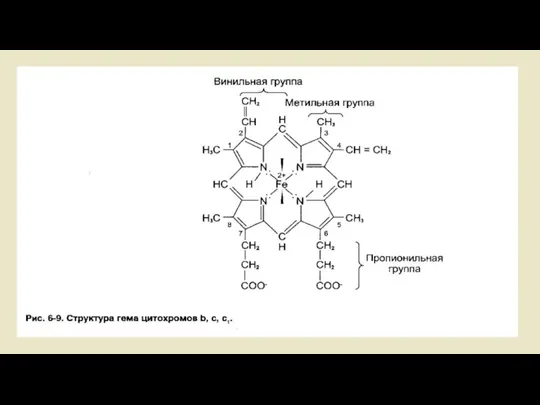
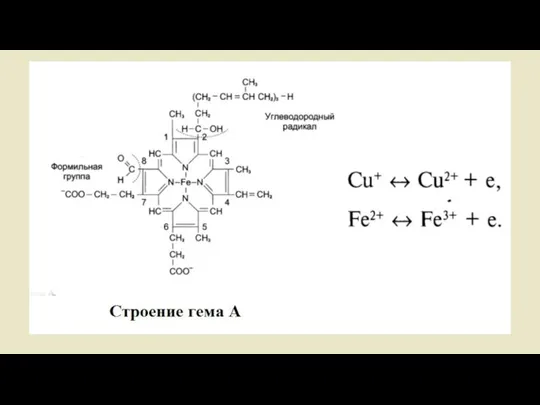
- 22. Цитохромы Цитохромы - это гемсодержащие белки. В видимом свете спектра поглощения востановительные группы гема имеют три
- 23. Комплекс IV: цитохром-с-оксидаза Задача комплекса IV заключается в переносе электронов с цитохрома с на молекулярный кислород.
- 25. Комплекс V: АТФ-синтаза Комплексы I. lll и IV способствуют созданию протонного градиента через внутреннюю мембрану митохондрий.
- 26. Строение и механизм действия АТФ - синтетазы. А – F0 и F1 – комплексы АТФ –
- 28. Коэффициент фосфорилирования P/O Коэффициент Р/О – это отношение количества неорганического фосфата, включенного в молекулу АТФ АТФ-синтазой,
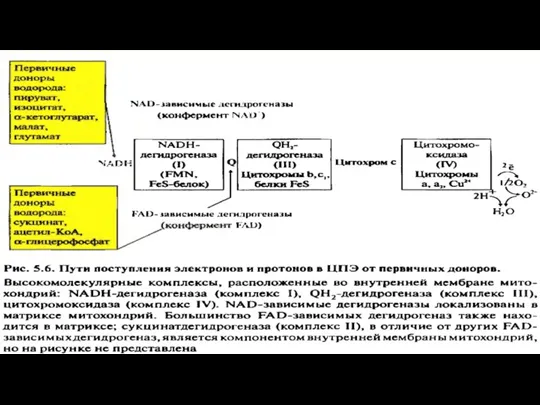
- 31. Большинство дегидрогеназ, поставляющих электроны в межмембранные пространства содержат НАД. Они катализируют реакции типа R – CHOH
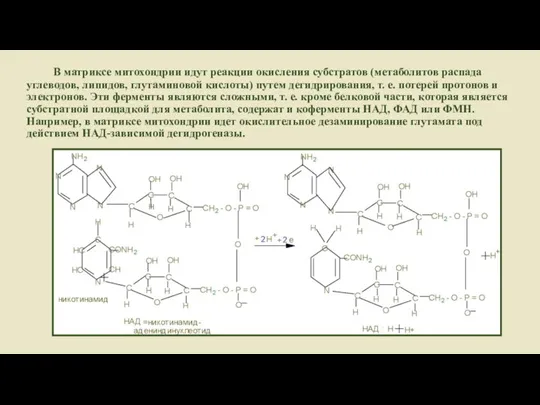
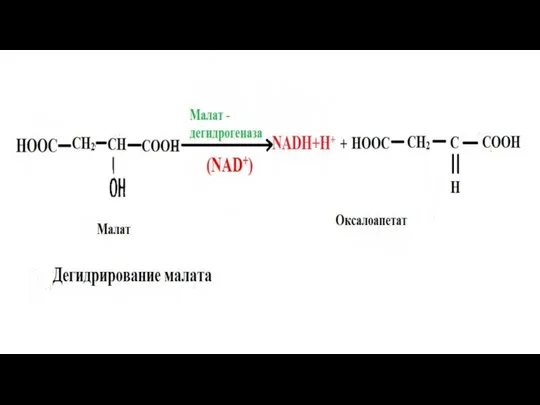
- 32. В матриксе митохондрии идут реакции окисления субстратов (метаболитов распада углеводов, липидов, глутаминовой кислоты) путем дегидрирования, т.
- 36. Строение железо-серных центров Ι - FeS - центр; атом железа связан координационными связями с четырьмя атомами
- 37. → 2е-, 2H+ Q Q H2
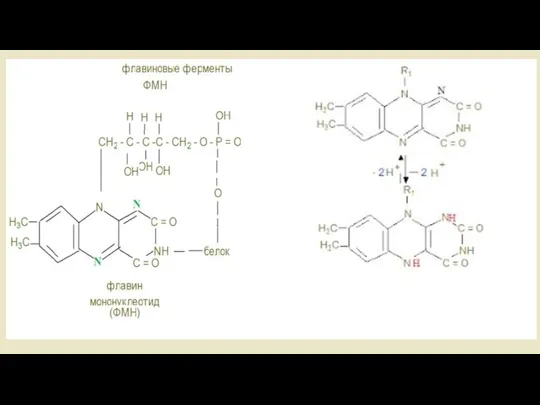
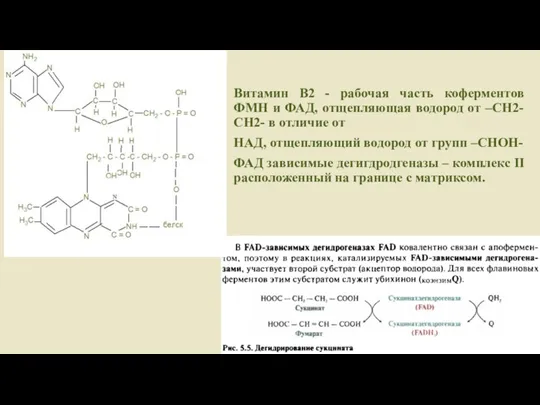
- 38. Витамин В2 - рабочая часть коферментов ФМН и ФАД, отщепляющая водород от –СН2- СН2- в отличие
- 41. На внутренней мембране митохондрии существует система переносчиков, их действие векторно. Они переносят протоны и электроны с
- 43. Протоны перенесенные в межмембранное пространство создают протонный градиент подкисляя его 1,4 рН. Кроме того, появляется разность
- 45. Механизм разобщения дыхания и фосфорилирования. Протонированная форма 2,4 – динитрофенола переносит протоны через внутреннюю мембрану митохондрий
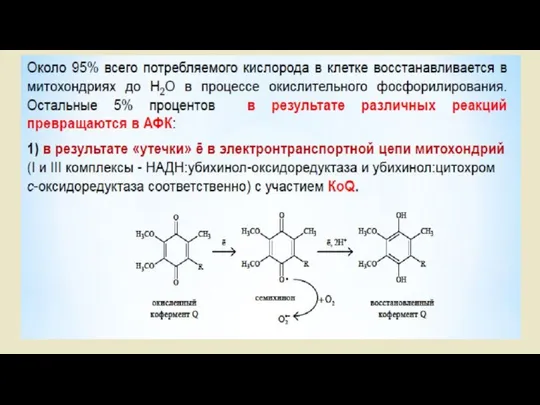
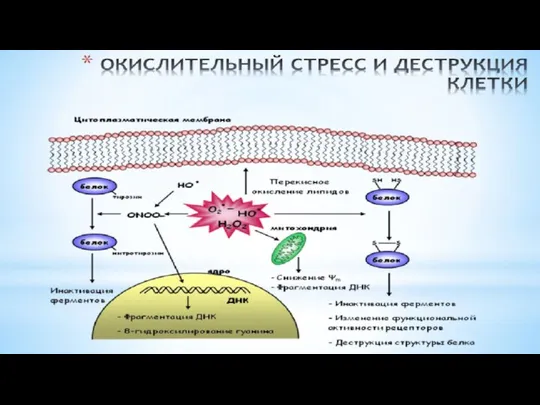
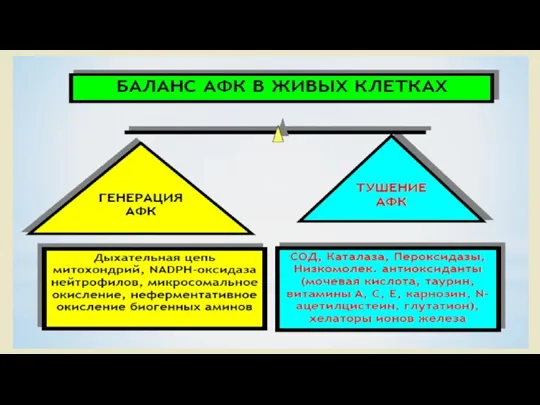
- 46. Активные формы кислорода и антиоксидантные системы. Проблема свободных радикалов в последнее десятилетие произвела настоящую революцию в
- 47. В эритроцитах окисление иона железа гемоглобина способствует образованию супероксидоного аниона. Hb (Fe2+) + O2 →MtHb (Fe+3)
- 48. Примеры свободных радикалов.
- 49. 2. ионы – гипохлорит -ион ClO4 – сопряженное основание для хлорноватистой кислоты, активный компонент отбеливателей. 3.
- 50. Образование токсичных форм при постепенном восстановлении кислорода.
- 53. Свободно-радикальное окисление нарушает структуру нуклеиновых кислот, белков и, особенно, непредельные жирные кислоты (липиды), принимающие электрон от
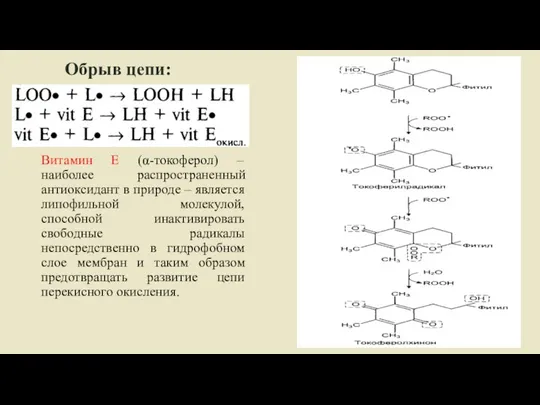
- 54. Обрыв цепи: Витамин Е (α-токоферол) – наиболее распространенный антиоксидант в природе – является липофильной молекулой, способной
- 55. В эритроцитах:
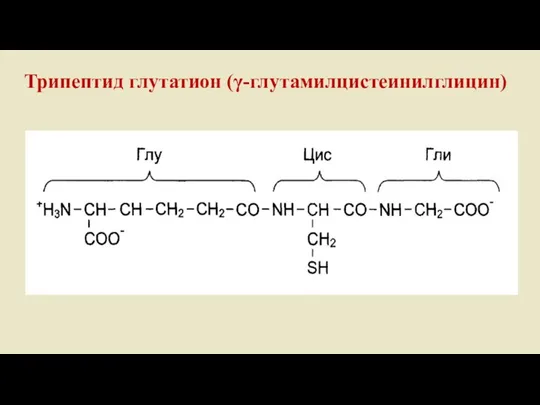
- 56. Трипептид глутатион (γ-глутамилцистеинилглицин)
- 57. Кроме витамина Е антиоксидантами являются: витамин С, β−каротин. Во-первых, витамин С восстанавливает окисленную форму витамина Е.
- 61. Скачать презентацию
































 Разнообразие отрядов класса Млекопитающие. Биологический диктант
Разнообразие отрядов класса Млекопитающие. Биологический диктант Способы расселения растений
Способы расселения растений Перелетные птицы
Перелетные птицы Схема строения почки
Схема строения почки Dangerous animals of Russia
Dangerous animals of Russia Жылқы
Жылқы Презентация на тему Химические элементы в организме человека
Презентация на тему Химические элементы в организме человека  Где зимуют птицы. Тест
Где зимуют птицы. Тест Цитоплазма клетки: органеллы общего и специального значения
Цитоплазма клетки: органеллы общего и специального значения Классификация комнатных растений
Классификация комнатных растений Красная книга Ростовской области
Красная книга Ростовской области Учебный проект на тему: Вода
Учебный проект на тему: Вода Технологии животноводства. Заболевания животных и их предупреждение
Технологии животноводства. Заболевания животных и их предупреждение Семейство Розовые (груша, яблоня, рябина, черемуха)
Семейство Розовые (груша, яблоня, рябина, черемуха) Отдел покрытосеменные или цветковые
Отдел покрытосеменные или цветковые Белок ДНК
Белок ДНК Индикатор успеваемости. Контрольно-измерительные материалы по биологии для 8-9 классов
Индикатор успеваемости. Контрольно-измерительные материалы по биологии для 8-9 классов Микроскопы и микроскопирование
Микроскопы и микроскопирование Отряд хоботные
Отряд хоботные Методы в биологии. Семья биологических наук. 10 класс
Методы в биологии. Семья биологических наук. 10 класс Фотосинтез
Фотосинтез Критические факторы, влияющие на развитие плода
Критические факторы, влияющие на развитие плода Головной мозг
Головной мозг Иммуноферментный анализ (ИФА)
Иммуноферментный анализ (ИФА) Анализаторы (органы чувств), их строения и функции, зрительный анализатор
Анализаторы (органы чувств), их строения и функции, зрительный анализатор Ранневесенние растения. Эфемероиды
Ранневесенние растения. Эфемероиды Итоговая пищеварительная система
Итоговая пищеварительная система Класс Млекопитающие. Отряды Китообразные, Ластоногие, Хоботные, Хищные. 7 класс
Класс Млекопитающие. Отряды Китообразные, Ластоногие, Хоботные, Хищные. 7 класс