Содержание
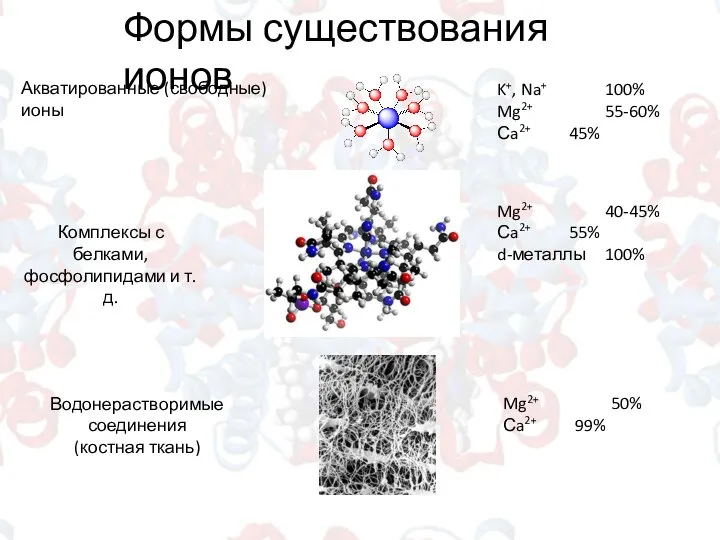
- 2. Формы существования ионов Акватированные (свободные) ионы K+, Na+ 100% Mg2+ 55-60% Сa2+ 45% Комплексы с белками,
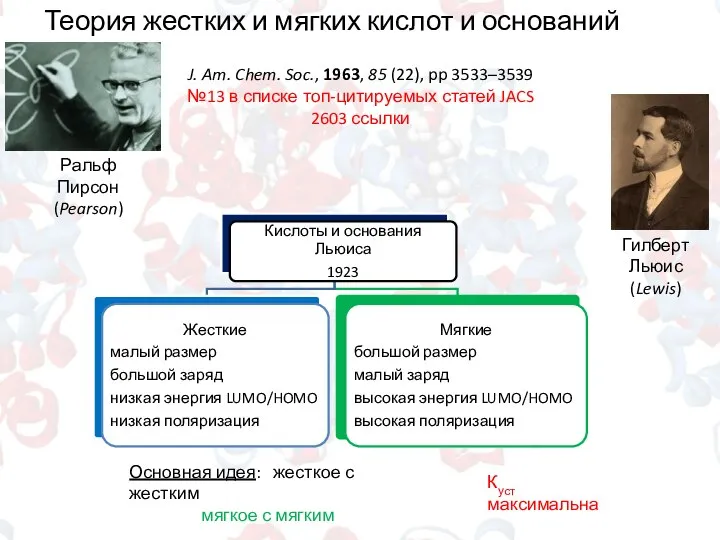
- 3. Теория жестких и мягких кислот и оснований Пирсона Ральф Пирсон (Pearson) J. Am. Chem. Soc., 1963,
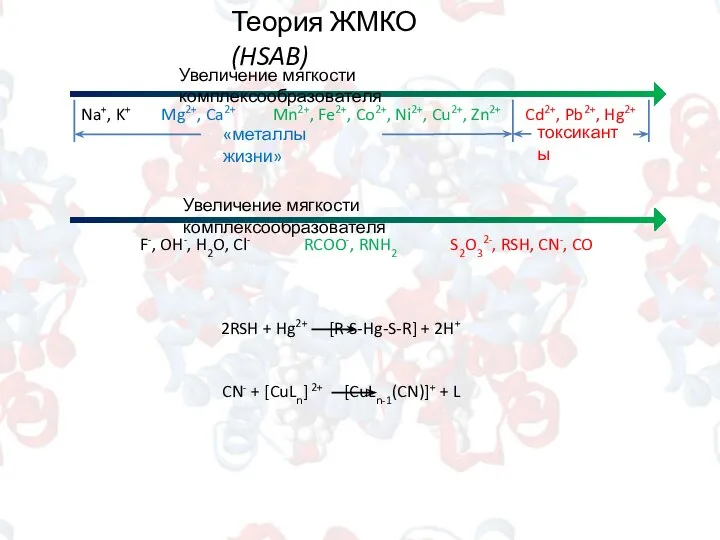
- 4. Теория ЖМКО (HSAB) Увеличение мягкости комплексообразователя Na+, K+ Mg2+, Ca2+ Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+
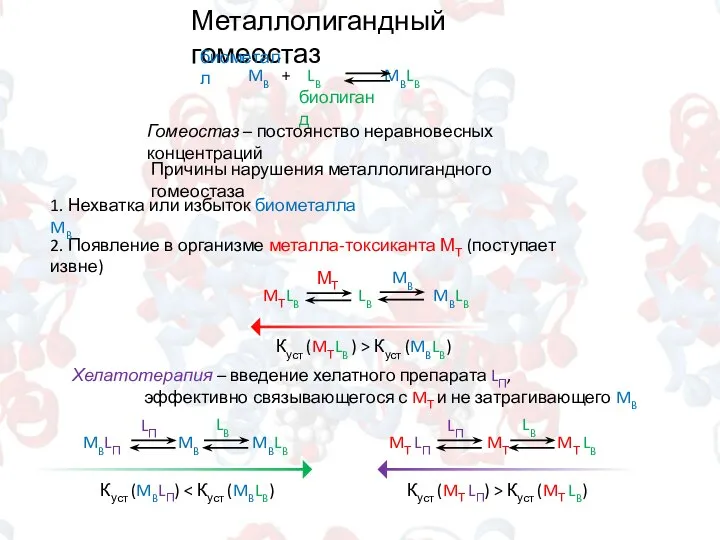
- 5. Металлолигандный гомеостаз биометалл биолиганд Гомеостаз – постоянство неравновесных концентраций 2. Появление в организме металла-токсиканта МТ (поступает
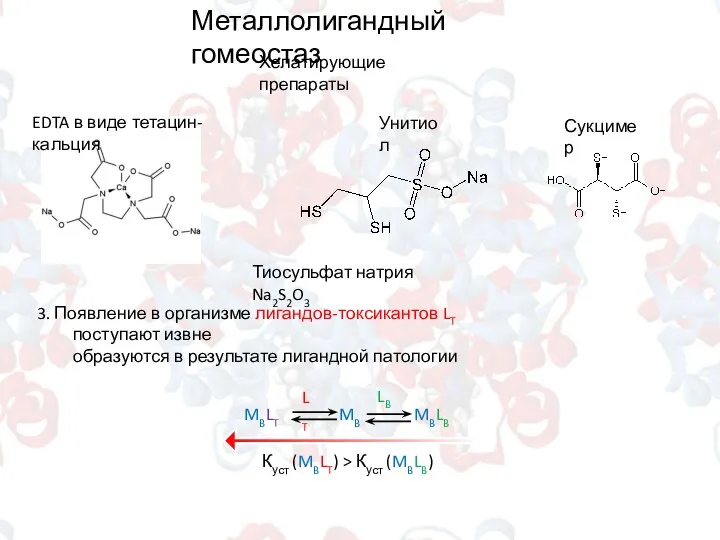
- 6. Металлолигандный гомеостаз Хелатирующие препараты EDTA в виде тетацин-кальция Унитиол Сукцимер Тиосульфат натрия Na2S2O3 3. Появление в
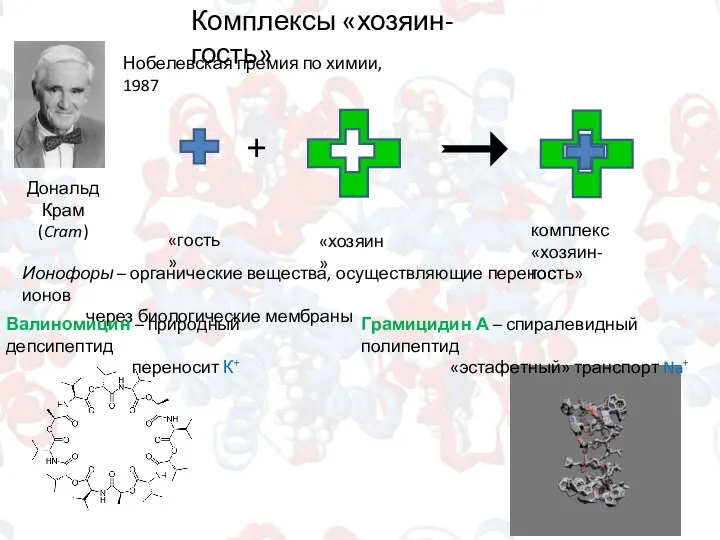
- 7. Комплексы «хозяин-гость» Дональд Крам (Cram) + «гость» «хозяин» комплекс «хозяин-гость» Нобелевская премия по химии, 1987 Ионофоры
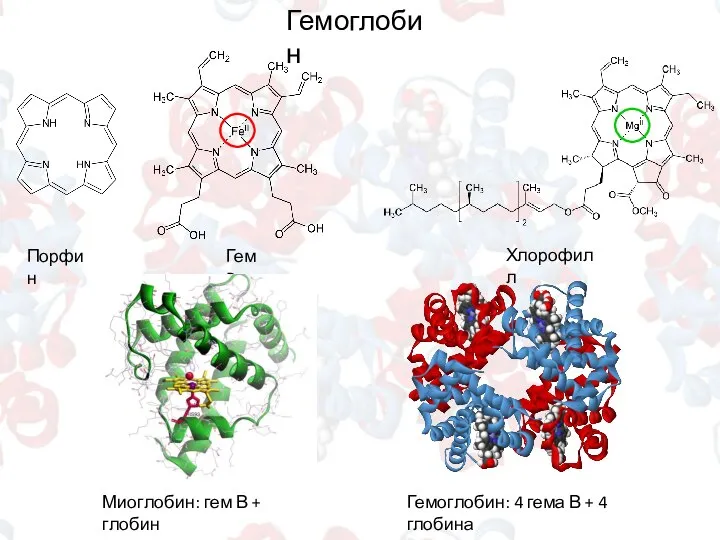
- 8. Гемоглобин Порфин Гем B Хлорофилл Миоглобин: гем В + глобин Гемоглобин: 4 гема В + 4
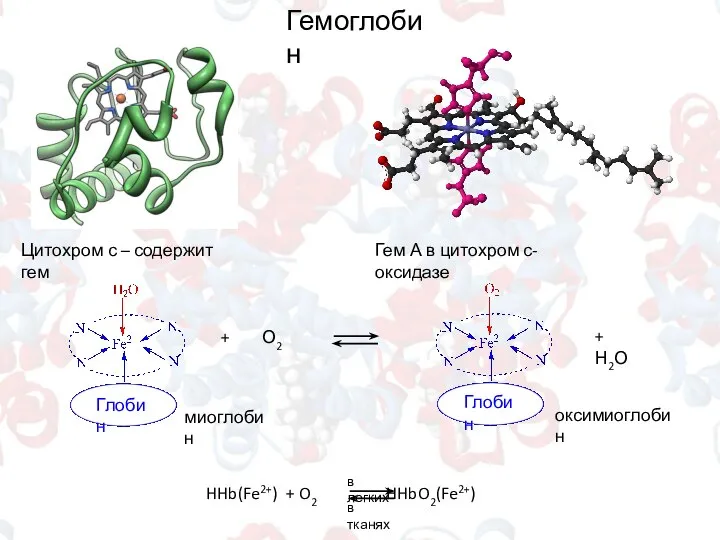
- 9. в легких Гемоглобин Цитохром с – содержит гем Гем А в цитохром с-оксидазе миоглобин оксимиоглобин +
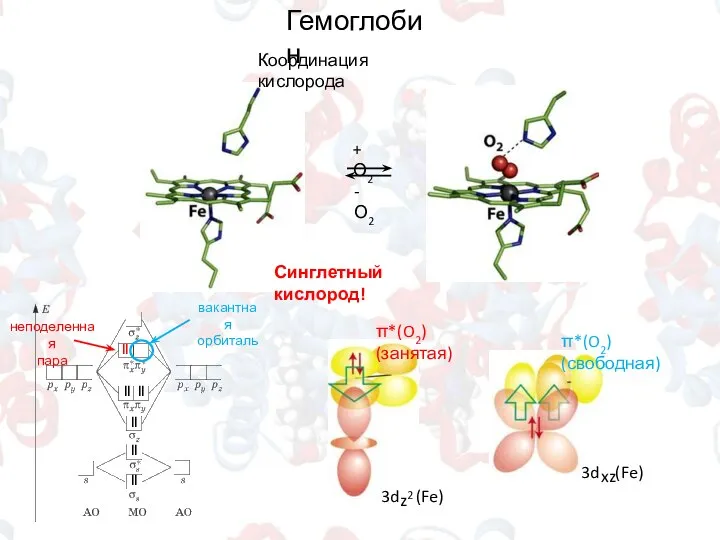
- 10. Гемоглобин Координация кислорода + О2 - О2 π*(O2) (занятая) π*(O2) (свободная) Синглетный кислород! ǁ ǁ ǁ
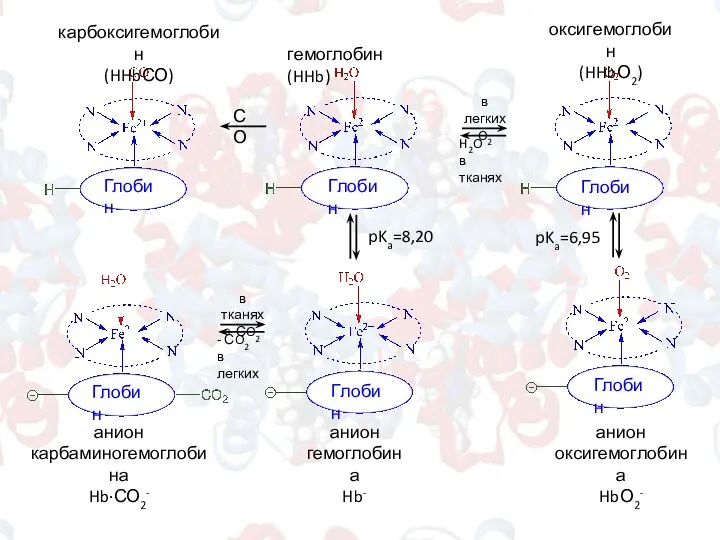
- 11. - СO2 в легких в тканях + СO2 в легких O2 H2O в тканях Глобин Глобин
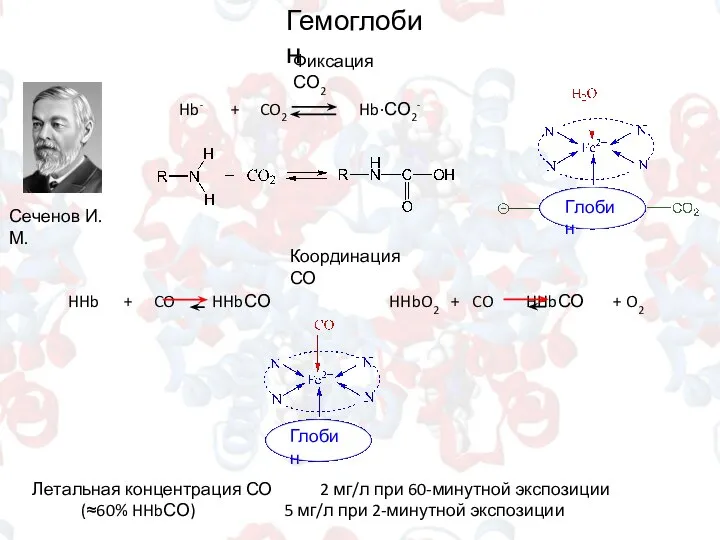
- 12. Сеченов И.М. Фиксация СО2 Гемоглобин Координация СО Летальная концентрация СО 2 мг/л при 60-минутной экспозиции (≈60%
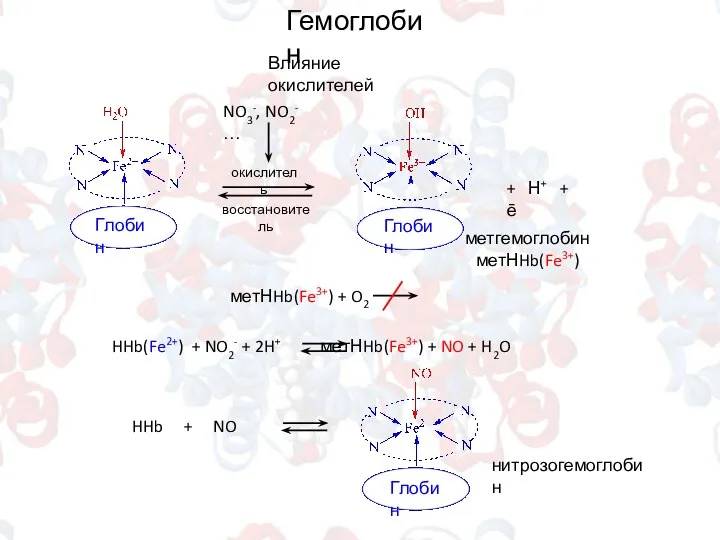
- 13. Влияние окислителей Глобин Гемоглобин окислитель восстановитель + Н+ + ē NO3-, NO2- … метгемоглобин метНHb(Fe3+) HHb
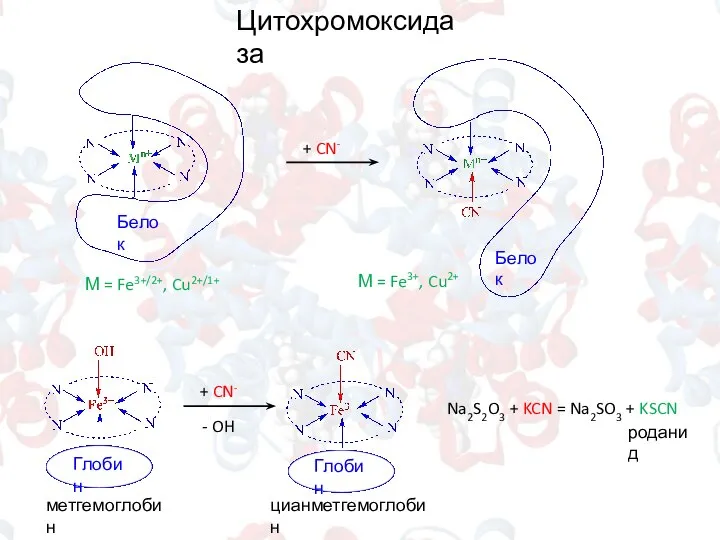
- 14. Цитохромоксидаза М = Fe3+/2+, Cu2+/1+ + CN- М = Fe3+, Cu2+ + CN- - OH Na2S2O3
- 16. Скачать презентацию
 Природа. Юные экологи
Природа. Юные экологи Структура ядра эукариотической клетки. Функции ядра. Репликация ДНК. Лекция 3
Структура ядра эукариотической клетки. Функции ядра. Репликация ДНК. Лекция 3 Внутренние органы человека
Внутренние органы человека Значение фотосинтеза
Значение фотосинтеза Дефференация диких животных от домашних
Дефференация диких животных от домашних Введение в биологию. Свойства живого. Функции нуклеиновых кислот. Три домена по Вёзе. Неклеточные формы жизни
Введение в биологию. Свойства живого. Функции нуклеиновых кислот. Три домена по Вёзе. Неклеточные формы жизни Презентация на тему Какие бывают собаки
Презентация на тему Какие бывают собаки  Предмет и история развития биомеханики
Предмет и история развития биомеханики Происхождение рыб
Происхождение рыб Межвидовые взаимоотношения организмов
Межвидовые взаимоотношения организмов Ленточные черви. Занятие 6
Ленточные черви. Занятие 6 Органы дыхания и газообмен
Органы дыхания и газообмен Лексическая тема Насекомые
Лексическая тема Насекомые Земноводные или амфибии
Земноводные или амфибии 27.1. Эволюция (теории, критерии, видообразование, факторы Э)
27.1. Эволюция (теории, критерии, видообразование, факторы Э) Питомник Ясавэй представляет
Питомник Ясавэй представляет 04. Двумембранные органоиды
04. Двумембранные органоиды Sponge spicules
Sponge spicules Радуга цветов
Радуга цветов История генетики. Основные понятия генетики (урок 19)
История генетики. Основные понятия генетики (урок 19) Опорно-двигательная система
Опорно-двигательная система Лягушки
Лягушки Презентация на тему "Тело человека Скелет .Мышцы" - презентации по Биологии
Презентация на тему "Тело человека Скелет .Мышцы" - презентации по Биологии Бладхаунд. Любимая порода собаки
Бладхаунд. Любимая порода собаки Кровеносная система
Кровеносная система Конкурсное задание Лесоводство
Конкурсное задание Лесоводство Hulumtim ekologjik
Hulumtim ekologjik Размножение растений
Размножение растений