Содержание
- 2. Ферменты или энзимы - особые белки, выполняющие функцию катализаторов химических реакций; Практически все химические реакции в
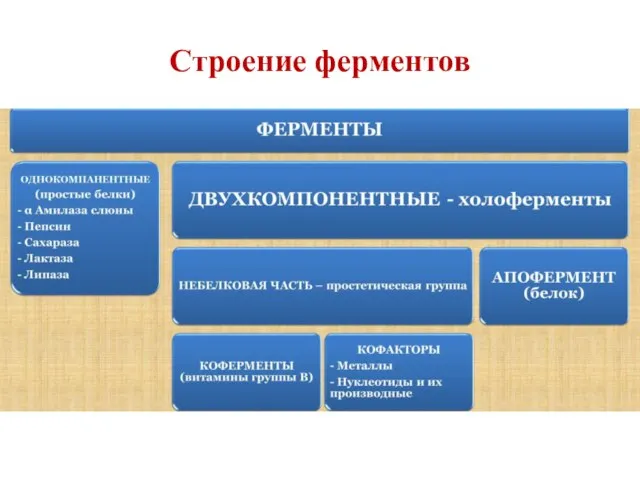
- 3. Строение ферментов
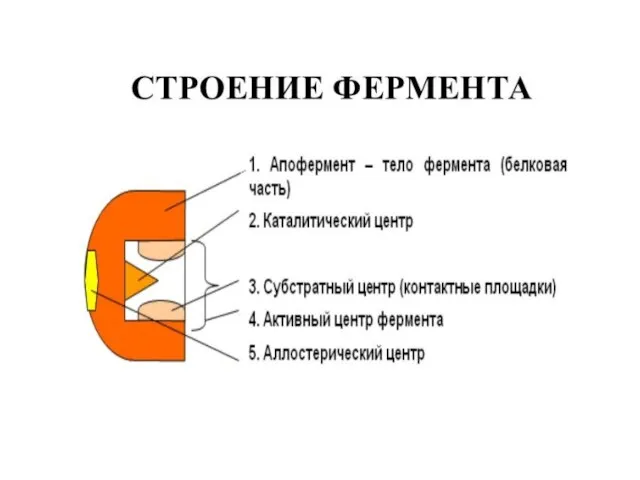
- 5. Участок молекулы фермента, на котором происходит катализ, получил название «активный центр»; Если фермент по строению является
- 6. Адсорбционный участок (центр связывания, субстратный центр) по своему строению соответствует структуре реагирующих соединений, и поэтому к
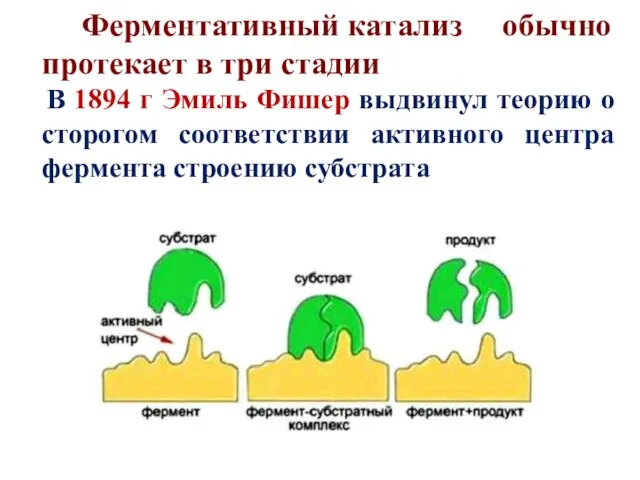
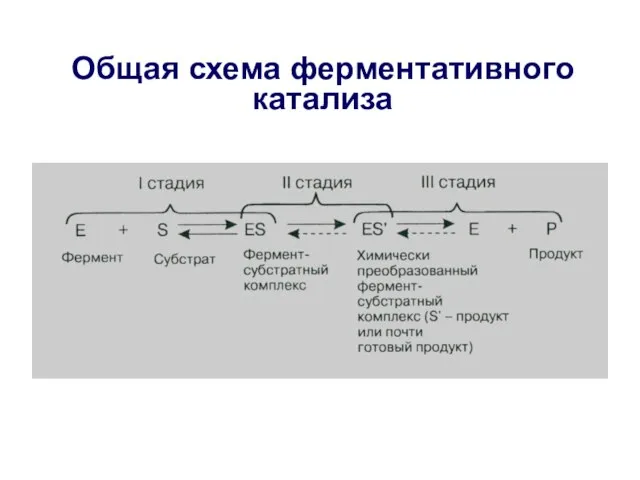
- 8. Ферментативный катализ обычно протекает в три стадии В 1894 г Эмиль Фишер выдвинул теорию о сторогом
- 9. I стадия – образование фермент-субстратного комплекса На этой стадии молекулы реагирующих веществ (субстрата) присоединяются к адсорбционному
- 10. II стадия – химическое преобразование фермент-субстратного комплекса На второй стадии с участием каталитического участка активного центра
- 11. III стадия - образование конечного продукта На третьей стадии происходит отделение продукта реакции от активного центра
- 12. Общая схема ферментативного катализа
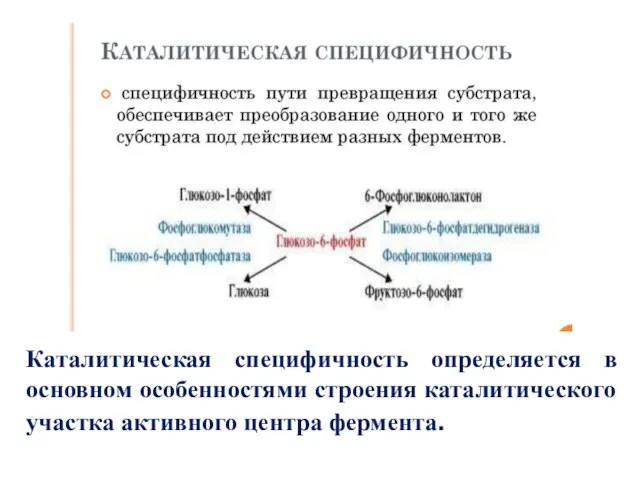
- 13. Специфичность ферментов Различают два вида специфичности ферментов: специфичность действия или каталитическая специфичность и субстратная специфичность; Специфичность
- 14. Каталитическая специфичность определяется в основном особенностями строения каталитического участка активного центра фермента.
- 15. Субстратная специфичность – способность фермента действовать только на определенные субстраты; Различают две разновидности субстратной специфичности: абсолютную
- 16. Фермент, обладающий абсолютной субстратной специфичностью, катализирует превращения только одного субстрата; На другие вещества, даже очень близкие
- 18. Относительная (групповая) субстратная специфичность – это способность фермента катализировать превращения нескольких похожих по строению веществ; Обычно
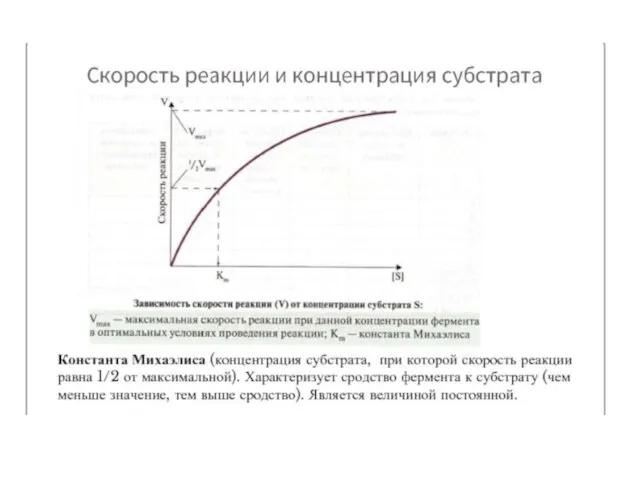
- 19. Кинетика ферментативного катализа Скорость ферментативных реакций существенно зависит от многих факторов; К ним относятся концентрации участников
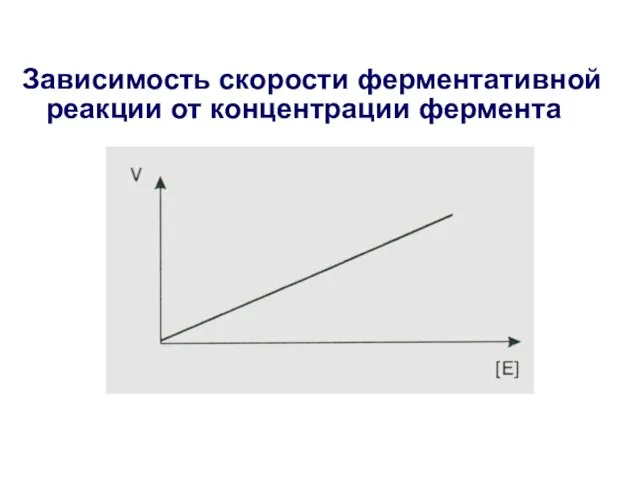
- 20. Зависимость скорости ферментативной реакции от концентрации фермента
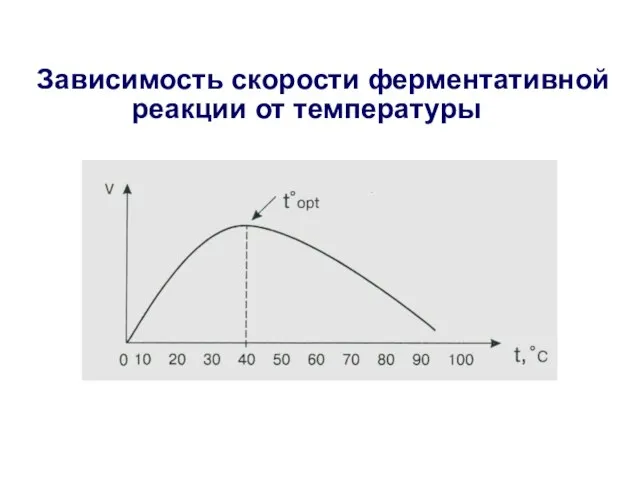
- 22. Зависимость скорости ферментативной реакции от температуры
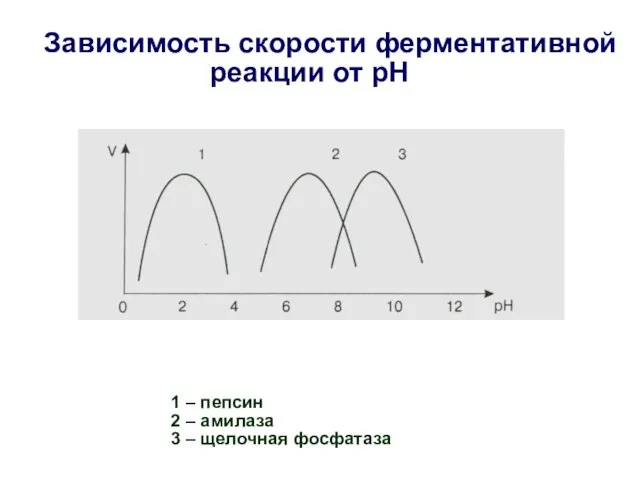
- 23. Зависимость скорости ферментативной реакции от рН 1 – пепсин 2 – амилаза 3 – щелочная фосфатаза
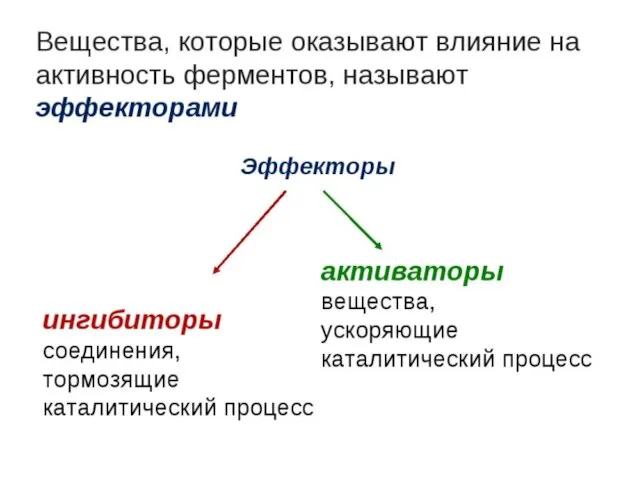
- 25. Ингибиторы и активаторы ферментов Ингибиторы (I) - это химические соединения (обычно низкомолекулярные), которые, находясь в низких
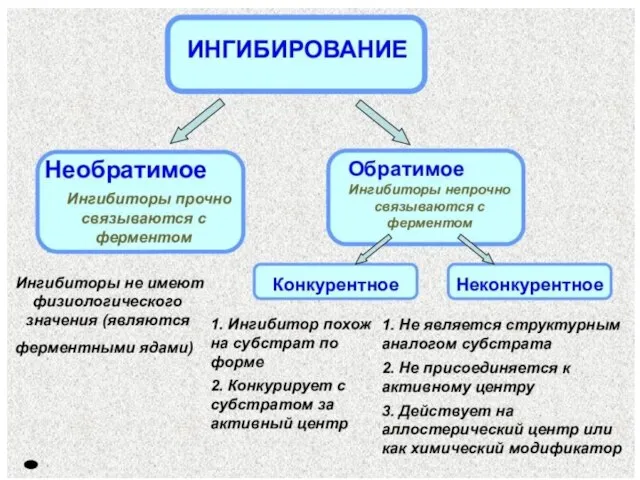
- 27. Если связи между ферментом и ингибитором прочные, то действие ингибитора носит необратимый характер, и торможение нарастает
- 28. Если ингибитор присоединяется к ферменту за счет непрочных связей, то торможение фермента является обратимым и не
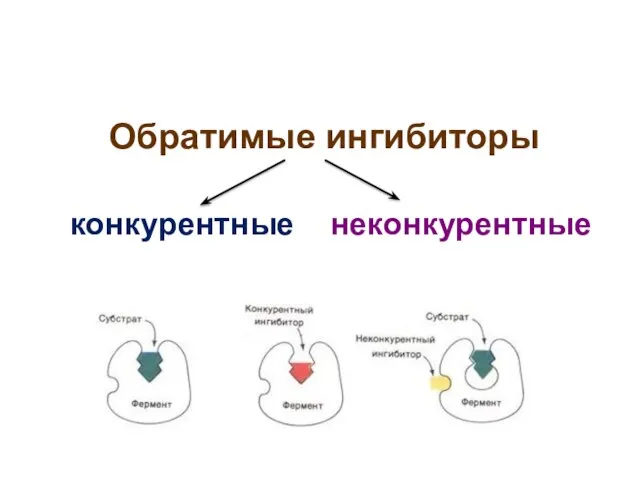
- 29. Обратимые ингибиторы конкурентные неконкурентные
- 30. Конкурентные ингибиторы присоединяются к активному центру фермента, т.е. к тому же участку поверхности фермента, что и
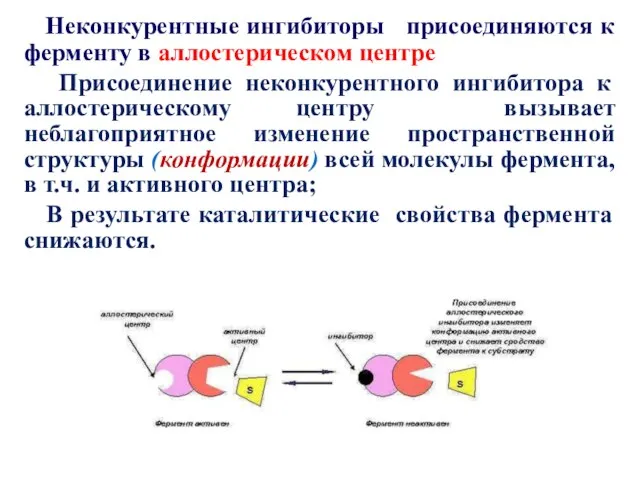
- 31. Неконкурентные ингибиторы присоединяются к ферменту в аллостерическом центре Присоединение неконкурентного ингибитора к аллостерическому центру вызывает неблагоприятное
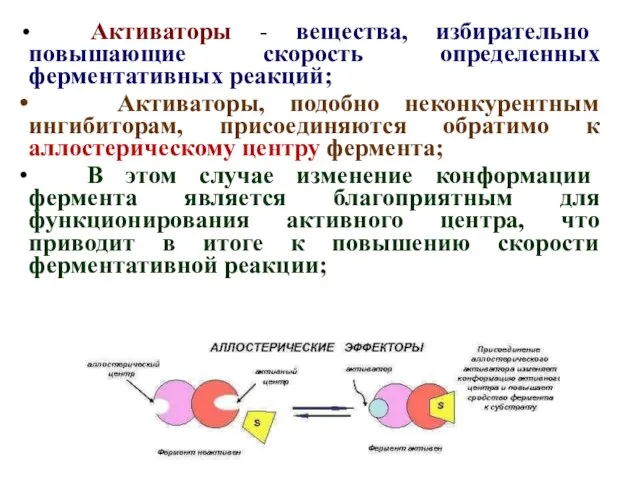
- 32. Активаторы - вещества, избирательно повышающие скорость определенных ферментативных реакций; Активаторы, подобно неконкурентным ингибиторам, присоединяются обратимо к
- 33. Эффекторами ферментативной активности являются некоторые гормоны, промежуточные или конечные продукты путей метаболизма, ионы металлов, АТФ, АДФ,
- 34. Регуляция скорости ферментативных реакций Особенностью ферментативных реакций является наличие механизмов регуляции их скорости; Благодаря регуляторным механизмам
- 35. Основные механизмы регуляции скорости ферментативных реакций Изменение скорости синтеза ферментов; Модификация ферментов; Изменение конформации ферментов;
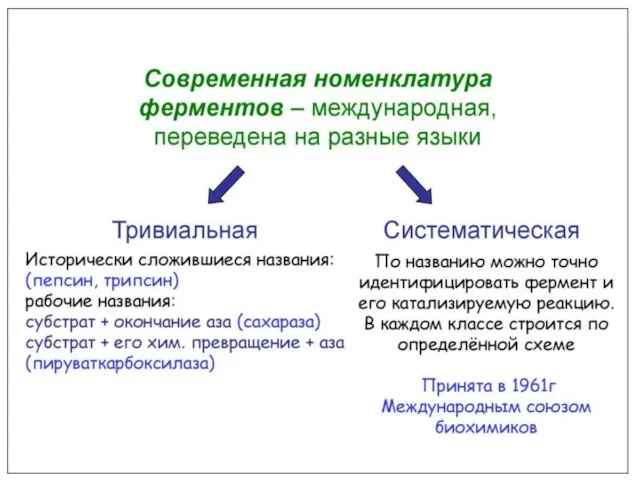
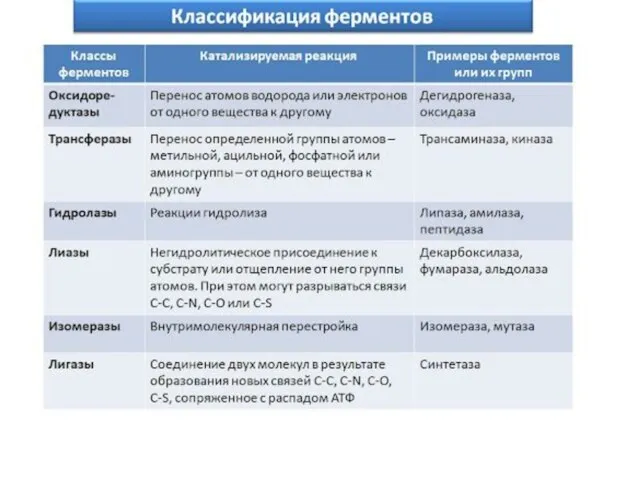
- 36. Классификация и индексация ферментов Современная классификация ферментов основывается на характере химической реакции, катализируемой ферментом; Все ферменты
- 37. Современные классификация и номенклатура ферментов были разработаны Комиссией по ферментам Международного биохимического союза. И утверждены на
- 40. Транслоказы (EC 7.X.X.X). В августе 2018 г. учеными Университета Маккуори (Macquarie University, Австралия) был предложен 7-й
- 41. В настоящее время разрабатывается номенклатура для каждого фермента транслоказы. • Номенклатурные номера ферментов АТФ-аз скоро изменятся
- 42. Индексация (нумерация) ферментов Индекс (шифр) каждого фермента состоит из четырех чисел, разделенных точками; Первая цифра индекса
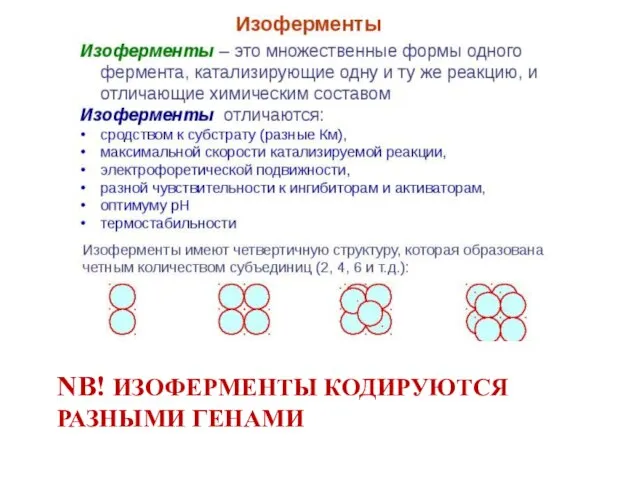
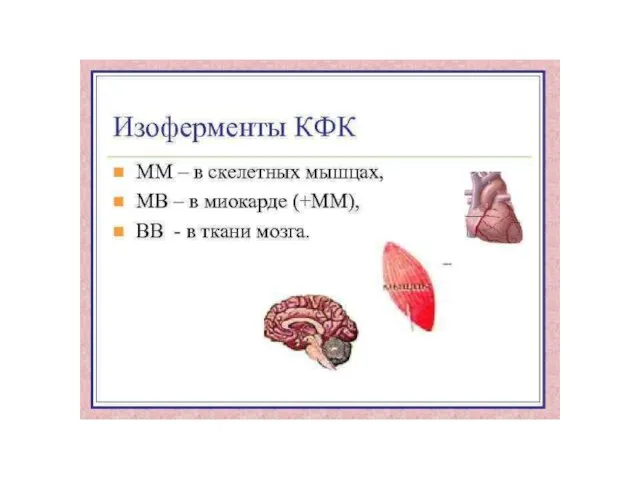
- 43. NB! ИЗОФЕРМЕНТЫ КОДИРУЮТСЯ РАЗНЫМИ ГЕНАМИ
- 46. Тест 1 Ферменты в организме выполняют функцию: а) каталитическую б) структурную в) транспортную г) энергетическую
- 47. Тест 2 Ферменты проявляют оптимальную активность при температуре: а) 0-10 ̊̊̊С б) 35-40 ̊̊̊С в) 55-75
- 48. Тест 3 Первой стадией ферментативного катализа является: а) возвращение фермента в исходное состояние б) образование фермент-субстратного
- 49. Тест 4 Ферменты обладают наибольшей активностью: а) в кислой среде б) в нейтральной среде в) в
- 50. Тест 5 Скорость ферментативной реакции зависит от: а) аминокислотного состава фермента б) концентрации фермента в) молекулярной
- 51. Тест 6 Конкурентные ингибиторы снижают скорость ферментативных реакций вследствие: а) присоединения к активному центру фермента б)
- 52. Тест 7 Неконкурентные ингибиторы снижают скорость ферментативных реакций вследствие: а) изменения конформации фермента б) изменения химического
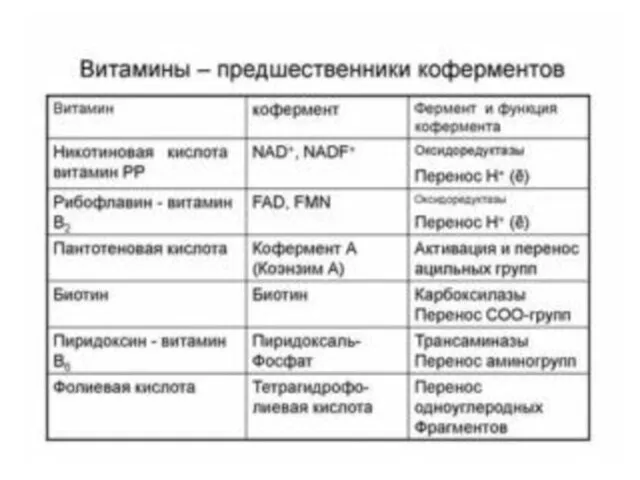
- 53. Тест 8 В состав коферментов входят: а) α-аминокислоты б) витамины в) гормоны г) жирные кислоты
- 54. Тест 9 Название класса ферментов указывает на: а) конформацию фермента б) молекулярную массу фермента в) тип
- 55. Тест 10 Ферменты, катализирующие реакции расщепления с участием воды, относятся к классу: а) гидролаз б) изомераз
- 56. Тест 11 Ферменты, катализирующие реакции внутримолекулярного переноса, относятся к классу: а) гидролаз б) изомераз в) оксидоредуктаз
- 57. Тест 12 Ферменты, катализирующие реакции межмолекулярного переноса, относятся к классу: а) гидролаз б) изомераз в) оксидоредуктаз
- 58. Тест 13 Ферменты, катализирующие окислительно-восстановительные реакции, относятся к классу: а) гидролаз б) изомераз в) оксидоредуктаз г)
- 59. Тест 14 Каждый фермент имеет индекс: а) двухзначный б) трехзначный в) четырехзначный г) пятизначный
- 60. Тест 15 Фермент с индексом 1.1.1.27 относится к классу: а) гидролаз б) изомераз в) оксидоредуктаз г)
- 61. Тест 16 Фермент с индексом 3.1.1.7 относится к классу: а) гидролаз б) изомераз в) оксидоредуктаз г)
- 62. Тест 17 Фермент лактатдегидрогеназа имеет индекс: а) 1.1.1.1 б) 2.1.1.10 в) 3.1.1.3 г) 5.4.1.1
- 64. Скачать презентацию










































 Генетические основы селекции. Лекция 13
Генетические основы селекции. Лекция 13 Вирусы
Вирусы Строение слухового анализатора
Строение слухового анализатора Рыба и рыбные товары
Рыба и рыбные товары Fotosintez
Fotosintez Изучение и изготовление муравейника
Изучение и изготовление муравейника Презентация на тему Эритроциты
Презентация на тему Эритроциты  Презентация на тему МНОГООБРАЗИЕ КЛЕТОК
Презентация на тему МНОГООБРАЗИЕ КЛЕТОК  Презентация на тему Готовимся к ЕГЭ по биологии. – практикум по подготовке к успешному выполнению задания С
Презентация на тему Готовимся к ЕГЭ по биологии. – практикум по подготовке к успешному выполнению задания С  Процессы жизнедеятельности одноклеточных животных
Процессы жизнедеятельности одноклеточных животных Ткани, органы, аппараты и системы органов. Периоды онтогенеза у животных и растений
Ткани, органы, аппараты и системы органов. Периоды онтогенеза у животных и растений Презентация на тему Отряд Богомолы
Презентация на тему Отряд Богомолы  Средства, влияющие на систему крови
Средства, влияющие на систему крови Взаимодействие генов
Взаимодействие генов Водоросли
Водоросли Презентация на тему История собаки динго
Презентация на тему История собаки динго  Физиология питания
Физиология питания Тип стрекающие
Тип стрекающие Презентация на тему Биологические ритмы
Презентация на тему Биологические ритмы  Строение клетки
Строение клетки Органоиды цитоплазмы
Органоиды цитоплазмы Строение листа растения
Строение листа растения Полезные комнатные растения
Полезные комнатные растения Woda. Właściwości. Rola w przyrodzie
Woda. Właściwości. Rola w przyrodzie Физиология пищеварения
Физиология пищеварения Кровеносная система
Кровеносная система Утки
Утки Кембрийская фауна
Кембрийская фауна