Слайд 2ФЕРМЕНТЫ – БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ БЕЛКОВОЙ ПРИРОДЫ.
Термин «фермент» введен в начале 17

века Ван Гельмонтом. Синонимом слова фермент является энзим.
Слайд 3
Fermentum – закваска
En zyme – в дрожжах

Слайд 4Начало XVII века – Ван Гельмонт вводит название «фермент», как вещество влияющее

на спиртовое брожение
Конец XVIII – Реомюр и Спалланцани показали, что растворение мяса желудочным соком процесс химический
1814г. – К.С. Кирхгоф обнаружил способность вытяжки из солода превращать крахмал в более простые сахара
1836г. – Шванн обнаружил в желудочном соке фермент пепсин
1837г. – Берцелиус ввел термин «катализ» и сравнил ферменты с неорганическими катализаторами
Слайд 5конец XIX века – М.М. Манассеина и братья Бухнер доказали несостоятельность деления

ферментов на «организованные» и «неорганизованные»
1913г. – Михаэлис и Ментен создали учение о кинетике ферментативных реакций
1926г. – Самнер получает в кристаллическом виде фермент уреазу
1957г. - Виланд и Пфлейдерер открыли изоферменты
1960г. - Филлипс установил при помощи рентгеноструктурного анализа трехмерную структуру лизоцима
Слайд 61955г. – Мур и Стейн полностью расшифровали, а в 1969г. В лаборатории

Мерифилда искусственно синтезировали фермент рибонуклеаза, состоящая из 124 а/к остатков
1989г. – С.Альтману и Т. Цеху вручена Нобелевская премия за открытие ферментативных свойств РНК (первый и пока единственный случай, когда ферментативной активностью обладала небелковая система).
Слайд 7Основная биологическая роль ферментов – это обеспечение протекания химических реакций в живом

организме. Вместе с тем ферменты обладают рядом существенных отличий от небиологических катализаторов:
Слайд 8высокая скорость катализа
обладают высокой специфичностью
катализируют в мягких условиях (t=37о, рН-нейтральное, нормальное атмосферное

давление)
регулируемость
скорость ферментативной реакции прямо пропорциональна количеству фермента.
Слайд 9Тем не менее, ферменты подчиняются общим законам катализа: т.е.:
Катализируют только энергетически возможные

реакции.
Они никогда не изменяют направления реакции
Они не изменяют направления обратимой реакции, а лишь ускоряют его наступление
Не расходуются в процессе реакции
Слайд 10ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ И ИХ СТРОЕНИЕ
Все ферменты являются белками. Выделяют ферменты простые

и сложные. Простые ферменты представлены только полипептидной цепью (т.е. состоят только из аминокислотных остатков).
Сложные ферменты – кроме белковой части имеют в своем составе вещество небелковой природы, которое называется кофермент.
Слайд 11Сложный фермент = Белковая часть + Небелковая
(холофермент) (апофермент) часть
(кофермент)
Если кофермент очень

прочно связан с апоферментом, то он называется - простетическая группа.
В отсутствии кофермента белковая часть ферментативной активностью не обладает
Слайд 12До 1/3 всех ферментов нуждается в присутствии иона металла, который либо активирует

фермент, либо обеспечивает его четвертичную конформацию.
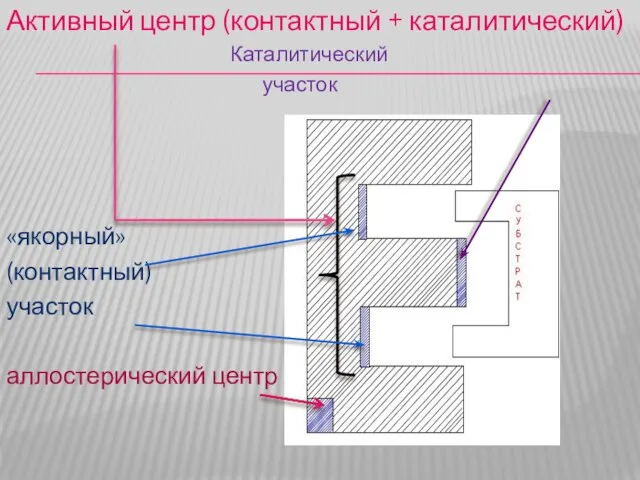
Слайд 13СТРОЕНИЕ МОЛЕКУЛЫ ФЕРМЕНТА
Любой фермент имеет в своем составе активный центр. В состав

активного центра входят контактный (якорный) участок и каталитический участок.
Якорный участок обеспечивает связывание субстрата, а каталитический обеспечивает его превращение.
Слайд 14Активный центр (контактный + каталитический)
Каталитический
участок
«якорный»
(контактный)
участок
аллостерический центр
Слайд 15В состав активного центра сложного фермента входит кофермент или простетическая группа, в

простом ферменте эту функцию выполняют радикалы аминокислот. Наиболее часто в состав активного центра входят радикалы гистидина, серина, аргинина, цистеина, лизина и дикарбоновых аминокислот.
Слайд 16Аминокислоты, образующие активный центр в простом ферменте при образовании первичной структуры полипептидной

цепи не обязательно находятся рядом (могут быть на противоположных концах полипептидной цепи), но при укладке полипептидной цепи в пространстве (третичная структура) сближаются и образуют единую функциональную группу.
Слайд 17Пример: активный центр пищеварительной гидролазы химотрипсина образуют серин - 195, гистидин –

57, аспарагиновая кислота – 102.
Структура активного центра комплиментарна субстрату.
Слайд 18АЛЛОСТЕРИЧЕСКИЙ ЦЕНТР
Выполняет регуляторную функцию, путем взаимодействия с аллостерическим эффектором, веществом комплиментарным по

строению с аллостерическим центром. Ничего общего по химическому строению аллостерический эффектор с субстратом не имеет и регулирует активность фермента путем изменения третичной структуры всей молекулы фермента.
Слайд 19Эффектор присоединяется в аллостерическом центре
Изменяется конформация аллостерического центра
Изменяется конформация фермента
Изменяется конформация активного

центра
Изменяется комплиментарность активного центра к субстрату
Изменяется скорость ферментативной реакции
Слайд 20ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Диффузия фермента и субстрата;
Образование фермент-субстратного комплекса за счет комплиментарности активного

центра фермента и субстрата;
Образование активированного фермент-субстратного комплекса за счет перераспределения электронной плотности в химических связях субстрата;
Слайд 214. Образование новых химических связей в молекулах, превращаемых под действием фермента и

появление комплекса фермент + продукт;
5. Выход продукта реакции в окружающую среду.
Слайд 23МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ
В основе действия любого фермента лежит снижение энергии активации. Данный

эффект может быть достигнут следующими путями:
1. Ориентация реагентов. Заключается в ориентации реакционных центров реагирующих молекул, что значительно снижает энергию активации.
Слайд 242. Деформация субстрата. Заключается в принудительном увеличении межатомных связей субстрата, что позволяет

легче их атаковать реагентом.
3. Кислотно-основной катализ. Заключается в перераспределении электронной плотности в молекуле субстрата, за счет функциональных групп входящих в состав активного центра фермента, что способствует образованию новых химических связей.
Слайд 254. Ковалентный катализ. Заключается в образовании с каталитическими группами фермента промежуточных веществ,

которые затем легко распадаются с освобождением продуктов реакции.
Слайд 26СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
В зависимости от степени сродства фермента к субстрату выделяют следующие виды

специфичности:
1. Стереохимическая специфичность – фермент может работать только с одним из стереоизомеров субстрата. Пример: фумаратгидратаза работает только с фумаровой кислотой, но не с малеиновой.
Слайд 272. Абсолютная субстратная специфичность. Фермент катализирует превращение только одного субстрата. Пример: уреаза

катализирует превращение только мочевины.
3. Абсолютная групповая специфичность – фермент катализирует превращение сходной группы субстратов. Пример: алкогольдегидрогеназа обеспечивает дегидрирование не только этанола, но и других алифатических спиртов.
Слайд 284. Относительная групповая специфичность. Для фермента первостепенное значение имеет характер химической связи

в субстрате. Пример: протеазы действуют на пептидную связь.
5. Относительная субстратная специфичность. Фермент работает с субстратами разных химических групп. Пример один – цитохром Р450. Единственное требование к субстрату, чтобы он был неполярный.
Слайд 29ТЕОРИИ ОБЪЯСНЯЮШИЕ СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Теория Фишера – «ключ-замок». Активный центр фермента жесткая структура.

Субстрат подходит к активному центру как ключ к замку. Имеет историческое значение.
Теория Кошленда – «перчатка-рука», «теория вынужденного соответствия». Активный центр фермента структура пластичная, при взаимодействии с субстратом принимает его форму, но в пределах определенных границ. Данная теория является общепринятой.
Слайд 30КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
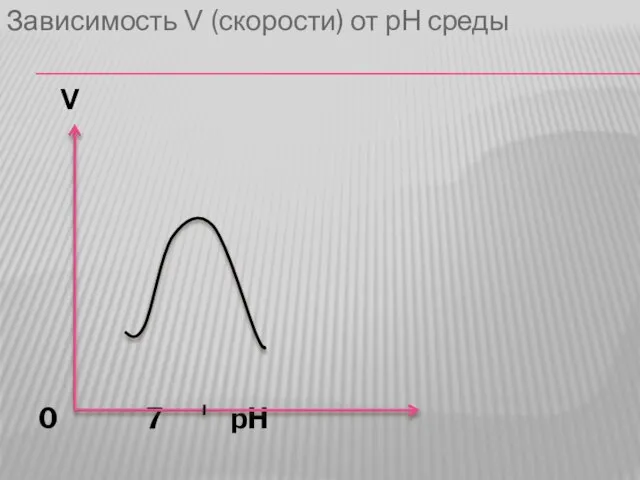
1. Зависимость скорости ферментативной реакции от pH. График имеет колоколообразный

характер, с оптимумом pH чаще всего равным 7. Однако не все ферменты имеют pH в нейтральной среде. Например пепсин,работающий в составе желудочного сока имеет оптимум pH 1,5.
Слайд 31Зависимость V (скорости) от рН среды
V
0 7 pH
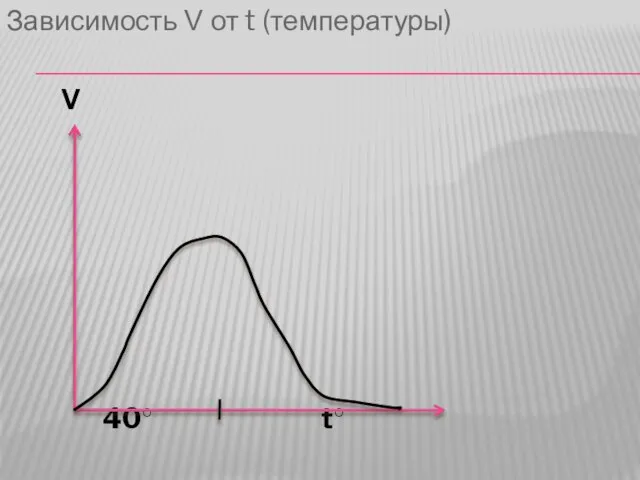
Слайд 322. Зависимость скорости ферментативной реакции от температуры. График имеет колоколообразный характер. При

увеличении t в соответствии с законами катализа скорость увеличивается (в 2 раза на каждые 10°С или 20% на 1°С), что имеет значение при метаболизме в лихорадочном состоянии (расценивается клиницистами как положительное явление).
Слайд 33Однако при дальнейшем увеличении температуры происходит денатурация ферментов и резкое падение скорости

реакции, поэтому температуру тела выше 40 °С следует сбивать.
Слайд 34Зависимость V от t (температуры)
V
40○ t○
Слайд 35Не все ферменты имеют оптимум при 40 °С. Например каталаза имеет оптимум

при 0°С.
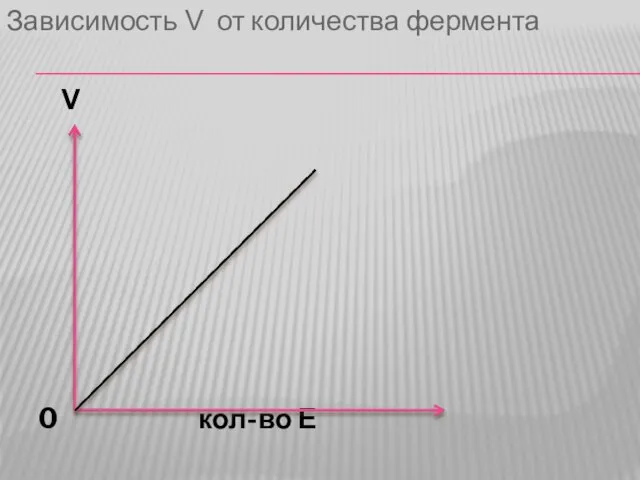
3. Зависимость скорости ферментативной реакции от количества фермента. Зависимость линейная, чем больше фермента, тем выше скорость.
Слайд 36Зависимость V от количества фермента
V
0 кол-во Е
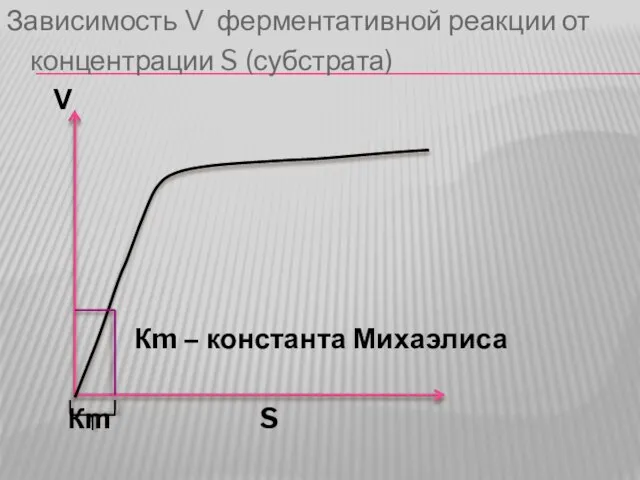
Слайд 374. Зависимость скорости ферментативной реакции от концентрации субстрата. Графическое изображение данной зависимости

носит название «кривой Михаэлиса» - при увеличении количества субстрата скорость реакции увеличивается до определенных пределов. В дальнейшем увеличения скорости не происходит, график имеет платообразный характер.
Слайд 38Зависимость V ферментативной реакции от
концентрации S (субстрата)
V
Кm – константа Михаэлиса
Кm S
Слайд 39Достижение максимальной скорости реакции зависит от сродства фермента к субстрату. Для того,

чтобы численно отобразить степень сродства введено понятие константа Михаэлиса.
Слайд 40Константа Михаэлиса – это такое количество субстрата, при котором достигается половина максимальной

скорости реакции.
Т.о., чем больше сродство фермента к субстрату, тем быстрее достигается максимальная скорость реакции, тем меньше константа Михаэлиса и наоборот.
Слайд 41Классификация ферментов
Оксидоредуктазы – обеспечивают перенос электронов и протонов. Участие в окислительно –

восстановительных реакциях.
Трансферазы – участвуют в переносе функциональных групп.
Гидролазы – разрыв связи с присоединением воды.
Лиазы – разрыв связи без присоединения воды.
Изомеразы – внутримолекулярный перенос.
Лигазы – присоединение с затратой энергии.
Слайд 42ХАРАКТЕРИСТИКА КЛАССОВ ФЕРМЕНТОВ
I класс. Оксидоредуктазы катализируют окисление-дегидрирование в аэробных и анаэробных условиях.
Редуктазы

– анаэробные
Оксидазы – аэробные
Всего класс насчитывает 480 ферментов, которые подразделяются на 17 подклассов. Пример: лактатдегидрогеназа (ЛДГ)
Слайд 43Коферменты оксидоредуктаз (1)
Никотинамидные (НАД, НАДФ)
Флавиновые (ФМН, ФАД)
Металлопорфириновые (гемы a, b, c, d)
Хинонкоферменты

(убихинон)
Пептидные (глутатион)
Липоевая кислота
Слайд 44II класс. Трансферазы – перенос атомных групп и молекулярных остатков. Подразделяется на

8 подклассов.
Слайд 45Группы:
амино-, альдегидная,
сульфо–, кетонные остатки,
глюко–, фосфо–,
одноуглеродые фрагменты (CH3-, СН2-)
Пример: гексокиназа.
D – глю

+ АТФ D – глю – 6 – фосфат + АДФ
гексокиназа
Слайд 46Коферменты трансфераз (2)
Пиридоксиновые (ПАЛФ, ПАМФ)
Пантотеновые (КоА, дефосфо – КоА, 4 - фосфопантотенат)
Нуклеотидные

(УДФ – глюкоза, ЦДФ - холин)
Фолиевые (ТГФК)
Кобамидные (метилкобаламин)
Слайд 47III класс. Гидролазы – ферменты, которые осуществляют разрыв химической связи с присоединением

молекулы воды. В основном представлены ферментами ЖКТ и лизосом. Коферментов нет. Некоторые имеют ион металла в качестве активатора. В зависимости от характера гидролизуемой связи выделяют эстеразы, гликозидазы, пептидазы. Всего класс объединяет 460 ферментов, составляющих 11 подклассов.
Пример: амилаза, липаза, пепсин.
Слайд 48IV класс. Лиазы – осуществляют негидролитические и неокислительные реакции распада и обратные

им реакции синтеза (синтазы). Класс насчитывает 230 ферментов, разделенных на 7 подклассов. Примеры: альдолаза, цитратсинтаза.
Слайд 49Коферменты лиаз (4)
Пиридоксиновые (ПАЛФ)
Пантотеновые (КоА, дефосфо - КоА)
Тиаминовые (ТДФ)
Кобамидные (дезоксиаденозилкобаламин)

Слайд 50V класс. Изомеразы – осуществляют внутримолекулярные превращения, изменения пространственного положения, перенос Н,

перемещение двойных связей. Класс насчитывает 80 ферментов, которые подразделяются на 6 подклассов.
Слайд 51Коферменты изомераз (5)
Пиридоксиновые (ПАЛФ)
Кобамидные (дезоксиаденозилкобаламин)
Фосфаты моносахаридов (глюкозо – 1, 6 – дифосфат,

2, 3 - дифосфоглицерат)
Пептидные (глутатион)
Никотинамидные (НАД)
Слайд 52VI класс. Лигазы – ферменты наращивания (синтетазы) осуществляют реакции синтеза с затратой
энергии АТФ или других макроэргических источников (ГТФ, ЦТФ). Всего известно около 80 лигаз, подразделяются на 5 подклассов.
Слайд 53Коферменты лигаз (6)
Нуклеотидные (УДФ – глюкоза, ЦДФ – холин и др.)
Биотиновые (карбоксибиотин)
Фолиевые

(5, 10 – метенил ТГФК)
Слайд 54НОМЕНКЛАТУРА ФЕРМЕНТОВ
Для ряда давно известных ферментов оставлены тривиальные названия: пепсин, трипсин, амилаза.
Кроме

того все ферменты имеют рабочее и систематическое название.
Слайд 55Рабочее название:
Лактат + дегидрогенизация + аза
лактатдегидрогеназа
Систематическое название:
L – лактат: НАД+ - оксидоредуктаза
субстрат

I субстрат II тип химического
превращения
1. – номер класса
1. – номер подкласса
1.1.1.27 1. – номер под – подкласса
27 – порядковый номер в под - подклассе






















































 Мова тварин
Мова тварин Дыхательная система
Дыхательная система 5 класс увеличительные приборы
5 класс увеличительные приборы Наследование, сцепленное с полом
Наследование, сцепленное с полом Презентация на тему ЛОСИ
Презентация на тему ЛОСИ  Биосинтез белка
Биосинтез белка Для чего человеку нужны кости и мышцы?
Для чего человеку нужны кости и мышцы? Анатомо-физиологические особенности органов мочеобразования и мочевыделения. Выделительные структуры и органы человека
Анатомо-физиологические особенности органов мочеобразования и мочевыделения. Выделительные структуры и органы человека Занимательный час Эти необычные домашние животные
Занимательный час Эти необычные домашние животные Цветы
Цветы Познавательные (когнитивные) процессы
Познавательные (когнитивные) процессы Тип Кольчатые черви
Тип Кольчатые черви Способы размножения комнатных растений. Способы размножения растений оранжереи
Способы размножения комнатных растений. Способы размножения растений оранжереи Альбом 1 семестр
Альбом 1 семестр Опорно-двигательный аппарат
Опорно-двигательный аппарат Лекция Тип Членистоногие. Подтипы Жабродышащие и Хелицеровые
Лекция Тип Членистоногие. Подтипы Жабродышащие и Хелицеровые Гимнастика Цигун. Кроссворд Анализатор слуха и равновесия
Гимнастика Цигун. Кроссворд Анализатор слуха и равновесия Морфология вегетативных органов. Лекция 2
Морфология вегетативных органов. Лекция 2 Презентация на тему ПИТАНИЕ РАСТЕНИЙ
Презентация на тему ПИТАНИЕ РАСТЕНИЙ  Предмет радиобиологии. История развития радиобиологии
Предмет радиобиологии. История развития радиобиологии Биохимия клетки
Биохимия клетки Основные понятия и положения классической и современной генетики
Основные понятия и положения классической и современной генетики Род пихта (abies)
Род пихта (abies) Закономерности наследования признаков. Моногибридное скрещивание
Закономерности наследования признаков. Моногибридное скрещивание Презентация на тему Лекарственные растения Викторина
Презентация на тему Лекарственные растения Викторина  Птичья кладовая
Птичья кладовая Различие в содержании вдыхаемого и выдыхаемого воздуха. Кислород. Окисление сложных органических веществ
Различие в содержании вдыхаемого и выдыхаемого воздуха. Кислород. Окисление сложных органических веществ Что такое хвоинки
Что такое хвоинки