химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
3: Гидролазы3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразыэстеразы, пепсинэстеразы, пепсин, трипсинэстеразы, пепсин, трипсин, амилаза,
4: Лиазы4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
6: Лигазы6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Классификация ферментов







 Пауки и другие паукообразные
Пауки и другие паукообразные Анатомия и физиология глаза человека
Анатомия и физиология глаза человека Размножение споровых растений
Размножение споровых растений Химическая организация клетки
Химическая организация клетки Екологічні групи і життєві форми рослин
Екологічні групи і життєві форми рослин Сравнение процессов питания и дыхания у растений (5 класс)
Сравнение процессов питания и дыхания у растений (5 класс) Отряд Парнокопытные
Отряд Парнокопытные Род хариусы
Род хариусы Лекция. Печень, поджелудочная железа (2)
Лекция. Печень, поджелудочная железа (2) Мир крымских насекомых
Мир крымских насекомых Сцепленное наследование генов. ЕГЭ по биологии, 28 задача
Сцепленное наследование генов. ЕГЭ по биологии, 28 задача Экология простейших
Экология простейших Красный мухомор
Красный мухомор Ткани. Эпителиальные, соединительные, мышечные, нервная ткани. Строение и функция нейрона. Синапс. Образование тканей
Ткани. Эпителиальные, соединительные, мышечные, нервная ткани. Строение и функция нейрона. Синапс. Образование тканей Пластический обмен
Пластический обмен Семинар. Методические рекомендации учителям при подготовке учащихся к практическому туру
Семинар. Методические рекомендации учителям при подготовке учащихся к практическому туру Энто 9 Салтанат
Энто 9 Салтанат Презентация на тему Селекция коз
Презентация на тему Селекция коз  Penguins
Penguins Класс млекопитающие, или звери
Класс млекопитающие, или звери Викторина знакомство с деревьями
Викторина знакомство с деревьями Свет и зрение
Свет и зрение Фенологиялық бақылау тікенекті шырша
Фенологиялық бақылау тікенекті шырша _Почвенное питание растений_ (1) (2)
_Почвенное питание растений_ (1) (2) Витамин B12 (кобаламин)
Витамин B12 (кобаламин) Мир комнатных растений
Мир комнатных растений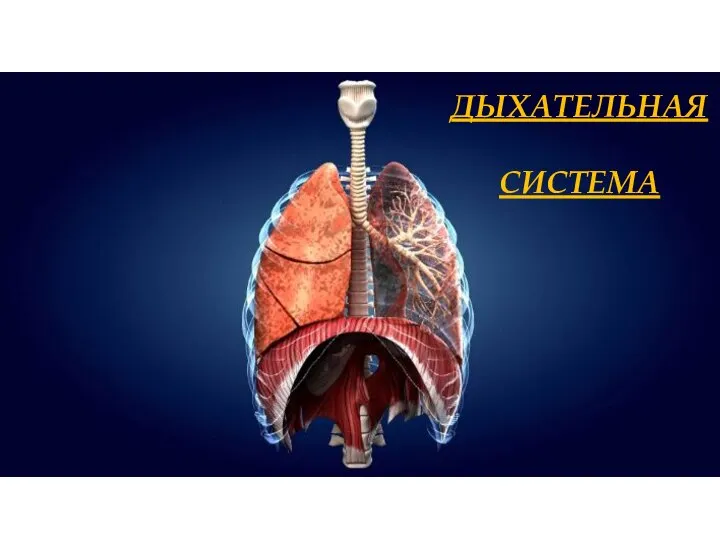 Дыхательная система человека
Дыхательная система человека Разновидности комнатных растений
Разновидности комнатных растений