Содержание
- 2. Гормоны – биологически активные вещества, которые синтезируются в эндокринных клетках, транспортируются кровью и действуют на ткани
- 3. Классификация и номенклатура гормонов Все гормоны классифицируют по химическому строению, биологическим функциям и механизму действия. 1.
- 5. Все гормоны действуют ограниченное время, которое зависит от скорости их распада. Самое короткое действие имеют пептиды
- 6. Механизм действия гормонов на клетку. Биологическое действие гормонов проявляется через их взаимодействие с рецепторами клеток-мишеней. Для
- 7. Активация аденилатциклазы приводит в свою очередь к увеличению образования циклической АМФ, которая служит как бы посредником
- 9. Гормоны поджелудочной железы Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция
- 10. Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются
- 11. проинсулин Т1/2 инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин. Схема биосинтеза
- 12. Регуляция синтеза и секреции инсулина. Глюкоза - главный регулятор секреции инсулина, а β-клетки - наиболее важные
- 13. На секрецию инсулина влияют другие гормоны. Адреналин через α2-рецепторы тормозит секрецию инсулина даже на фоне стимуляции
- 14. Биологические функции инсулина Инсулин - главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот,
- 15. - заболевание, обусловленное абсолютной или относительной недостаточностью инсулина и нарушением всех видов обмена веществ сахарный диабет
- 16. БИОХИМИЧЕСКИЕ НАРУШЕНИЯ ПРИ САХАРНОМ ДИАБЕТЕ: ГИПЕРГЛЮКОЗЕМИЯ, ГЛЮКОЗУРИЯ; ПОЛИДЕПСИЯ, ПОЛИУРИЯ; КЕТОНЕМИЯ, КЕТОНУРИЯ; ГИПЕРАЗОТЕМИЯ, ГИПЕРАЗОТУРИЯ; МЕТАБОЛИЧЕСКИЙ АЦИДОЗ.
- 17. Глюкагон Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков
- 18. Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь
- 20. Синтез и секреция катехоламинов Синтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников. В
- 21. Механизм действия и биологические функции катехоламинов Катехоламины действуют на клетки-мишени через рецепторы, локализованные в плазматической мембране.
- 22. Патология мозгового вещества надпочечников Основная патология мозгового вещества надпочечников - феохромоцитома, опухоль, образованная хромаффинными клетками и
- 23. Биосинтез йодтиронинов Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют собой морфологическую и
- 24. БИОСИНТЕЗ ТИРЕОИДНЫХ ГОРМОНОВ Биологическая активность йодтиронинов обусловлена свободной фракцией. Основная биологически активная форма йодтиронинов - Т3;
- 25. Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов. Транспорт йода в клетки щитовидной железы. Йод
- 26. Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойодтирозинов (МИТ) и
- 27. йодтиронины УВЕЛИЧИВАЮТ белковый синтез, стимулируют процессы роста и клеточной дифференцировки, ускоряют транскрипцию гена гормона роста. в
- 28. Гипотиреоз -при недостаточности функции щитовидной Гипотериоз приводит к снижению основного обмена, скорости гликолиза, мобилизации гликогена и
- 29. Гормоны гипоталамуса Гипоталамус занимает важнейшее место в иерархической системе, объединяя высшие отделы ЦНС и эндокринные железы.
- 30. 2. Кортиколиберин Кортиколиберин - полипептид, содержащий 41 аминокислотный остаток. Как и другие пептидные гормоны, Кортиколиберин синтезируется
- 31. 5.Соматостатин Соматостатин первично был выделен из гипоталамуса, но впоследствии оказалось, что он синтезируется во многих клетках,
- 32. Гормоны гипофиза Гипофиз секретирует большое количество гормонов, участвующих в регуляции различных биохимических процессов и физиологических функций.
- 33. Гормон роста, пролактин Гормон роста синтезируется в соматотропных клетках, наиболее многочисленных в передней доле гипофиза. Содержание
- 34. Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных с ростом и развитием
- 35. У мужчин Пролактин повышает чувствительность клеток Лейдига к лютеинизирующему гормону, поддерживая таким образом необходимый уровень синтеза
- 36. Тиреотропин, лютеинизирующий гормон фолликулостимулирующий гормон Тиреотропин, ЛГ и ФСГ - гликопротеины. Тиреотропин (TIT) синтезируется в тиреотрофных
- 37. В клетках коры надпочечников АКТГ стимулирует гидролиз эфиров холестерола, увеличивает поступление в клетки холестерола в составе
- 38. Оба гормона образуются в гипоталамусе в нейронах разных гипоталамических ядер в форме прогормонов, из которых в
- 39. Нарушения функций гипоталамо-гипофизарной системы Гипофункция может быта следствием уменьшения или полного подавления продукции тройных гормонов (пангипопитуитаризм)
- 41. Скачать презентацию
Слайд 2Гормоны – биологически активные вещества, которые синтезируются в эндокринных клетках, транспортируются кровью
Гормоны – биологически активные вещества, которые синтезируются в эндокринных клетках, транспортируются кровью

Особенности действия гормонов:
Действуют в малых количествах (10-6-10-12 ммоль/л);
Существует абсолютная или высокая специфичность в действии гормонов.
Переносят только информацию. Не используются в энергетических и строительных целях;
Действуют опосредованно через рецепторы и внутриклеточные посредники (Са2+, цАМФ, цГМФ, ДАГ, ИФ3 и т.д.). Например, через аденилатциклазную, инозитолтрифосфатную системы;
Регулируют активность или количество ферментов;
Зависят от ЦНС;
Беспороговый принцип. Даже 1 молекула гормона способна оказать эффект;
Пермессивность действия. Конечный эффект - результат действия множества гормонов.
Гормоны могут оказывать как системное, так и местное действие.
Слайд 3Классификация и номенклатура гормонов
Все гормоны классифицируют по химическому строению, биологическим функциям и
Классификация и номенклатура гормонов
Все гормоны классифицируют по химическому строению, биологическим функциям и

1. Классификация гормонов по химическому строению
По химическому строению гормоны делят на 4 группы: пептидные (или белковые) (гормоны гипоталамуса, гипофиза, поджелудочной железы), стероидные (половые, кортикоиды) и производные аминокислот (тиреоидные, катехоламины), эйкозаноиды - производные арахидоновой кислоты (гормоноподобные).
2. Классификация гормонов по месту синтеза
Гормоны гипофиза;
Гормоны гипоталамуса;
Гормоны поджелудочной железы;
Гормоны паращитовидной железы;
Гормоны щитовидной железы и т.д.
Слайд 5Все гормоны действуют ограниченное время, которое зависит от скорости их распада.
Самое короткое
Все гормоны действуют ограниченное время, которое зависит от скорости их распада.
Самое короткое

Гормоны синтезируются с разной скоростью, которая зависит от:
✔наличия субстрата;
✔действия нейромедиаторов;
✔других гормонов;
✔времени суток, года;
✔возраста;
✔у женщин от физиологического состояния.
Слайд 6Механизм действия гормонов на клетку.
Биологическое действие гормонов проявляется через их взаимодействие с
Механизм действия гормонов на клетку.
Биологическое действие гормонов проявляется через их взаимодействие с

Гормоны белковой природы (производные аминокислот, пептиды и белки)– действуют по мембанно-внутри-клеточному механизму.
Белковые и пептидные гормоны, а также катехоламины, связываясь с рецепторами на поверхности клеточной мембраны, образуют комплекс гормон-рецептор, который трансформирует сигнал первичного посредника в изменение концентрации особых молекул внутри клетки - вторичных посредников.
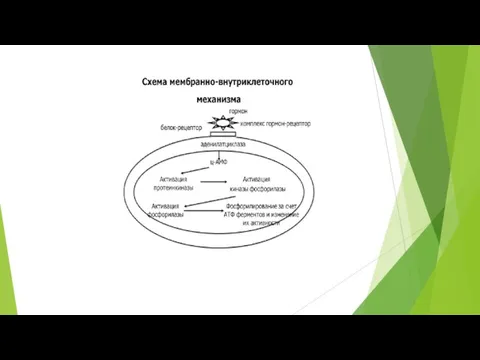
Основную часть рецептора составляют мембранные белки. Частью такого рецептора или тесно с ним связанным может быть фермент аденилатциклаза, встроенный в мембраны клеток многих тканей. Принята трехкомпонентная структура фермента аденилатциклазы, включающая регуляторную и каталитическую часть и сопрягающую часть (сцепщик или трансдуктор).
Регуляторная часть находится на наружной стороне цитоплазматической мембраны и является составной частью мембранного гормонального рецептора. На внутренней стороне мембраны расположена каталитическая часть аденилатциклазы, являющаяся собственно-ферментативным белком, превращающим АТФ ц-АМФ.
Слайд 7Активация аденилатциклазы приводит в свою очередь к увеличению образования циклической АМФ, которая
Активация аденилатциклазы приводит в свою очередь к увеличению образования циклической АМФ, которая

Сопрягающая часть аденилатциклазы, занимает промежуточное положение в липидном слое мембраны и представлена особым белком – G-белком (Г-белок) поскольку он связан в неактивной форме с ГДФ, а как только образовавшийся комплекс гормон-рецептор взаимодействуют с этим беком ГДФ замещается на ГТФ и комплекс G-белок – ГТФ выступает в качестве аллостерического активатора каталитической части аденилатциклазы. При диссоциации комплекса гормон-рецептор прекращается его действие на G-белок, ГТФ превращается в ГДФ и комплекс G-белок – ГДФ становится не активен.
Активация аденилатциклазы приводит в свою очередь к увеличению образования циклической АМФ, которая служит как бы посредником (мессенджер) действия гормонов, являясь внутриклеточным эффектором ряда внутриклеточных ферментных систем. Циклический 3,5 - АМФ образуется из АТФ под влиянием аденилатциклазы, а инактивируется фосфодиэстеразой путем гидролиза с образованием 5 - АМФ. Гормоны, влияя на активность аденилатциклазы и фосфодиэстеразы, тем самым способны увеличивать или уменьшать образование в клетках ц-АМФ.
Слайд 9Гормоны поджелудочной железы
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную
Гормоны поджелудочной железы
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную

В островковой части поджелудочной железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) - инсулин, D- (или δ-) - соматостатин, F-клетки секретируют панкреатический полипептид.
Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками .
ИНСУЛИН
Слайд 10Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате
Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате

Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Т1/2 инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин.
Слайд 11проинсулин
Т1/2 инсулина в плазме крови составляет 3-10 мин,
С-пептида - около 30
проинсулин
Т1/2 инсулина в плазме крови составляет 3-10 мин,
С-пептида - около 30
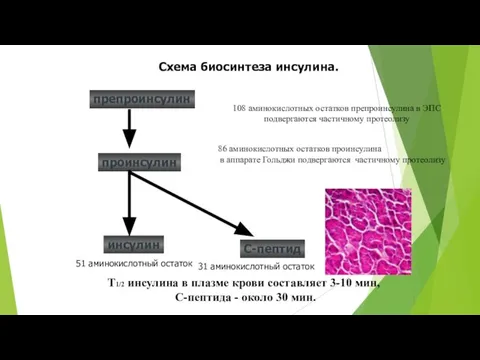
Схема биосинтеза инсулина.
препроинсулин
инсулин
86 аминокислотных остатков проинсулина
в аппарате Гольджи подвергаются частичному протеолизу
51 аминокислотный остаток
С-пептид
31 аминокислотный остаток
108 аминокислотных остатков препроинсулина в ЭПС подвергаются частичному протеолизу
Слайд 12Регуляция синтеза и секреции инсулина. Глюкоза - главный регулятор секреции инсулина, а β-клетки
Регуляция синтеза и секреции инсулина. Глюкоза - главный регулятор секреции инсулина, а β-клетки

Синтез и секреция инсулина не являются строго сопряжёнными процессами. Синтез гормона стимулируется глюкозой, а секреция его является Са2+-зависимым процессом и при дефиците Са2+снижается даже в условиях высокой концентрации глюкозы, которая стимулирует синтез инсулина.
Потребление глюкозы β-клетками происходит в основном при участии ГЛЮТ-1 и ГЛЮТ-2, и концентрация глюкозы в клетках быстро уравнивается с концентрацией глюкозы в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой, имеющей высокую Кm, вследствие чего скорость её фосфорилирования почти линейно зависит от концентрации глюкозы в крови. Фермент глюкокиназа - один из важнейших компонентов глюкозочувствительного аппарата β-клеток, в который, помимо глюкозы, вероятно, входят промежуточные продукты метаболизма глюкозы, цитратного цикла и, возможно, АТФ. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета.
Слайд 13На секрецию инсулина влияют другие гормоны. Адреналин через α2-рецепторы тормозит секрецию инсулина
На секрецию инсулина влияют другие гормоны. Адреналин через α2-рецепторы тормозит секрецию инсулина

Слайд 14Биологические функции инсулина
Инсулин - главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта
Биологические функции инсулина
Инсулин - главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта

Влияние инсулина на метаболизм глюкозы. Инсулин стимулирует утилизацию глюкозы в клетках разными путями. Около 50% глюкозы используется в процессе Гликолиза, 30-40% превращается в жиры и около 10% накапливается в форме гликогена. Общий результат стимуляции этих процессов - снижение концентрации глюкозы в крови.
Влияние инсулина на метаболизм глюкозы осуществляется путём повышения активности и количества ключевых ферментов гликолиза: глюкокиназы, фосфофруктокиназы, пируват-киназы
Влияние инсулина на метаболизм жиров. В печени и жировой ткани инсулин стимулирует синтез жиров, обеспечивая получение для этого процесса необходимых субстратов (ацетил-КоА, α-глицерофосфат и NADPH) из глюкозы. В адипоцитах инсулин активирует ацетил КоА-карбок-силазу и ЛП-липазу и индуцирует синтез синта-зы жирных кислот, ацетил-КоА-карбоксилазы и ЛП-липазы. Инсулин в жировой ткани тормозит мобилизацию жиров. Он активирует фосфатазу, которая дефосфорилирует и тем самым инактивирует гормончувствительную ТАГ-липазу. Таким образом, под влиянием инсулина снижается концентрация жирных кислот, циркулирующих в крови. Инсулин стимулирует потребление нейтральных аминокислот в мышцах и синтез белков в печени, мышцах и сердце.
Слайд 15- заболевание, обусловленное абсолютной или относительной недостаточностью инсулина и нарушением всех видов
- заболевание, обусловленное абсолютной или относительной недостаточностью инсулина и нарушением всех видов

сахарный диабет 1 типа
(25%)
Сахарный диабет
сахарный диабет 2 типа
(75%).
Абсолютная или относительная недостаточность выделения инсулина.
Нормальное содержание инсулина. Толерантность рецептора инсулина к гормону.
Слайд 16БИОХИМИЧЕСКИЕ НАРУШЕНИЯ ПРИ САХАРНОМ ДИАБЕТЕ:
ГИПЕРГЛЮКОЗЕМИЯ, ГЛЮКОЗУРИЯ;
ПОЛИДЕПСИЯ, ПОЛИУРИЯ;
КЕТОНЕМИЯ, КЕТОНУРИЯ;
ГИПЕРАЗОТЕМИЯ, ГИПЕРАЗОТУРИЯ;
МЕТАБОЛИЧЕСКИЙ АЦИДОЗ.
БИОХИМИЧЕСКИЕ НАРУШЕНИЯ ПРИ САХАРНОМ ДИАБЕТЕ:
ГИПЕРГЛЮКОЗЕМИЯ, ГЛЮКОЗУРИЯ;
ПОЛИДЕПСИЯ, ПОЛИУРИЯ;
КЕТОНЕМИЯ, КЕТОНУРИЯ;
ГИПЕРАЗОТЕМИЯ, ГИПЕРАЗОТУРИЯ;
МЕТАБОЛИЧЕСКИЙ АЦИДОЗ.

Слайд 17Глюкагон
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит
Глюкагон
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит

Слайд 18Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и
Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и

Слайд 20 Синтез и секреция катехоламинов
Синтез катехоламинов происходит в цитоплазме и гранулах клеток
Синтез и секреция катехоламинов
Синтез катехоламинов происходит в цитоплазме и гранулах клеток

Катехоламины поступают в гранулы путём АТФ-зависимого транспорта и хранятся в них в комплексе с АТФ в соотношении 4:1 (гормон-АТФ). Разные гранулы содержат разные катехоламины: некоторые только адреналин, другие - норадреналин, третьи - оба гормона.
Секреция гормонов из гранул происходит путём экзоцитоза. Катехоламины и АТФ освобождаются из гранул в том же соотношении, в каком они сохраняются в гранулах. В отличие от симпатических нервов, клетки мозгового слоя надпочечников лишены механизма обратного захвата выделившихся катехоламинов.
В плазме крови катехоламины образуют непрочный комплекс с альбумином. Адреналин транспортируется в основном к печени и скелетным мышцам. Норадреналин образуется в основном в органах, иннервируемых симпатическими нервами (80% от общего количества). Норадреналин лишь в незначительных количествах достигает периферических тканей. Т1/2 катехоламинов - 10-30 с. Основная часть катехоламинов быстро метаболизируется в различных тканях при участии специфических ферментов. Лишь небольшая часть адреналина (~ 5%) выделяется с мочой.
Слайд 21Механизм действия и биологические функции катехоламинов
Катехоламины действуют на клетки-мишени через рецепторы, локализованные
Механизм действия и биологические функции катехоламинов
Катехоламины действуют на клетки-мишени через рецепторы, локализованные

Биосинтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников. В одних гранулах содержится адреналин, в других норадреналин, а в некоторых - оба гормона. При стимуляции содержимое гранул высвобождается во внеклеточную жидкость. А - адреналин; НА - норадреналин.
Адреналин взаимодействует как с α-, так и с β-рецепторами; норадреналин в физиологических концентрациях главным образом взаимодействует с α-рецепторами.
Биологические эффекты адреналина и норадреналина затрагивают практически все функции организма. Общее во всех этих эффектах заключается в стимуляции процессов, необходимых для противостояния организма чрезвычайным ситуациям.
Слайд 22Патология мозгового вещества надпочечников
Основная патология мозгового вещества надпочечников - феохромоцитома, опухоль, образованная
Патология мозгового вещества надпочечников
Основная патология мозгового вещества надпочечников - феохромоцитома, опухоль, образованная

Гормоны щитовидной железы
В щитовидной железе синтезируются гормоны - йодированные производные тирозина. Они объединены общим названием йодтиронины. К ним относят 3,5,3'-трийодтиронин (трийодтиронин, Т3) и 3,5,3',5'-тетрайодтиронин (Т4), или тироксин.
Йодтиронины участвуют в регуляции многих процессов метаболизма, развития, клеточной дифференцировки, в регуляции экспрессии генов.
Заболевания, возникающие в результате нарушений синтеза, секреции и функций йодтиронинов, - наиболее распространённые заболевания эндокринной системы.
Слайд 23Биосинтез йодтиронинов
Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют
Биосинтез йодтиронинов
Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют

Тиреоглобулин - гликопротеин с молекулярной массой 660 кД, содержащий 115 остатков тирозина. 8-10% массы тиреоглобулина представлено углеводами. Содержание йодида в организме составляет 0,2-1%.
Тиреоглобулин синтезируется на рибосомах шероховатого ЭР в виде претиреоглобулина, затем переносится в цистерны ЭР, где происходит формирование вторичной и третичной структуры, включая процессы гликозилирования. Из цистерн ЭР Тиреоглобулин поступает в аппарат Гольджи, включается в состав секреторных гранул и секретируется во внеклеточный коллоид, где происходит йодирование остатков тирозина и образование йодтиронинов.
Слайд 24БИОСИНТЕЗ ТИРЕОИДНЫХ ГОРМОНОВ
Биологическая активность йодтиронинов обусловлена свободной фракцией.
Основная биологически активная форма
БИОСИНТЕЗ ТИРЕОИДНЫХ ГОРМОНОВ
Биологическая активность йодтиронинов обусловлена свободной фракцией.
Основная биологически активная форма

Слайд 25Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов.
Транспорт йода в клетки
Йодирование тиреоглобулина и образование йодтиронинов осуществляется в несколько этапов.
Транспорт йода в клетки

Окисление йода. Окисление I- в I+ происходит при участии гемсодержащей тиреопероксидазы и Н2О2 в качестве окислителя.
Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3 - трийодтиронин, Т4 - тироксин.
Йодирование тирозина. Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой.
Слайд 26Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием
Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием

Транспорт и метаболизм йодтиронинов. От половины до двух третей Т3 и Т4 находятся в организме вне щитовидной железы. Большая часть их циркулирует в крови в связанной форме в комплексе с белками: тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). ТСГ служит основным транспортным белком йодтиронинов, а также формой их депонирования. Он обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме.
Т1/2 Т4 в плазме в 4-5 раз больше, чем Т3. Для Т4 этот период составляет около 7 дней, а для Т3 - 1-1,5 дня. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Т3 - основная биологически активная форма йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т4. В периферических тканях в результате дейодирования части Т4 по пятому углеродному атому образуется так называемая "реверсивная" форма Т3, которая почти полностью лишена биологической активности.
Регуляция синтеза и секреции йодтиронинов .
Скорость синтеза и секреции йодтиронинов регулируются гипоталамо-гипофизарной системой по механизму обратной связи. Стимулом для повышения секреции тиреолиберина и тиреотропина служит снижение концентрации йодтиронинов в крови.
Слайд 27йодтиронины УВЕЛИЧИВАЮТ
белковый синтез,
стимулируют процессы роста и клеточной дифференцировки,
ускоряют транскрипцию
йодтиронины УВЕЛИЧИВАЮТ
белковый синтез,
стимулируют процессы роста и клеточной дифференцировки,
ускоряют транскрипцию

в печени йодтиронины ускоряют гликолиз, синтез холестерола и синтез жёлчных кислот,
повышает чувствительность клеток к действию адреналина и косвенно стимулирует липолиз в жировой ткани и мобилизацию гликогена в печени.
увеличивает в мышцах потребление глюкозы,
стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность мышечных клеток к действию адреналина.
Йодтиронины стимулируют работу Na+,K+-ATФазы, повышают поглощение клетками кислорода (кроме мозга, РЭС и гонад).
Йодтиронины участвуют в формировании ответной реакции на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина.
Слайд 28Гипотиреоз -при недостаточности функции щитовидной
Гипотериоз приводит к снижению основного обмена, скорости
Гипотиреоз -при недостаточности функции щитовидной
Гипотериоз приводит к снижению основного обмена, скорости

Проявления гипотериоза: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи.
Гипотиреоз новорождённых приводит к развитию кретинизма (тяжёлой необратимой задержкой умственного развития). У детей старшего возраста наблюдают отставание в росте без задержки умственного развития.
Тяжёлой формой гипотиреоза является «микседема».
Эндемический зоб (нетоксический зоб)
Если поступление йода в организм снижается (ниже 100 мкг/сут), то уменьшается продукция йодтиронинов, что приводит к усилению секреции ТТГ (из-за ослабления действия йодтиронинов на гипофиз по механизму отрицательной обратной связи), под влиянием которого происходит компенсаторное увеличение размеров щитовидной железы (гиперплазия), но продукция йодтиронинов при этом не увеличивается.
Гипертиреоз -повышенная продукция йодтиронинов вследствие развития опухоли, тиреоидите, аутоиммунных реакций.
Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2—5 раз и развитие тиреотоксикоза.
Слайд 29Гормоны гипоталамуса
Гипоталамус занимает важнейшее место в иерархической системе, объединяя высшие отделы ЦНС
Гормоны гипоталамуса
Гипоталамус занимает важнейшее место в иерархической системе, объединяя высшие отделы ЦНС

1. Тиреолиберин - трипептид, состоящий из пироглутаминовой кислоты, гистидина и пролинамида.
Синтез тиреолиберина происходит в различных участках гипоталамуса, но в большей степени в паравентрикулярном ядре, а также в других областях ЦНС, где он выполняет функцию нейромедиатора, повышающего двигательную активность и АД. Предшественник тиреолиберина препротиреолиберин человека включает 242 аминокислотных остатка. Образование активного гормона происходит по механизму частичного протеолиза. В передней доле гипофиза тиреолиберин стимулирует синтез и секрецию тиреотропина, а также оказывает стимулирующее влияние на синтез многих других гормонов. В результате взаимодействия тиреолиберина с рецепторами плазматической мембраны клеток гипофиза происходит повышение концентрации внутриклеточного цАМФ и Са2+. Трансдукция сигнала происходит как через аденилатциклазную, так и через инозитолфосфатную системы.
Тиреолиберин разрушается в клетках-мишенях и в крови под действием специфических протеаз. Т1/2 в крови составляет 3-4 мин.
Слайд 302. Кортиколиберин
Кортиколиберин - полипептид, содержащий 41 аминокислотный остаток. Как и другие пептидные
2. Кортиколиберин
Кортиколиберин - полипептид, содержащий 41 аминокислотный остаток. Как и другие пептидные

В передней доле гипофиза кортиколиберин увеличивает синтез и секрецию проопиомеланокортина и образование кортикотропина. Рецепторы кортиколиберина находятся в плазматической мембране клеток в составе аденилатциклазного комплекса. Стимуляция секреции АКТГ требует присутствия ионов Са2+. Увеличение уровня внутриклеточного кальция, вероятно, является результатом фосфорилирования белков кальциевых каналов.
3. Гонадолиберин
Гонадолиберин - декапептид. Предшественник гонадолиберина человека состоит из 92 аминокислотных остатков и имеет молекулярную массу около 10 кД. Гонадолиберин стимулирует синтез и секрецию 2 гормонов гипофиза - ЛГ и ФСГ. Помимо гипоталамуса, нейроны, содержащие Гонадолиберин, находятся и в других областях ЦНС, контролирующих эмоциональное и половое поведение. Рецептор гонадолиберина в плазматической мембране входит в состав инозитолфосфатного комплекса, активация которого стимулирует фосфорилирование белков и мобилизацию Са2+, что приводит к освобождению гормонов. Т1/2 гонадолиберина в плазме крови составляет 5-7 мин. Инактивация гонадолиберина происходит при участии специфических протеаз.
Соматолиберин
Соматолиберин - полипептид, состоящий из 44 аминокислотных остатков. В передней доле гипофиза Соматолиберин стимулирует синтез и секрецию соматотропина. Трансдукция сигнала сопровождается повышением концентрации как цАМФ, так и ионов кальция. Т1/2 соматолиберина в крови составляет около 7 мин. Соматолиберин применяют в клинической практике для диагностики нарушений функции гипофиза.
Слайд 315.Соматостатин
Соматостатин первично был выделен из гипоталамуса, но впоследствии оказалось, что он синтезируется
5.Соматостатин
Соматостатин первично был выделен из гипоталамуса, но впоследствии оказалось, что он синтезируется

Биологической активностью обладает и ациклическая восстановленная форма пептида. В тканях соматостатин присутствует в форме пептида, содержащего 28 аминокислотных остатков и может служить предшественником пептида, состоящего из 14 аминокислотных остатков. Обе формы проявляют биологическую активность, но в разной степени. Соматостатин-14 находится в основном в ЦНС, а соматостатин-28 преимущественно в кишечнике.
Результат трансдукции сигнала соматостатина - снижение уровня внутриклеточной концентрации цАМФ и Са2+ в цитозоле клеток. Соматостатин тормозит секрецию гормона роста, глюкагона, инсулина, гастрина, секретина, вазоактивного интестинального пептида (ВИП, VIP), холецистокинина, кальцитонина, паратгормона, иммуноглобулинов, ренина; он также ингибирует секрецию бикарбонатов и ферментов поджелудочной железы, уменьшает кровоток на всём протяжении ЖКТ, снижает секрецию жёлчи.
Слайд 32Гормоны гипофиза
Гипофиз секретирует большое количество гормонов, участвующих в регуляции различных биохимических процессов
Гормоны гипофиза
Гипофиз секретирует большое количество гормонов, участвующих в регуляции различных биохимических процессов

Задняя доля гипофиза, или нейрогипофиз, секретирует гормоны, регулирующие в основном водный баланс и лактацию.
Секреция гормонов гипофиза обусловлена сочетанием нервных и гуморальных сигналов. При этом один и тот же агонист (например, норадреналин) может вызывать противоположные изменения в секреции гипофизарных гормонов. С другой стороны, секреция каждого гормона может контролироваться многочисленными факторами.
Синтез и секреция гормонов передней доли гипофиза регулируются гормонами гипоталамуса, которые поступают в гипофиз через портальную систему кровеносных сосудов, связывающих гипоталамус и переднюю долю гипофиза. Кроме того, секреция гормонов гипоталамуса и гипофиза регулируется по механизму обратной связи гормонами, продукцию которых они стимулируют в органах-мишенях.
В передней доле гипофиза синтезируются гормоны, которые по химическому строению являются пептидами и гликопротеинами.
По механизму их синтеза и биологическим функциям эти гормоны объединяют в 3 группы.
Слайд 33 Гормон роста, пролактин
Гормон роста синтезируется в соматотропных клетках, наиболее многочисленных в
Гормон роста, пролактин
Гормон роста синтезируется в соматотропных клетках, наиболее многочисленных в

Гормон роста у всех видов млекопитающих представляет собой одноцепочечный пептид, состоящий из 191 аминокислотного остатка и имеющий 2 внутримолекулярные дисульфидные связи.
Гормон роста образуется из прогормона не обладающего гормональной активностью. Уровень гормона роста в плазме крови не превышает 3 нг/мл. Секреция гормона роста носит пульсирующий характер с интервалами в 20-30 мин. Один из самых больших пиков отмечается вскоре после засыпания.
Под влиянием различных стимулов (стресс, физические упражнения, гипогликемия, голодание, белковая пища, аминокислота аргинин) даже у не растущих взрослых людей уровень гормона роста в крови может возрастать до 30-100 нг/мл.
Регуляция синтеза и секреции гормона роста осуществляется множеством факторов. Основной стимулирующий эффект оказывает соматолиберин, основной тормозящий - гипоталамический соматостатин.
Первичные эффекты гормона роста кратковременны и инсулиноподобны. Они проявляются в основном в отношении обмена жиров и углеводов. В жировой ткани усиливается потребление глюкозы и липогенез, вследствие чего происходит снижение концентрации глюкозы в крови. Однако в дальнейшем проявляются более медленные (в основном, противоположные инсулину) эффекты: усиливается липолиз в жировой ткани, увеличивается концентрация жирных кислот в крови, а в случае недостаточности инсулина увеличивается содержание кетоновых тел в крови. Энергия, образующаяся при повышенном распаде жиров, используется на анаболические процессы. В то же время использование глюкозы жировыми и мышечными клетками снижается, а в печени ускоряется глюконеогенез, следствием чего может быть гипергликемия, особенно при недостатке инсулина.
Слайд 34Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных
Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных

Под влиянием гормона роста увеличивается ширина и толщина костей, и одновременно с этим ускоряется рост других тканей, включая соединительную ткань, мышцы и внутренние органы.
Пролактин синтезируется лактотрофными клетками передней доли гипофиза в виде прогормона. Число этих клеток резко возрастает при беременности под влиянием эстрогенов. Пролактин близок по химическому строению гормону роста. Он состоит из 199 аминокислотных остатков, образующих одну полипептидную цепь с тремя дисульфидными связями. 35% аминокислотной последовательности пролактина идентично последовательностям гормона роста. Оба гормона имеют общие антигенные детерминанты, сходное строение рецепторов и пути трансдукции сигналов в клетки.
Рецепторы пролактина присутствуют в клетках многих тканей: в печени, почках, надпочечниках, яичках, яичниках, матке и других тканях.
Основная физиологическая функция пролактина - стимуляция лактации. Пролактин индуцирует синтез α-лактальбумина и казеина, активирует синтез фосфолипидов и ТАГ.
На процессы роста Пролактин влияет в значительно меньшей степени, чем гормон роста.
Слайд 35У мужчин Пролактин повышает чувствительность клеток Лейдига к лютеинизирующему гормону, поддерживая таким
У мужчин Пролактин повышает чувствительность клеток Лейдига к лютеинизирующему гормону, поддерживая таким

Синтез и секрецию пролактина стимулируют тиреолиберин, серотонин, окситоцин, ацетил-холин, ингибирующий эффект оказывает дофамин.
Подобно большинству гормонов, Пролактин секретируется в кровь эпизодически с интервалами 30-90 мин. Максимум секреции отмечается через 6-8 ч после начала сна. Концентрация пролактина в плазме крови женщин составляет 8-10 нг/мл, а мужчин - 5-8 нг/мл. Т1/2 пролактина составляет 15-20 мин.
Плацента продуцирует гормон (плацентарный лактоген) , гомологичный по аминокислотному составу гормону роста и пролактину. Все 3 гормона имеют общие антигенные детерминанты и обладают рост-стимулирующей и лакто-генной активностью. Существует гипотеза, согласно которой гены этих гормонов возникли в результате дупликации одного гена-предшественника.
Слайд 36Тиреотропин, лютеинизирующий гормон фолликулостимулирующий гормон
Тиреотропин, ЛГ и ФСГ - гликопротеины. Тиреотропин (TIT)
Тиреотропин, лютеинизирующий гормон фолликулостимулирующий гормон
Тиреотропин, ЛГ и ФСГ - гликопротеины. Тиреотропин (TIT)

Стимуляция секреции тиреотропина происходит под влиянием тиреолиберина, а основное ингибирующее действие оказывает повышение уровня тиреоидных гормонов. Пик секреции ТТГ отмечается в часы, непосредственно предшествующие сну, с последующим снижением в течение ночи.
Основная биологическая функция тиреотропина - стимуляция синтеза и секреции йодтиронинов (Т3 и Т4) в щитовидной железе.
Группа гормонов, образующихся из проопиомеланокортина
Проопиомеланокортин (ПОМК) синтезируется в передней и промежуточной долях гипофиза и в некоторых других тканях (кишечнике, плаценте). Полипептидная цепь ПОМК состоит из 265 аминокислотных остатков.
После отщепления сигнального пептида происходит частичный протеолиз оставшейся полипептидной цепи с образованием АКТГ и β-липотропина (β-ЛП).
Кортикотропин (АКТГ) - пептидный гормон; состоит из 39 аминокислотных остатков; синтезируется в клетках передней доли гипофиза под влиянием кортиколиберина.
Кортикотропин секретируется в импульсивном режиме. Скорость секреции составляет 5-25 мкг/сут. При стрессе (травма, ожог, хирургическое вмешательство, интоксикация химическими веществами, кровотечение, боль, психическая травма) концентрация АКТГ в крови возрастает во много раз. У здоровых людей наименьший уровень АКТГ в крови отмечается в конце дня и непосредственно перед сном, наибольший.
Слайд 37В клетках коры надпочечников АКТГ стимулирует гидролиз эфиров холестерола, увеличивает поступление в
В клетках коры надпочечников АКТГ стимулирует гидролиз эфиров холестерола, увеличивает поступление в

Гормоны задней доли гипофиза
Задняя доля гипофиза, или нейрогипофиз, сек-ретирует 2 активных гормона - вазопрессин, или антидиуретический гормон (АДГ), и окситоцин.
Окситоцин и вазопрессин - нонапептиды со сходной первичной структурой.
Слайд 38Оба гормона образуются в гипоталамусе в нейронах разных гипоталамических ядер в форме
Оба гормона образуются в гипоталамусе в нейронах разных гипоталамических ядер в форме

Основные биологические эффекты вазопрессина проявляются через взаимодействие с 2 типами рецепторов. V1-рецепторы расположены в клетках гладкой мускулатуры сосудов в комплексе с фосфолипазой С. Результат трансдукции сигнала в эти клетки - сокращение сосудов. V2-рецепторы расположены в клетках почечных канальцев. Взаимодействие вазопрессина с V2-рецепторами активирует аденилатциклазную систему, увеличивая в клетках концентрацию
Окситоцин стимулирует сокращение гладкой мускулатуры матки, а также играет важную роль в стимуляции лактации. Он вызывает сокращение миоэпителиальных клеток молочных желёз, в результате чего происходит перераспределение молока из альвеолярных протоков в область соска.
Акт сосания материнской груди стимулирует секрецию пролактина, обеспечивая образование и секрецию молока.
Слайд 39Нарушения функций гипоталамо-гипофизарной системы
Гипофункция может быта следствием уменьшения или полного подавления продукции тройных
Нарушения функций гипоталамо-гипофизарной системы
Гипофункция может быта следствием уменьшения или полного подавления продукции тройных

Выпадение гонадотропной функции гипофиза приводит к недостаточности яичников, аменорее, атрофии матки, молочных желёз. Вследствие снижения продукции кортикотропина развивается хроническая недостаточность коры надпочечников.
Дефицит гормона роста особенно опасен у детей. Известно несколько типов нарушений способности к нормальному росту вследствие абсолютного или относительного дефицита СТГ.
Гипофизарный нанизм, или карликовость (от греч. nanos - карлик). Причина нарушения роста и физического развития - дефицит гормона роста. Большинство форм гипофизарного нанизма развивается вследствие мутаций гена гормона роста. У большинства больных гипофизарным нанизмом нарушение роста сочетается с другими эндокринными нарушениями. В некоторых случаях гипосекреция гормона роста может быть результатом аутоиммунного повреждения соматотрофных клеток гипофиза, черепно-мозговой травмы или радиации.
Нанизм Ларона возникает вследствие дефекта рецепторов гормона роста гепатоцитов и снижения синтеза ИФР-1 и ИФР-2. Концентрация СТГ в крови при этом повышена.
Карликовость африканских пигмеев - результат нарушения пострецепторной передачи гормонального сигнала СТГ. При этой форме карликовости концентрация гормона роста в плазме нормальная, а концентрация ИФР-1 значительно снижена.


 Синичкин день
Синичкин день Хвойный лес
Хвойный лес Хромосомы. Кариотип. Жизненный цикл клетки
Хромосомы. Кариотип. Жизненный цикл клетки Исследования реакций адаптаций организма к высоким температурам
Исследования реакций адаптаций организма к высоким температурам Презентация на тему Зима в лесу
Презентация на тему Зима в лесу  Артериолы, венулы и капилляры м. мозговой оболочки кошки
Артериолы, венулы и капилляры м. мозговой оболочки кошки Модификационная изменчивость
Модификационная изменчивость Птицы
Птицы Презентация на тему Царство растений
Презентация на тему Царство растений  Огород в городе
Огород в городе Обитатели Черного моря
Обитатели Черного моря Prezentatsia_Organicheskie_veschestva_Uglevody_Belki
Prezentatsia_Organicheskie_veschestva_Uglevody_Belki Микроскоп. Части микроскопа
Микроскоп. Части микроскопа Общие вопросы. Задания 27. Часть 2-3
Общие вопросы. Задания 27. Часть 2-3 Развитие эволюционного учения (9)
Развитие эволюционного учения (9) Хеморецепция. Органы вкуса
Хеморецепция. Органы вкуса Презентация на тему ИСТОРИЯ РАЗВИТИЯ ГЕНЕТИКИ
Презентация на тему ИСТОРИЯ РАЗВИТИЯ ГЕНЕТИКИ  Времена года
Времена года Симметрия в природе
Симметрия в природе Головной мозг человека
Головной мозг человека Виртуальное путешествие в микромир
Виртуальное путешествие в микромир Двоякодышащие рыбы
Двоякодышащие рыбы Историческое прошлое людей
Историческое прошлое людей Прощание с ботаникой
Прощание с ботаникой Дружная семейка. Виртуальная выставка ко Дню любителей зоопарков
Дружная семейка. Виртуальная выставка ко Дню любителей зоопарков Тип членистоногие, класс насекомые, отряд стрекозы
Тип членистоногие, класс насекомые, отряд стрекозы Генетика пола
Генетика пола Углеводы: моносахариды, олигосахариды и полисахариды
Углеводы: моносахариды, олигосахариды и полисахариды