Содержание
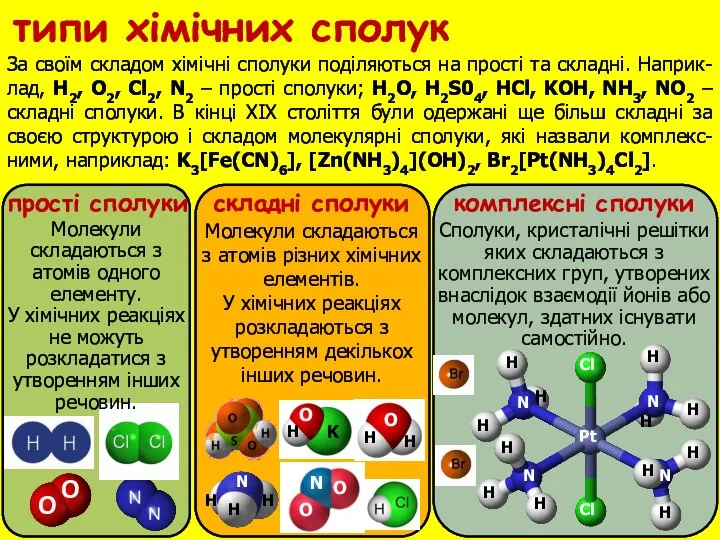
- 2. прості сполуки складні сполуки комплекснi сполуки типи хiмiчних сполук За своїм складом хімічні сполуки поділяються на
- 3. Альфред Вернер Головною ознакою комплексних сполук є координація, тому їх називають координаційними. У 1893 році швейцарський
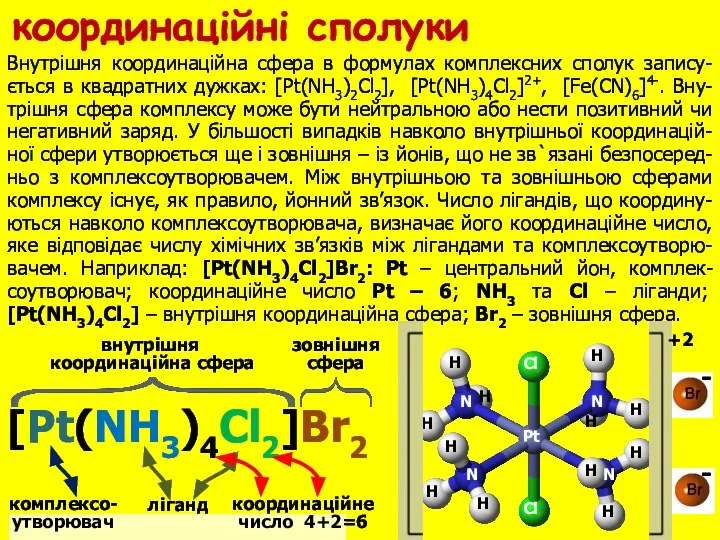
- 4. координаційне число 4+2=6 зовнішня сфера комплексо- утворювач ліганд Внутрішня координаційна сфера в формулах комплексних сполук запису-ється
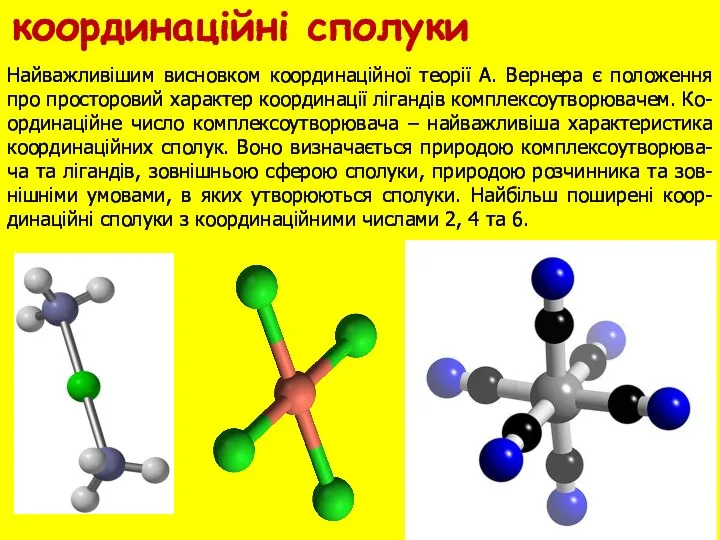
- 5. Найважливішим висновком координаційної теорії А. Вернера є положення про просторовий характер координації лігандів комплексоутворювачем. Ко-ординаційне число
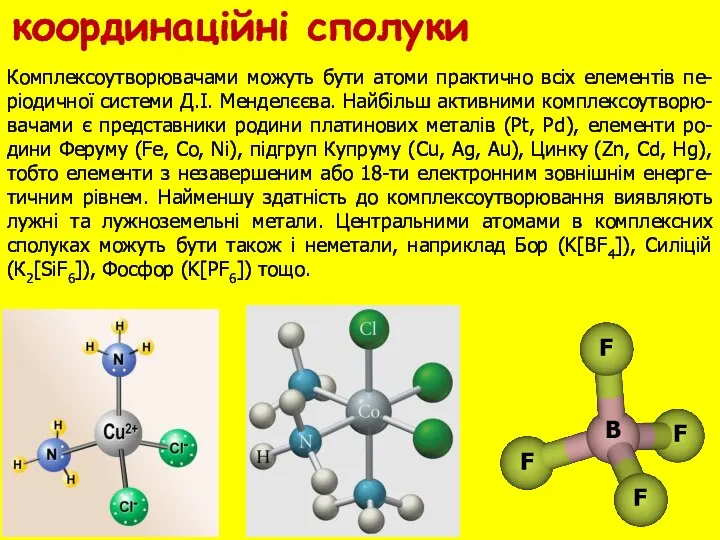
- 6. Комплексоутворювачами можуть бути атоми практично всіх елементів пе-ріодичної системи Д.І. Менделєєва. Найбільш активними комплексоутворю-вачами є представники
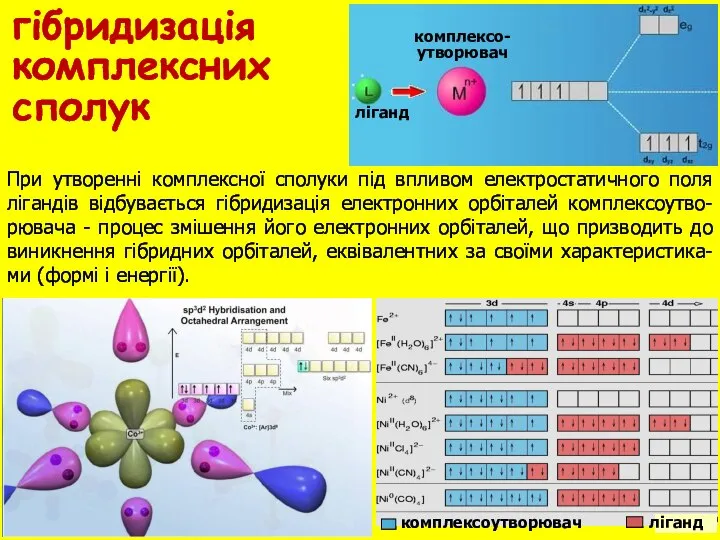
- 7. комплексоутворювач ліганд гібридизація комплексних сполук комплексо- утворювач ліганд При утворенні комплексної сполуки під впливом електростатичного поля
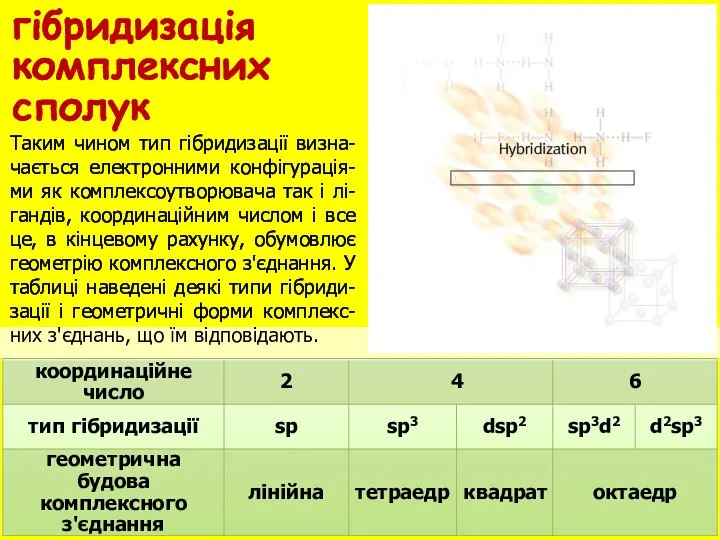
- 8. гібридизація комплексних сполук Таким чином тип гібридизації визна-чається електронними конфігурація-ми як комплексоутворювача так i лi-гандiв, координаційним
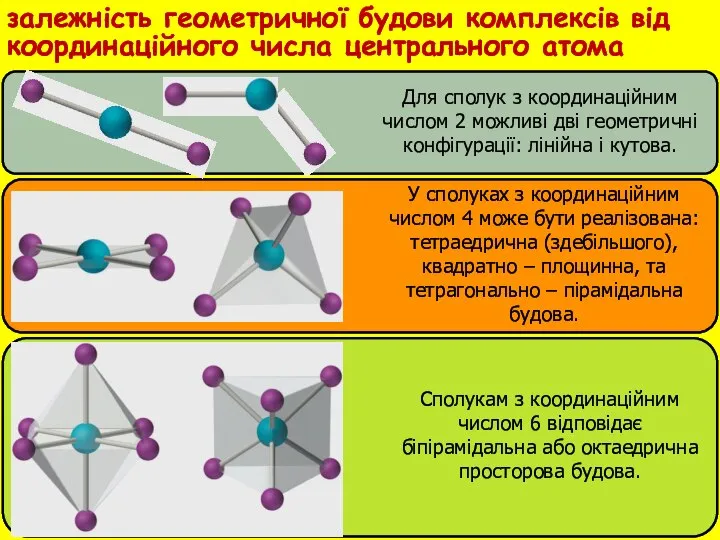
- 9. Для сполук з координаційним числом 2 можливі дві геометричні конфігурації: лінійна і кутова. У сполуках з
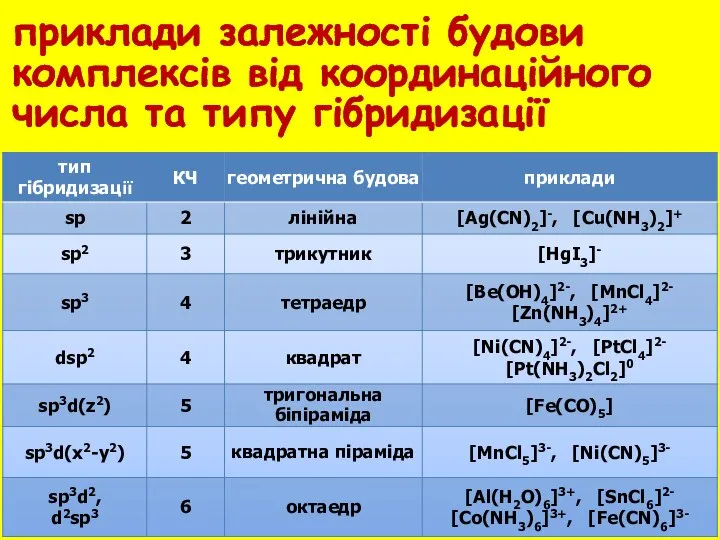
- 10. приклади залежності будови комплексів від координаційного числа та типу гібридизації
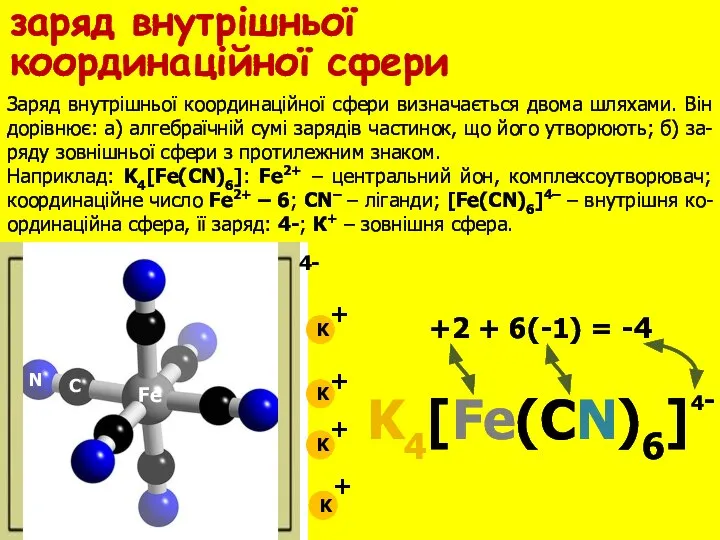
- 11. Заряд внутрішньої координаційної сфери визначається двома шляхами. Він дорівнює: а) алгебраїчній сумі зарядів частинок, що його
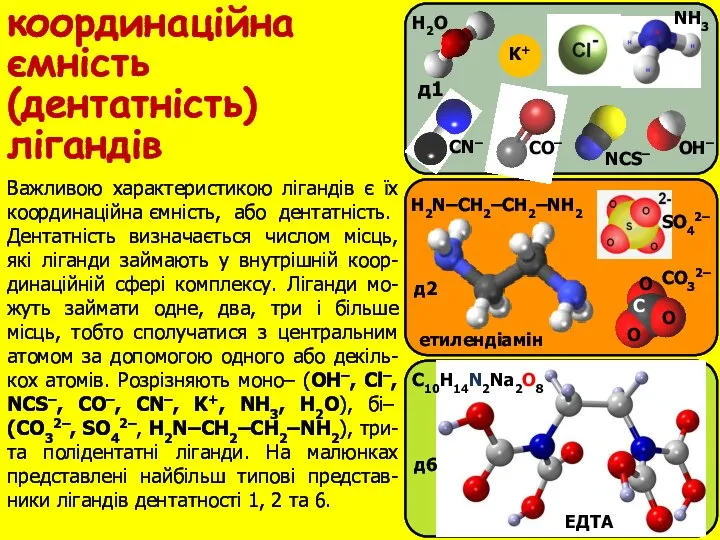
- 12. д1 Важливою характеристикою лігандів є їх координаційна ємність, або дентатність. Дентатність визначається числом місць, які ліганди
- 13. (C55H72N4O5Mg) (Co[C62H88N13O14P])CN (C34H32N4O4Fe) Біоорганічні молекули (білки, гормони, пептиди, нуклеїнові кислоти тощо) є полідентатними лігандами, які разом
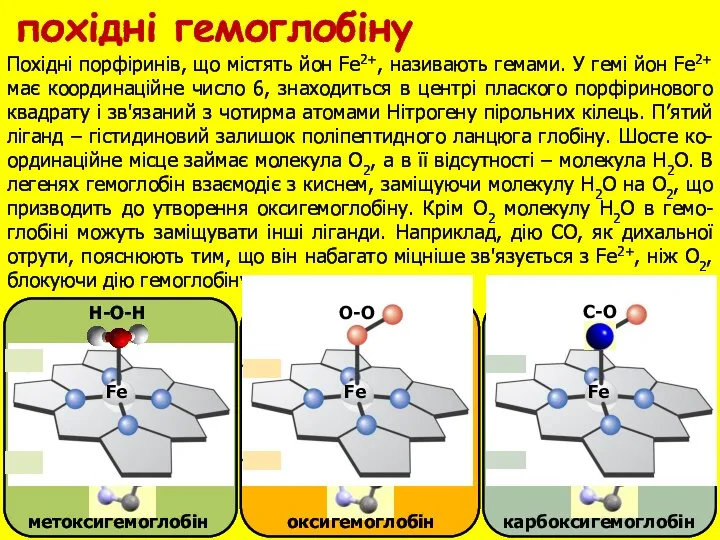
- 14. Похідні порфіринів, що містять йон Fe2+, називають гемами. У гемі йон Fe2+ має координаційне число 6,
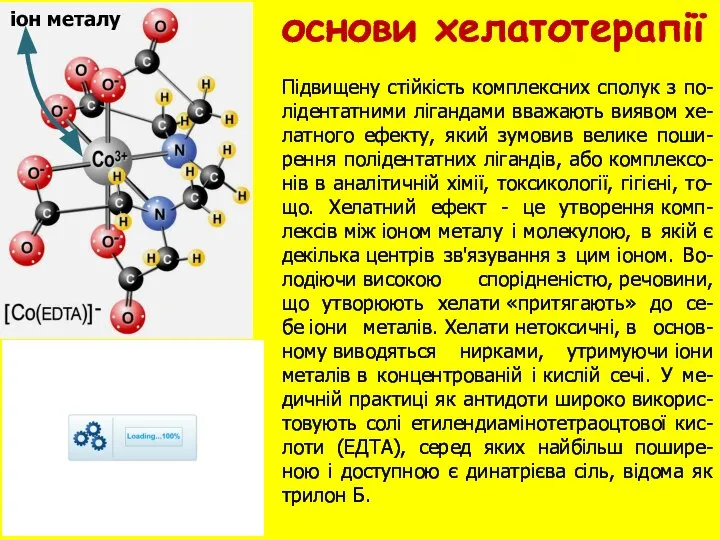
- 15. Підвищену стійкість комплексних сполук з по-лідентатними лігандами вважають виявом хе-латного ефекту, який зумовив велике поши-рення полідентатних
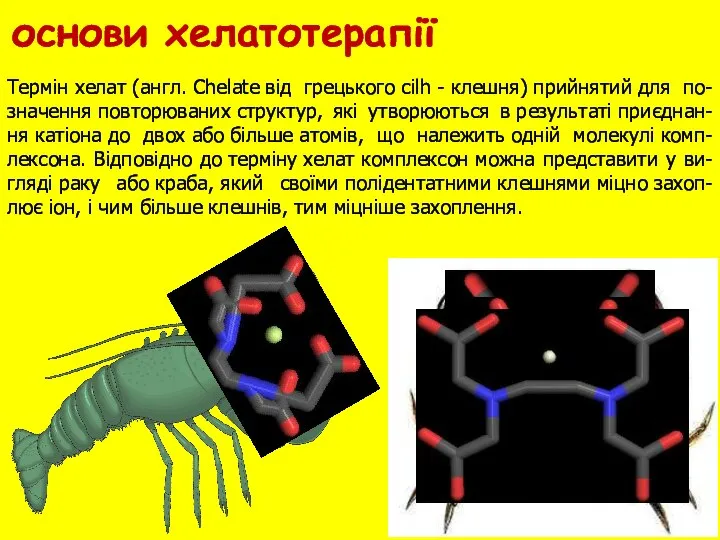
- 16. Термін хелат (англ. Chelate від грецького cilh - клешня) прийнятий для по-значення повторюваних структур, які утворюються
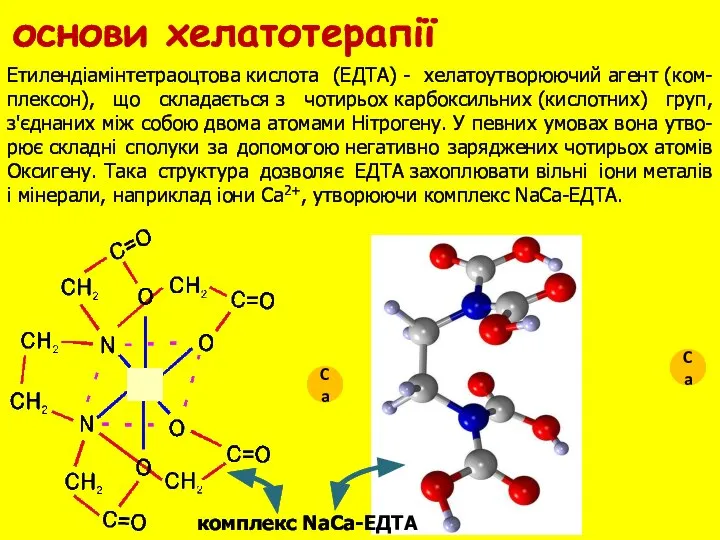
- 17. Етилендіамінтетраоцтова кислота (ЕДТА) - хелатоутворюючий агент (ком-плексон), що складається з чотирьох карбоксильних (кислотних) груп, з'єднаних між
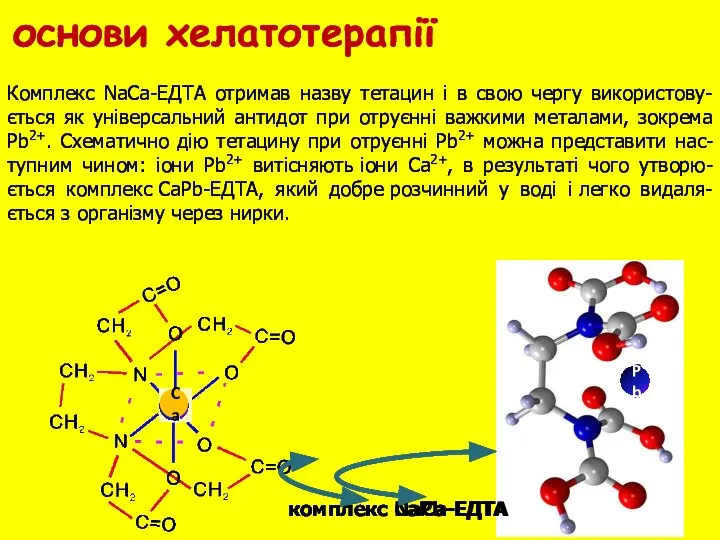
- 18. Pb Ca Комплекс NaCa-ЕДТА отримав назву тетацин i в свою чергу використову-ється як унiверсальний антидот при
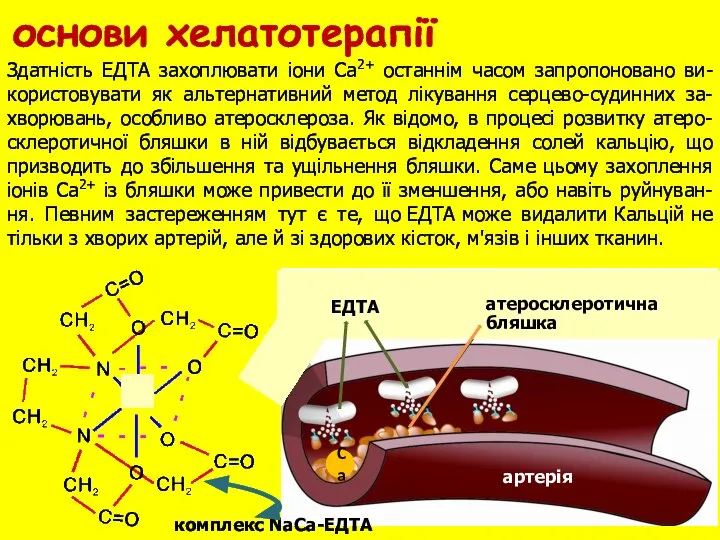
- 19. Ca атеросклеротична бляшка ЕДТА артерiя Здатнiсть ЕДТА захоплювати iони Са2+ останнiм часом запропоновано ви-користовувати як альтернативний
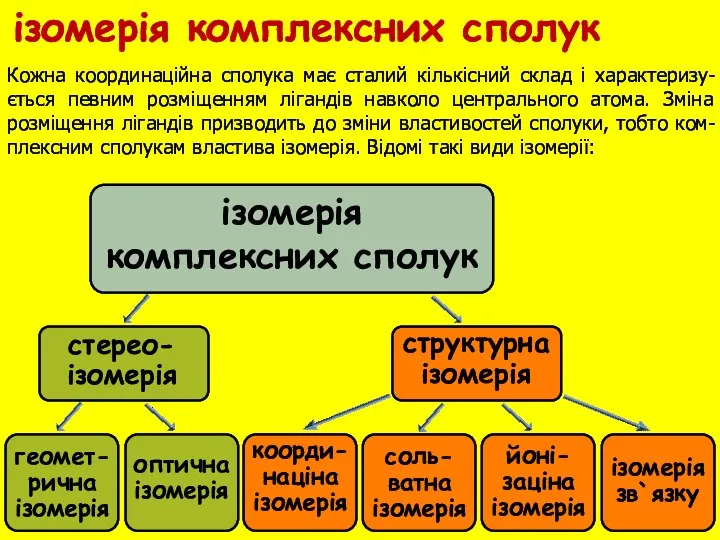
- 20. ізомерія комплексних сполук стерео- ізомерія структурна ізомерія Кожна координаційна сполука має сталий кількісний склад і характеризу-ється
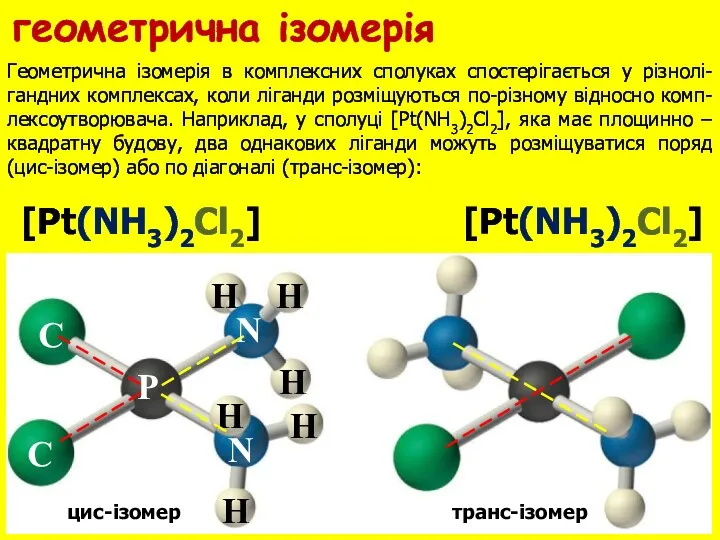
- 21. Геометрична ізомерія в комплексних сполуках спостерігається у різнолі-гандних комплексах, коли ліганди розміщуються по-різному відносно комп-лексоутворювача. Наприклад,
- 22. mer-ізомер fac-ізомер Схожа ізомерія характерна і для комплексів складу [Pt(NH3)3Cl3], але тут вживається інше маркування: конфігурація
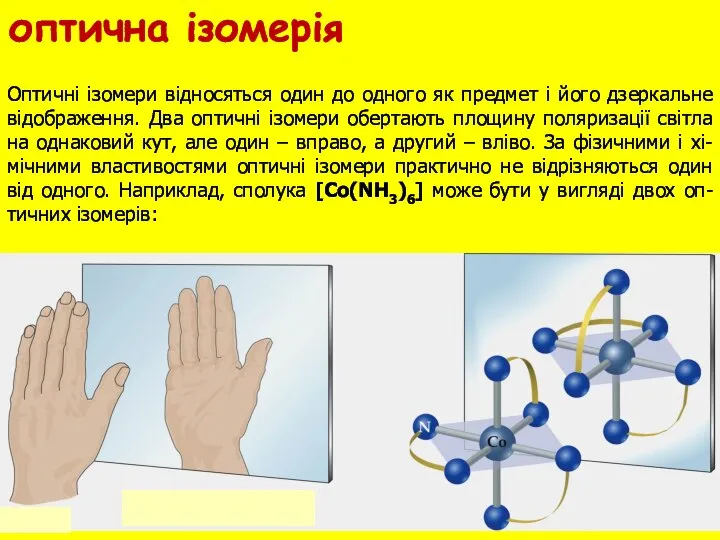
- 23. Оптичні ізомери відносяться один до одного як предмет і його дзеркальне відображення. Два оптичні ізомери обертають
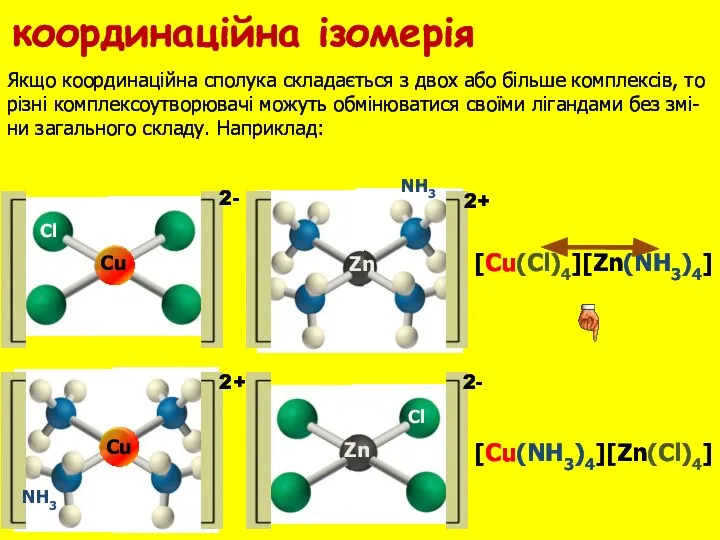
- 24. Zn Cu Cu Zn Якщо координаційна сполука складається з двох або більше комплексів, то різні комплексоутворювачі
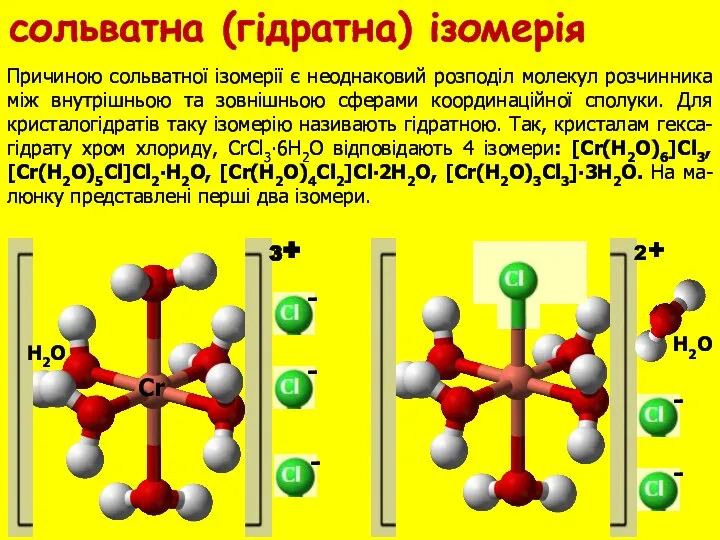
- 25. Причиною сольватної ізомерії є неоднаковий розподіл молекул розчинника між внутрішньою та зовнішньою сферами координаційної сполуки. Для
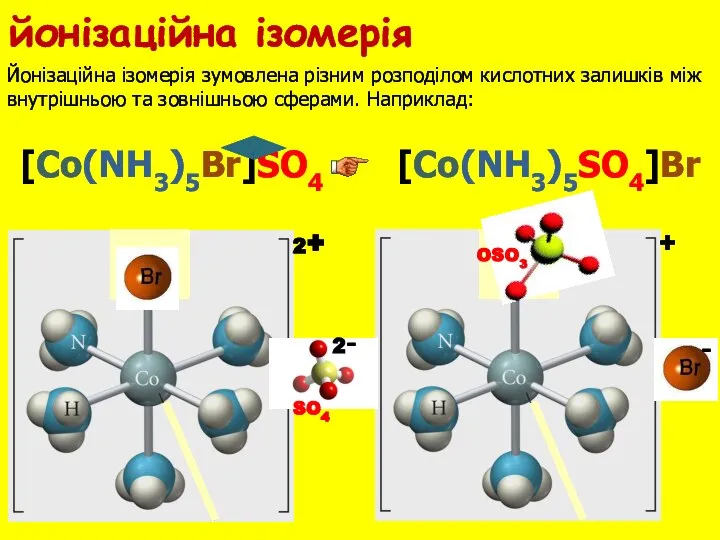
- 26. Йонізаційна ізомерія зумовлена різним розподілом кислотних залишків між внутрішньою та зовнішньою сферами. Наприклад: [Co(NH3)5Br]SO4 [Co(NH3)5SO4]Br йонiзацiйна
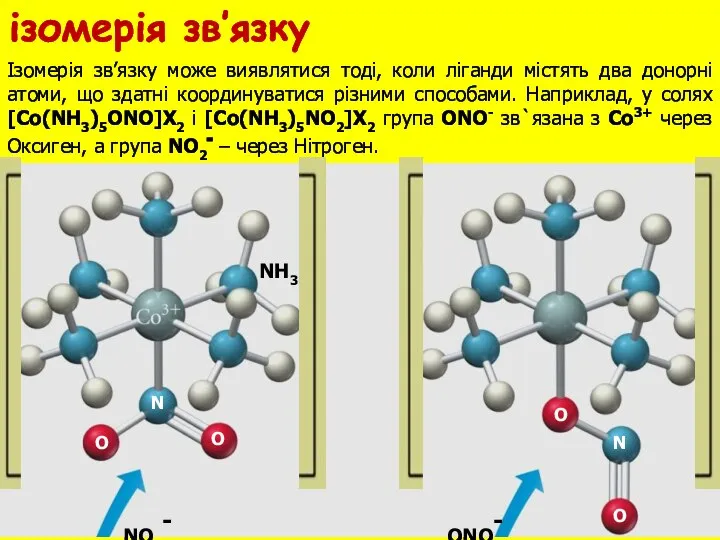
- 27. Ізомерія зв’язку може виявлятися тоді, коли ліганди містять два донорні атоми, що здатні координуватися різними способами.
- 28. У живому організмі d-елементи в біохімічних процесах беруть участь у виг-ляді біокомплексів металів. Лігандами в цих
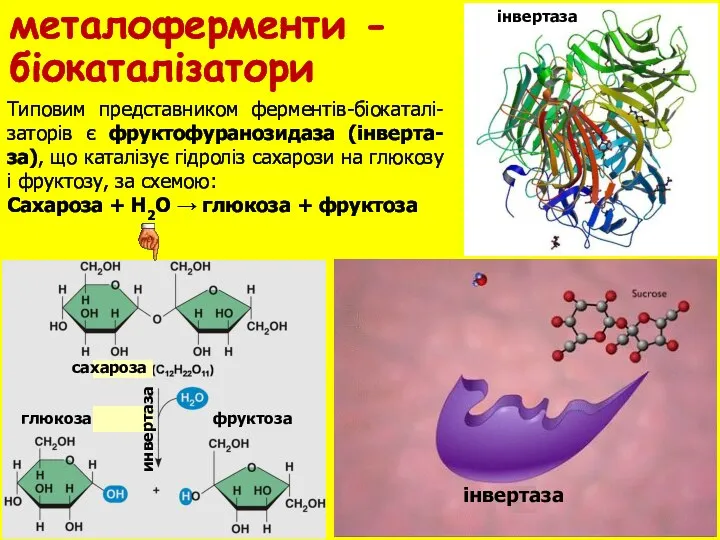
- 29. металоферменти - біокаталізатори инвертаза сахароза глюкоза фруктоза iнвертаза Типовим представником ферментiв-бiокаталi-заторiв є фруктофуранозидаза (інверта-за), що каталізує
- 30. Карбоангідраза - каталізує зворотну гідратацію карбон (IV) оксиду: CO2 + H2O H2CO3 H+ + HCO Карбоксипепсидаза
- 32. Скачать презентацию

![(C55H72N4O5Mg) (Co[C62H88N13O14P])CN (C34H32N4O4Fe) Біоорганічні молекули (білки, гормони, пептиди, нуклеїнові кислоти тощо) є](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1021480/slide-12.jpg)
![mer-ізомер fac-ізомер Схожа ізомерія характерна і для комплексів складу [Pt(NH3)3Cl3], але тут](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1021480/slide-21.jpg)


 Основы физиологии равновесия
Основы физиологии равновесия Общий план строения растительной клетки
Общий план строения растительной клетки Разнообразие растений
Разнообразие растений Сдаём ЁГЭ!
Сдаём ЁГЭ! Многообразие цветковых растений
Многообразие цветковых растений Растения Австралии
Растения Австралии Нуклеиновые кислоты. Функции и состав
Нуклеиновые кислоты. Функции и состав Ткани растений и животных
Ткани растений и животных Amoebozoa. Царство Conosea. Тип Archamoeba
Amoebozoa. Царство Conosea. Тип Archamoeba Noctule bat
Noctule bat Физиология анализаторов
Физиология анализаторов Ленточные черви. Занятие 6
Ленточные черви. Занятие 6 Механические ткани
Механические ткани Клетка – открытая система
Клетка – открытая система Животное надотряда скаты - манта
Животное надотряда скаты - манта Проект Зимующие птицы Тверской области
Проект Зимующие птицы Тверской области Млекопитающие
Млекопитающие Соматосенсорные органы
Соматосенсорные органы Покрытосеменные (Цветковые) растения
Покрытосеменные (Цветковые) растения Класс Птицы
Класс Птицы Шляпочные грибы. Итоговая практико-значимая работа по курсу Государство и общество. 6 класс
Шляпочные грибы. Итоговая практико-значимая работа по курсу Государство и общество. 6 класс Золотая осень. Что это за листья
Золотая осень. Что это за листья Изучение ценопопуляции прострела раскрытого в окрестностях Д. Клавдино
Изучение ценопопуляции прострела раскрытого в окрестностях Д. Клавдино Организм как единая саморазвивающаяся биологическая система
Организм как единая саморазвивающаяся биологическая система Анатомия центральной нервной системы. Оболочки и полости
Анатомия центральной нервной системы. Оболочки и полости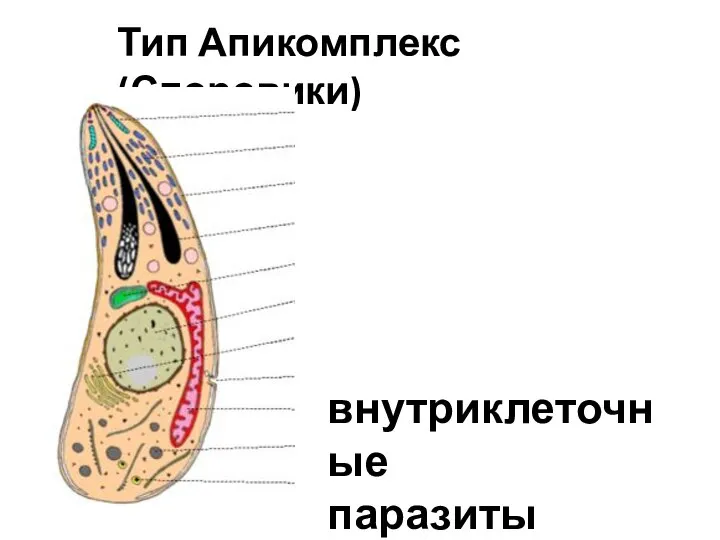 Тип Апикомплекс (Споровики). Внутриклеточные паразиты
Тип Апикомплекс (Споровики). Внутриклеточные паразиты Вирусы, как форма жизни
Вирусы, как форма жизни Акантоцефалезы (Тест)
Акантоцефалезы (Тест)