Содержание
- 2. назначение буферных систем - не в коррекции нарушений КОС (не достижима без участия выделительных органов), а
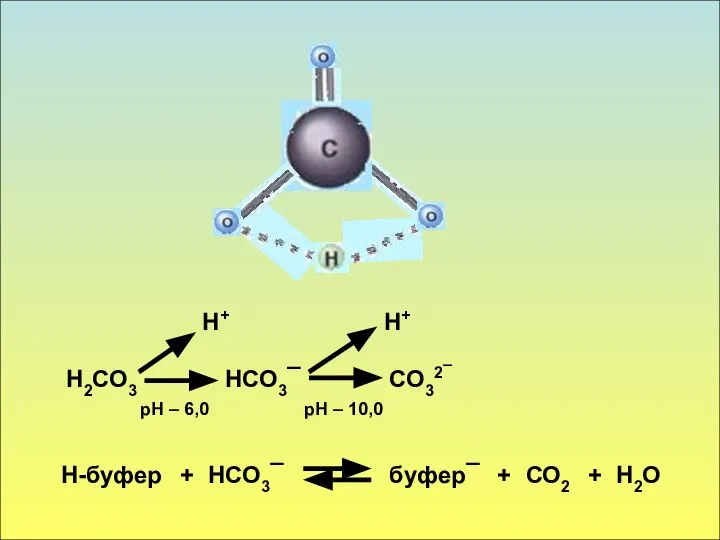
- 3. Буферные системы организма (карбонатная буферная система) Карбонатная буферная система. Она определяется постоянством соотношения угольной кислоты и
- 4. Н2СО3 Н+ НСО3¯ + СО32¯ Н+ рН – 6,0 рН – 10,0 Н-буфер НСО3¯ буфер¯ +
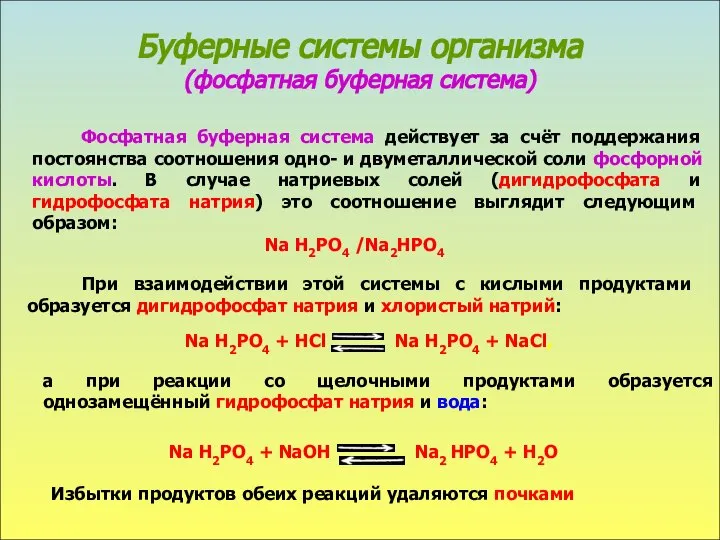
- 5. Буферные системы организма (фосфатная буферная система) Фосфатная буферная система действует за счёт поддержания постоянства соотношения одно-
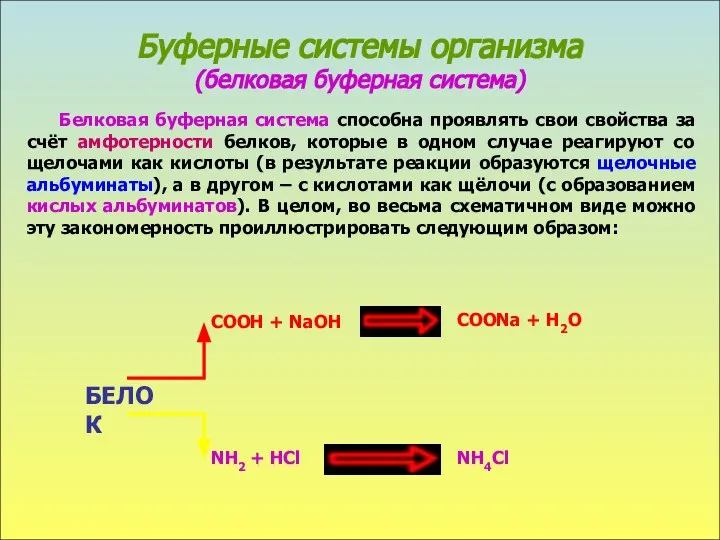
- 6. Буферные системы организма (белковая буферная система) Белковая буферная система способна проявлять свои свойства за счёт амфотерности
- 7. Буферные системы организма (гемоглобиновая буферная система) Гемоглобиновая буферная система в значительной степени обеспечивает буферную ёмкость крови.
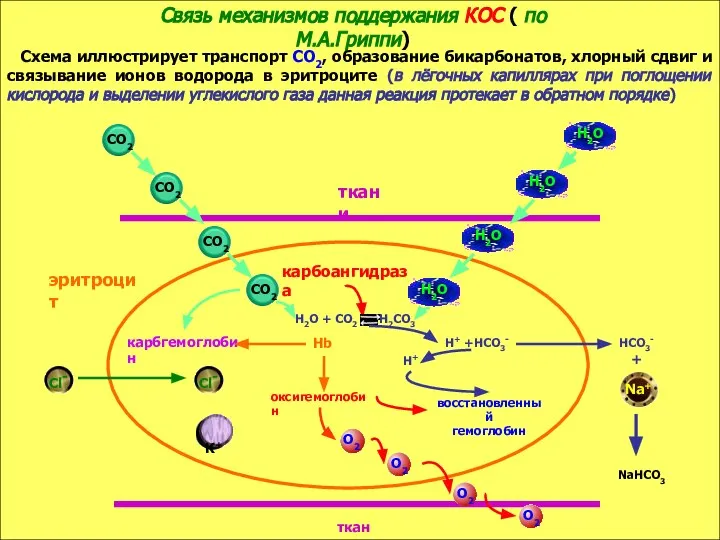
- 8. Связь механизмов поддержания КОС ( по М.А.Гриппи) Схема иллюстрирует транспорт СО2, образование бикарбонатов, хлорный сдвиг и
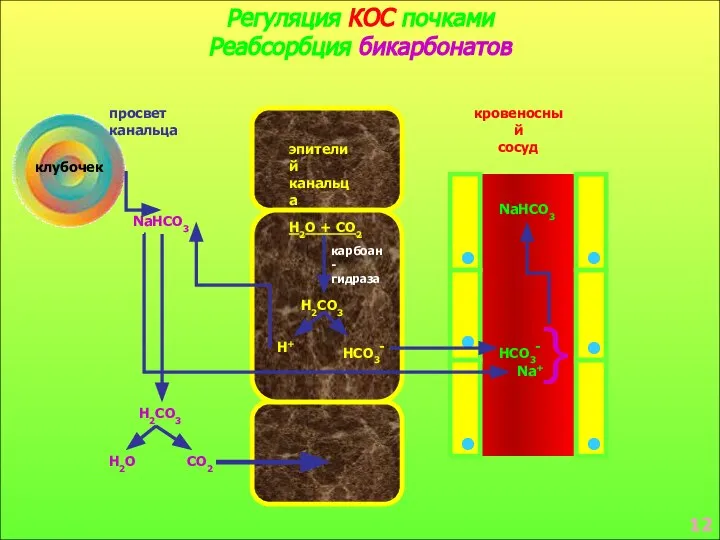
- 9. Регуляция КОС почками Реабсорбция бикарбонатов клубочек просвет канальца эпителий канальца кровеносный сосуд NaHCO3 H2CO3 H2O CO2
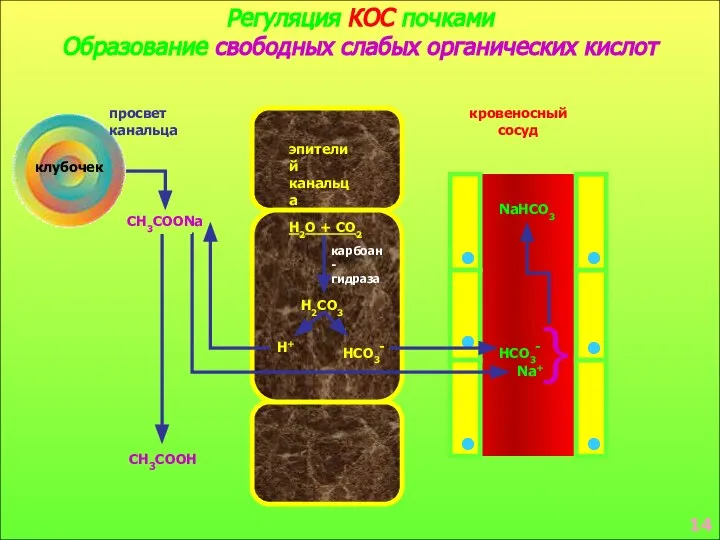
- 10. Регуляция КОС почками Образование свободных слабых органических кислот клубочек просвет канальца эпителий канальца кровеносный сосуд CH3COONa
- 11. ВВ - (буферные основания) показатель содержания ионов бикарбоната и анионов белка и Hb (31,8 - 65
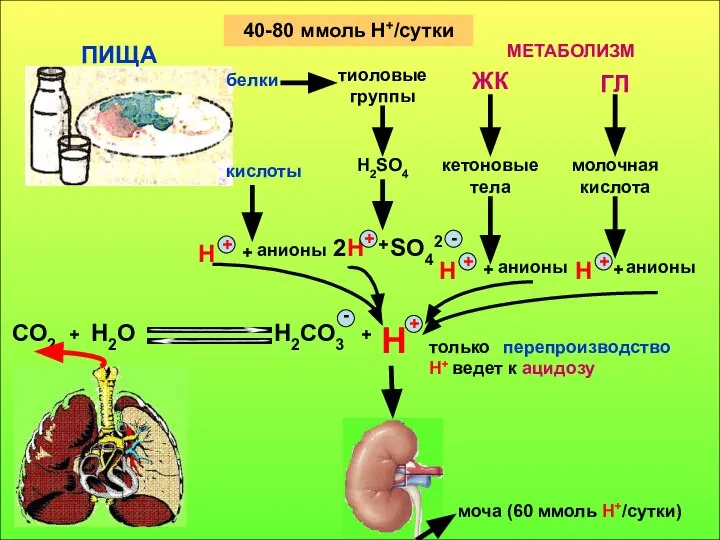
- 12. 40-80 ммоль Н+/сутки белки тиоловые группы ЖК ГЛ кислоты H2SO4 кетоновые тела молочная кислота H +
- 13. У детей Н+ образуется в 2-3 раза больше, чем у взрослых выделение Н+ осуществляется в основном
- 14. Метаболический Метаболический Газовый Газовый [HCO3] [HCO3] АЦИДОЗ АЦИДОЗ АЛКАЛОЗ АЛКАЛОЗ [HCO3] [HCO3] [H2CO3] [H2CO3] Рсо2 Рсо2
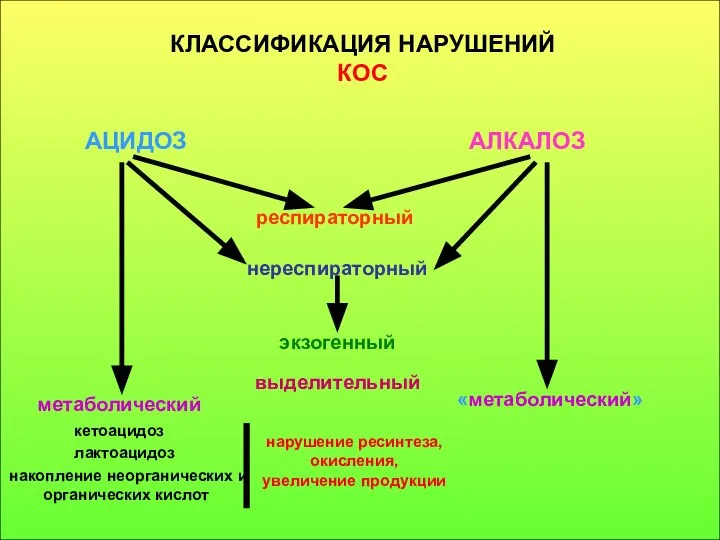
- 15. КЛАССИФИКАЦИЯ НАРУШЕНИЙ КОС АЦИДОЗ АЛКАЛОЗ респираторный нереспираторный экзогенный выделительный метаболический «метаболический» кетоацидоз лактоацидоз накопление неорганических и
- 16. Сочетанные нарушения КОС Метаболический ацидоз + метаболический алкалоз Диабетический кетоацидоз + рвота Метаболический ацидоз + дыхательный
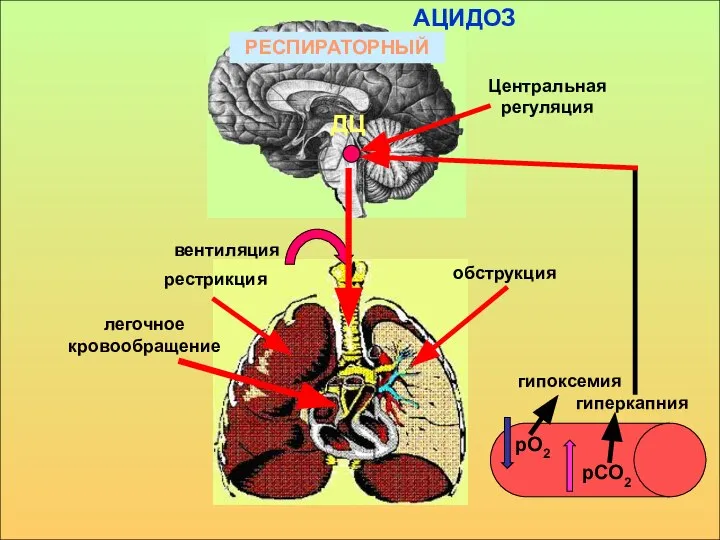
- 17. рО2 рСО2 гипоксемия гиперкапния Центральная регуляция ДЦ РЕСПИРАТОРНЫЙ вентиляция рестрикция обструкция легочное кровообращение АЦИДОЗ
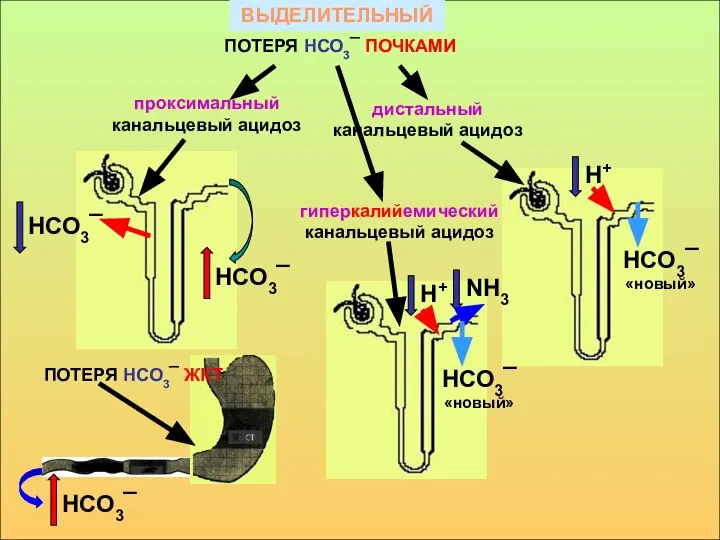
- 18. ВЫДЕЛИТЕЛЬНЫЙ проксимальный канальцевый ацидоз дистальный канальцевый ацидоз ПОТЕРЯ НСО3¯ ПОЧКАМИ гиперкалийемический канальцевый ацидоз НСО3¯ НСО3¯ НСО3¯
- 19. Рosm Na+ Б Н+ гипоосмолярная жидкость ([Na+ + [K+] — [Cl-] + [HCO3-]) анионной разницы гиперосмолярная
- 20. Компенсаторные реакции при основных формах нарушения КОС Метаболический ацидоз [НСО3] [НСО3] Рсо2 Рсо2 Рсо2 Рсо2 [НСО3]
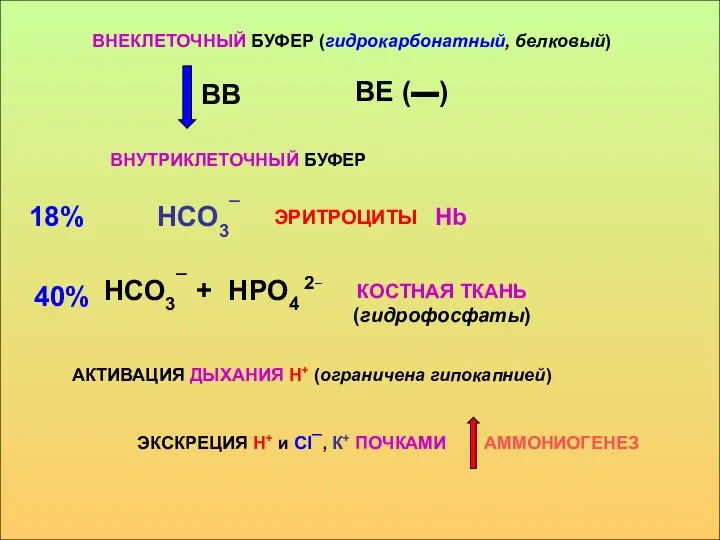
- 21. ВНЕКЛЕТОЧНЫЙ БУФЕР (гидрокарбонатный, белковый) ВВ ВЕ (▬) ВНУТРИКЛЕТОЧНЫЙ БУФЕР НСО3¯ 18% ЭРИТРОЦИТЫ НСО3¯ + НРО4 2¯
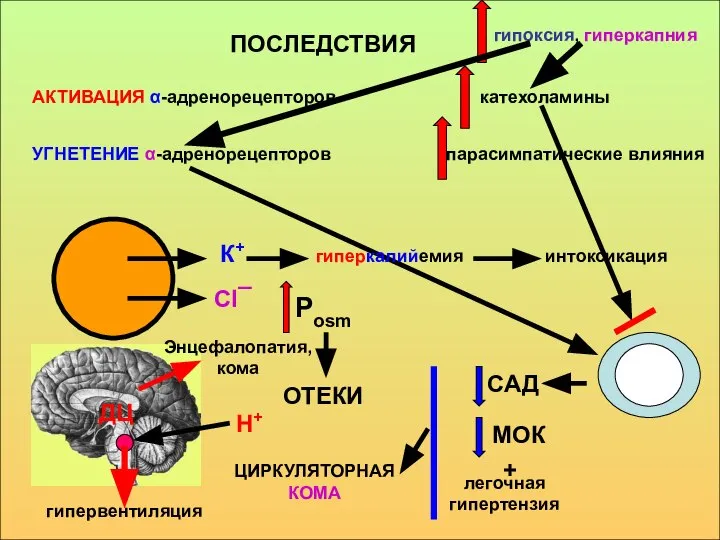
- 22. ПОСЛЕДСТВИЯ катехоламины УГНЕТЕНИЕ α-адренорецепторов парасимпатические влияния К+ Сl¯ Н+ гиперкалийемия интоксикация гипервентиляция САД Рosm ОТЕКИ МОК
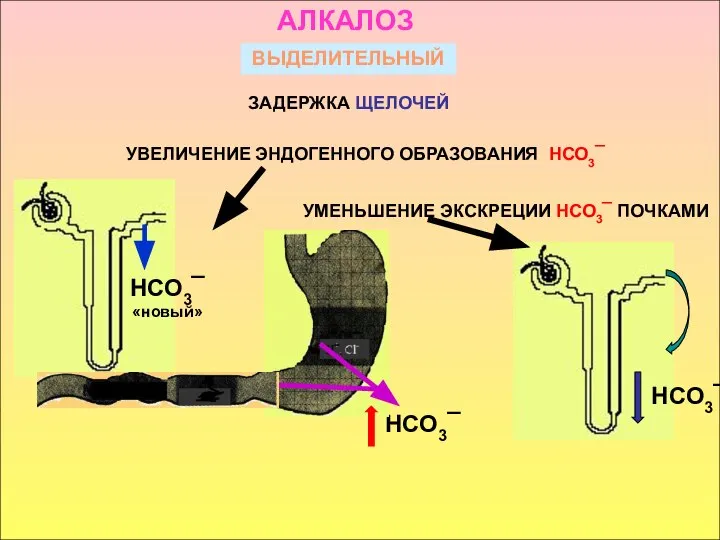
- 23. ВЫДЕЛИТЕЛЬНЫЙ ЗАДЕРЖКА ЩЕЛОЧЕЙ НСО3¯ АЛКАЛОЗ УВЕЛИЧЕНИЕ ЭНДОГЕННОГО ОБРАЗОВАНИЯ НСО3¯ УМЕНЬШЕНИЕ ЭКСКРЕЦИИ НСО3¯ ПОЧКАМИ НСО3¯ «новый» НСО3¯
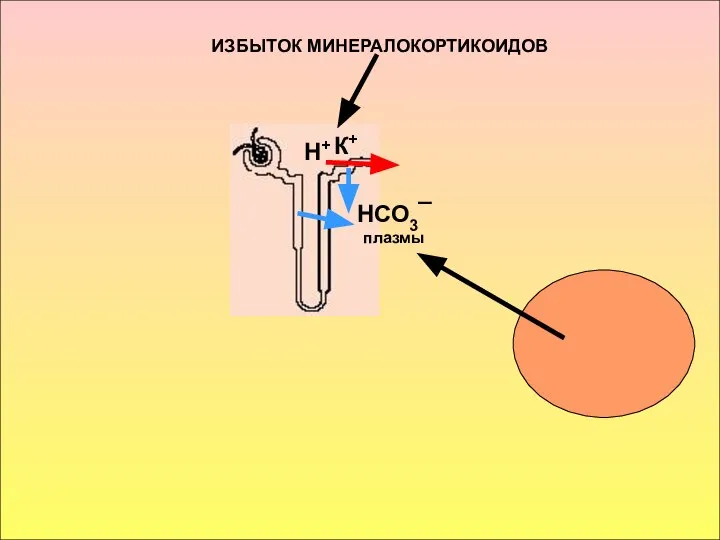
- 24. ИЗБЫТОК МИНЕРАЛОКОРТИКОИДОВ Н+ К+ НСО3¯ плазмы
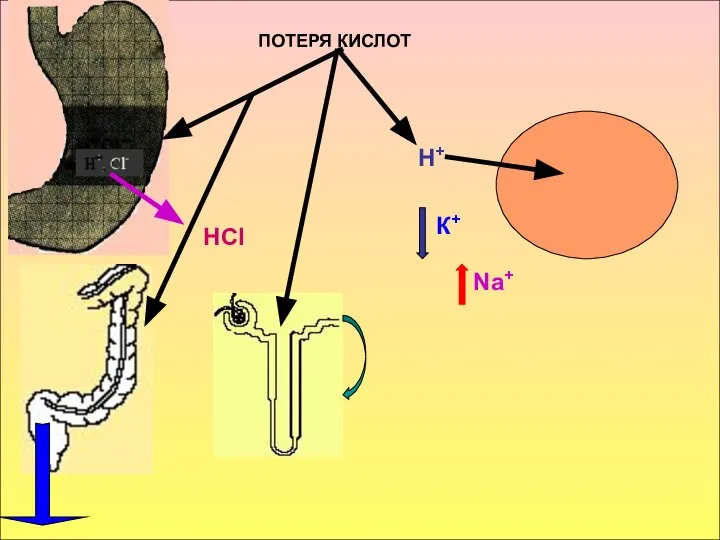
- 25. ПОТЕРЯ КИСЛОТ НСl Н+ К+ Na+
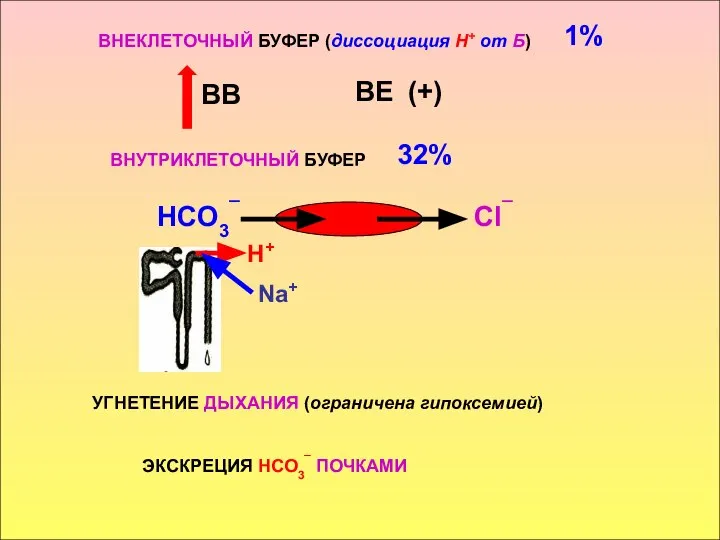
- 26. ВНЕКЛЕТОЧНЫЙ БУФЕР (диссоциация Н+ от Б) ВВ ВЕ (+) ВНУТРИКЛЕТОЧНЫЙ БУФЕР НСО3¯ 32% 1% ЭКСКРЕЦИЯ НСО3¯
- 28. Скачать презентацию





![Метаболический Метаболический Газовый Газовый [HCO3] [HCO3] АЦИДОЗ АЦИДОЗ АЛКАЛОЗ АЛКАЛОЗ [HCO3] [HCO3] [H2CO3] [H2CO3] Рсо2 Рсо2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1135770/slide-13.jpg)

![Рosm Na+ Б Н+ гипоосмолярная жидкость ([Na+ + [K+] — [Cl-] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1135770/slide-18.jpg)
![Компенсаторные реакции при основных формах нарушения КОС Метаболический ацидоз [НСО3] [НСО3] Рсо2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1135770/slide-19.jpg)
 Анатомия к ЕГЭ
Анатомия к ЕГЭ АФО органов пищеварения
АФО органов пищеварения 7ac29e02b1944081b6d74f4de0f8510a
7ac29e02b1944081b6d74f4de0f8510a Метаболизм. Энергетический обмен
Метаболизм. Энергетический обмен Диплоидный и гаплоидный набор
Диплоидный и гаплоидный набор Сообщества воды. 5 класс
Сообщества воды. 5 класс Хомяки в домашних условиях
Хомяки в домашних условиях Ткани внутренней среды
Ткани внутренней среды Экспериментальное выявление филогенетического родства некоторых таксонов
Экспериментальное выявление филогенетического родства некоторых таксонов Презентация на тему СОСНОВЫЙ ЛЕС
Презентация на тему СОСНОВЫЙ ЛЕС  Отделы растений. Циклы развития
Отделы растений. Циклы развития Крестовский карьер – памятник природы Ярославля
Крестовский карьер – памятник природы Ярославля Презентация по биологии_ Тип Плоские черви_,7 класс
Презентация по биологии_ Тип Плоские черви_,7 класс Взаимодействие природы и общества
Взаимодействие природы и общества Звуки в лесу
Звуки в лесу Грибы Кубани
Грибы Кубани Плесневые грибы и дрожжи
Плесневые грибы и дрожжи Анатомия органов слуха
Анатомия органов слуха Инвазия чужеродных животных и растительности
Инвазия чужеродных животных и растительности Зеленые зоны воронежа: от сохранения и преобразования к поиску смысловой и образной содержательности
Зеленые зоны воронежа: от сохранения и преобразования к поиску смысловой и образной содержательности Занятие по ознакомлению с окружающим миром на тему Цветы
Занятие по ознакомлению с окружающим миром на тему Цветы Уроки №№ 14-15 МНОГООБРАЗИЕ ВОДОРОСЛЕЙ, ИХ РОЛЬ В ПРИРОДЕ И ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ. Отделы Зеленые водоросли, Красные водоросли, Бур
Уроки №№ 14-15 МНОГООБРАЗИЕ ВОДОРОСЛЕЙ, ИХ РОЛЬ В ПРИРОДЕ И ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ. Отделы Зеленые водоросли, Красные водоросли, Бур В гостях у бабушки травницы
В гостях у бабушки травницы Нервная регуляция работы внутренних органов
Нервная регуляция работы внутренних органов Тип Губки
Тип Губки Фотосинтез
Фотосинтез Автор: Филатова Анжелика, ученица 6 класса Руководитель: Филатова С.Н., учитель биологии МБОУ СОШ №6 город Ливны 2012 год
Автор: Филатова Анжелика, ученица 6 класса Руководитель: Филатова С.Н., учитель биологии МБОУ СОШ №6 город Ливны 2012 год