Слайд 2ПЛАН ЛЕКЦИИ:
1. Химическая природа и структурная организация ферментов;
2. Сходства и отличия ферментов

и неорганических катализаторов;
3. Коферменты, классификация, функции;
4. Классификация и номенклатура ферментов;
5. Свойства ферментов;
6. Механизм действия ферментов;
7. Ингибирование ферментативной активности;
8. Регуляция активности ферментов.
Слайд 3Ферменты – биокатализаторы белковой природы.
Рибозимы - биокатализаторы, по химической природе РНК.
Рибозимы катализируют

разрыв фосфодиэфирных связей нуклеиновых кислот.
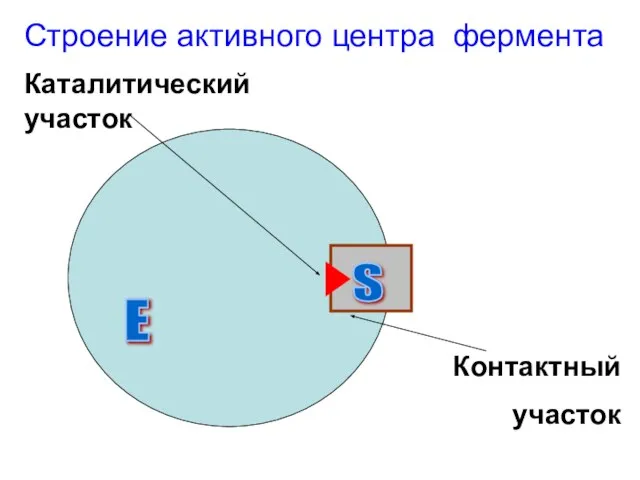
Слайд 4Строение активного центра фермента
Е
S
Каталитический участок
Контактный
участок
Слайд 5ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ:
Повышают скорость реакции;
В реакциях не

расходуются;
Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
Слайд 6ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ФЕРМЕНТОВ:
1 .Ферменты обладают более высокой эффективностью действия (повышают скорость реакции

в большее число раз, чем неорганические катализаторы).
2.Ферменты чувствительны к температуре (термолабильны)
3.Ферменты чувствительны к значениям рН среды.
4.Специфичность действия.
5.Ферменты - это катализаторы с регулируемой активностью.
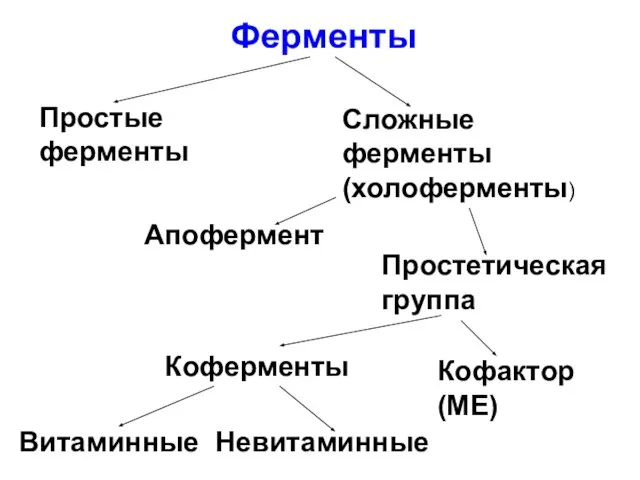
Слайд 7Ферменты
Простые ферменты
Сложные ферменты (холоферменты)
Апофермент
Простетическая группа
Кофактор
(МЕ)
Витаминные
Невитаминные
Коферменты
Слайд 8Коферменты:
Витаминные:
тиаминовые ;
флавиновые;
пантотеновые;
никотинамидные;
пиридоксиновые.
Невитаминные:
нуклеотиды;
производные порфирина;
глутатион.

Слайд 9Тиаминовые коферменты
Производные витамина B1 (тиамина);
Участвуют в реакциях декарбоксилирования кетокислот (входят в

состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного комплексов);
Являются коферментами транскетолаз (распад глюкозы);
Основной представитель тиаминдифосфат (ТДФ).
Слайд 10Флавиновые коферменты
Производные витамина B2 (рибофлавина);
ФМН – флавинмононуклеотид;
ФАД – флавинадениндинуклеотид;
Могут быть в

окисленной и восстановленной формах;
Коферменты дегидрогеназ.
Слайд 11Пантотеновые коферменты
Производные пантотеновой кислоты);
Основной представитель – кофермент А;
Участвует:
в переносе кислотных

остатков;
Синтезе холестерола и кетоновых тел;
Активации жирных кислот;
Обезвреживании ксенобиотиков.
Слайд 12Никотинамидные коферменты
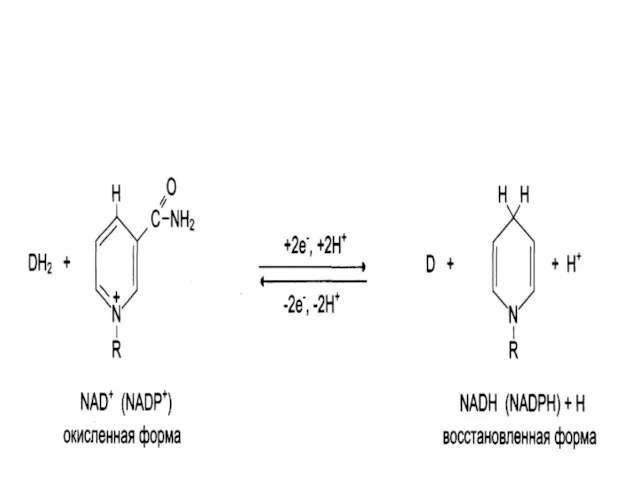
Производные витамина РР (никотинамид);
НАД (никотинамидадениндинуклеотид);
НАДФ (никотинамидадениндинуклеотидфосфат);
Коферменты могут быть в окисленной

и восстановленной формах;
НАД и НАДФ связаны с ферментами дегидрогеназами, которые в окислительно-восстановительных реакциях.
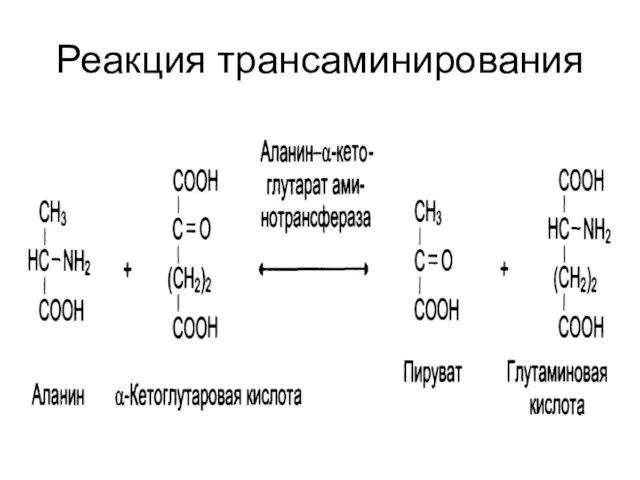
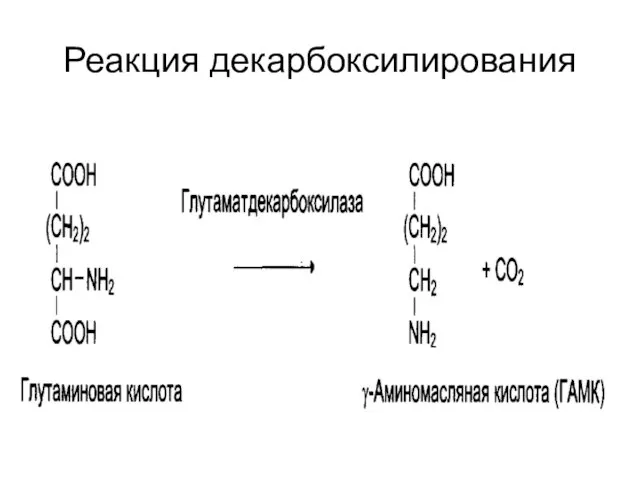
Слайд 14Пиридоксиновые коферменты
Производные витамина В6 (пиридоксин);
Кофермент – пиридоксальфосфат;
Участвует в :
Реакциях переаминирования (трансаминирование).

Связан с ферментами аминотрансферазами;
Реакциях декарбоксилирования аминокислот.
Слайд 15Номенклатура ферментов
Тривиальная - пепсин
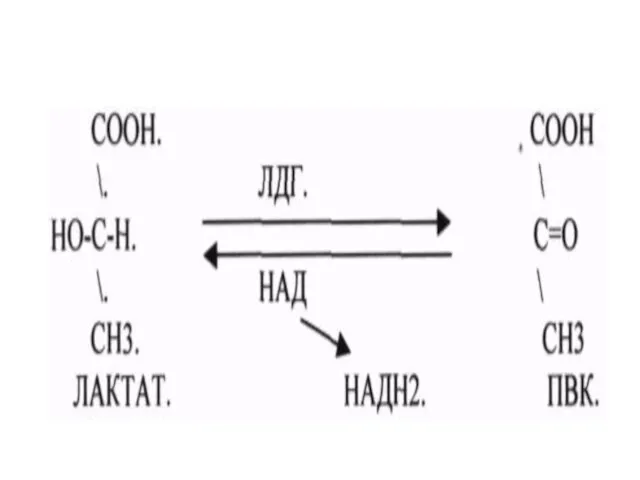
Рабочая - лактатдегидрогеназа
Систематическая - L-лактат:НАД - оксидоредуктаза

Слайд 16Шифр
1-номер класса
2-номер подкласса
3-номер подподкласса
4-индивидуальный номер фермента в подподклассе
1.1.1.27

- ЛДГ
Слайд 17Классификация ферментов
В основе лежит тип катализируемой реакции
1. Оксидоредуктазы
2. Трансферазы
3.

Гидролазы
4. Лиазы
5. Изомеразы
6. Синтетазы
7. Транслоказы
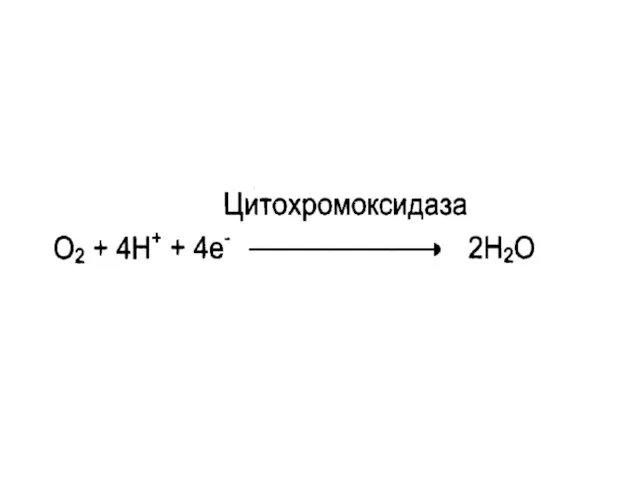
Слайд 18Оксидоредуктазы
Катализируют окислительно - восстановительные реакции
Подклассы:
дегидрогеназы;
оксидазы;
оксигеназы.

Слайд 21Трансферазы
ускоряют реакции транспорта групп атомов от одного субстрата к другому.
Подклассы (в

зависимости от переносимых групп):
аминотрансферазы;
метилтрансферазы;
фосфотрансферазы (киназы);
ацилтрансферазы;
гликозилтрансферазы
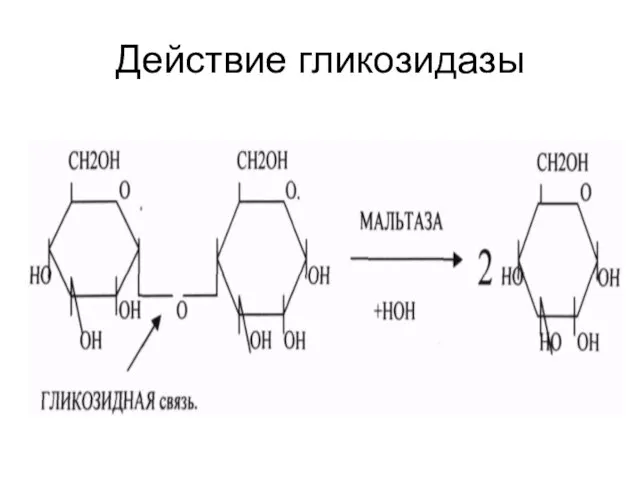
Слайд 23Гидролазы
катализируют реакции разрыва связей в молекулах субстратов при участии воды. При этом

элементы воды присоединяются к свободным единичным валентностям, образовавшимся после разрыва связей.
Подклассы:
эстеразы;
гликозидазы;
пептидазы;
фосфатазы.
Слайд 26Лиазы
ускоряют отщепление негидролитическим путем групп: СООН, NH2, SH2;
присоединение воды по двойной связи.

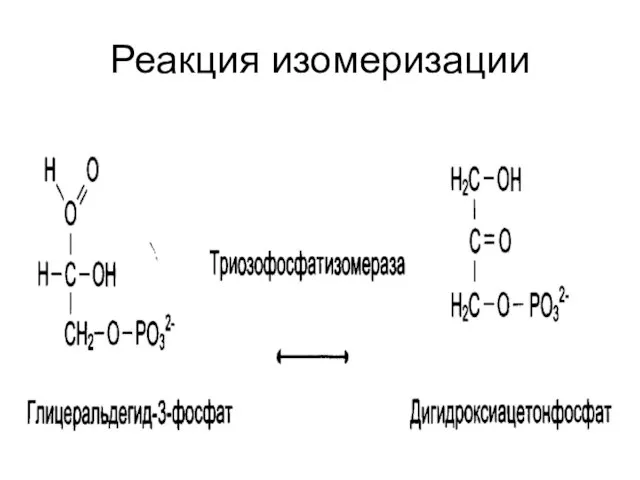
Слайд 29Изомеразы
катализируют реакции изомеризации.
Выделяют:
«истинные изомеразы»;
мутазы

Слайд 31Лигазы (синтетазы)
участвуют в реакциях соединения двух и более простых веществ с образованием
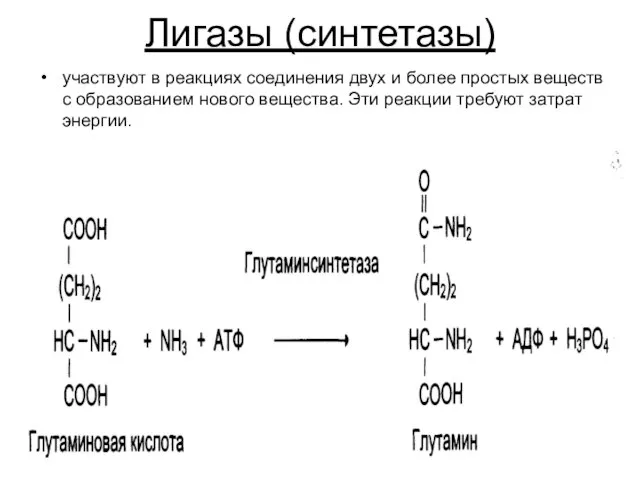
нового вещества. Эти реакции требуют затрат энергии.
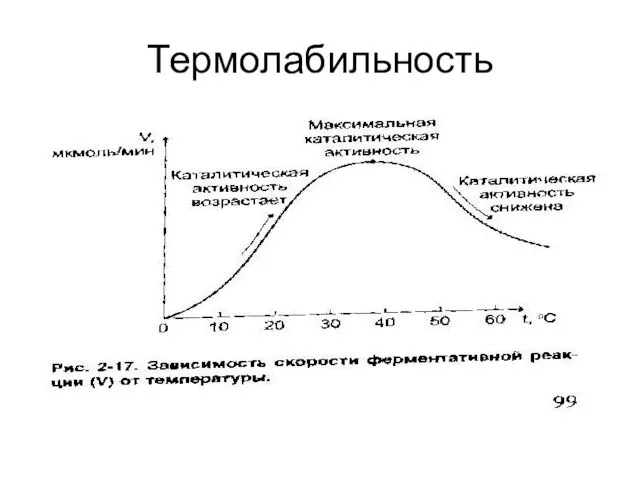
Слайд 32Свойства ферментов:
Высок ая каталитическая активность;
специфичность действия;
термолабильность;
чувствительность к изменению рН среды;
регулируемая активность.

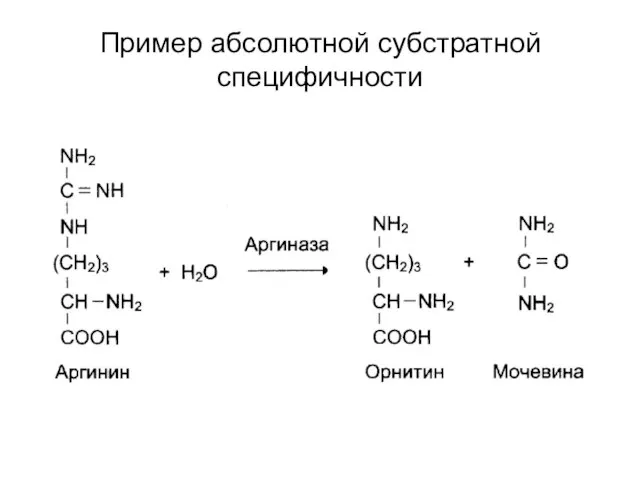
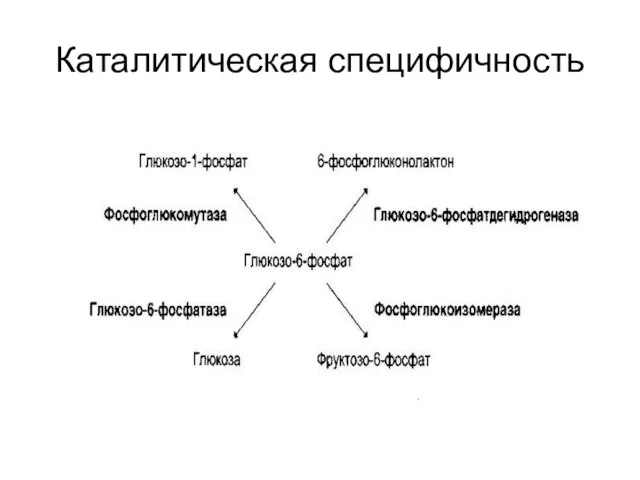
Слайд 33Специфичность действия
Субстратная
абсолютная;
групповая;
стереоспецифичность.
Каталитическая
обеспечивается каталитическим участком;
происходит выбор пути превращения субстрата

Слайд 34Пример абсолютной субстратной специфичности
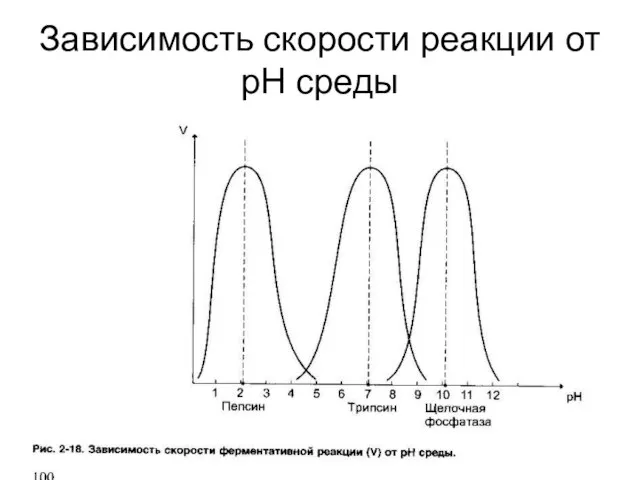
Слайд 37Зависимость скорости реакции от рН среды
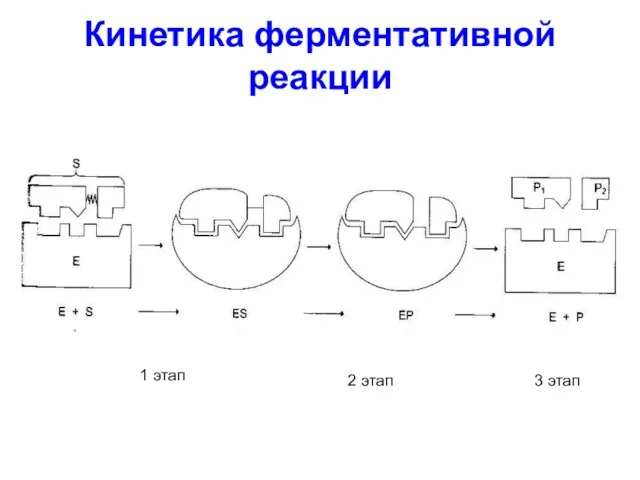
Слайд 38Кинетика ферментативной реакции
1 этап
3 этап
2 этап
Слайд 39Молекулярные эффекты:
Эффект концентрирования;
Эффект ориентации;
Эффект индуцированного соответствия;
Эффект натяжения связей субстрата;
Эффект кислотно-основного катализа;
Эффект ковалентного

катализа.
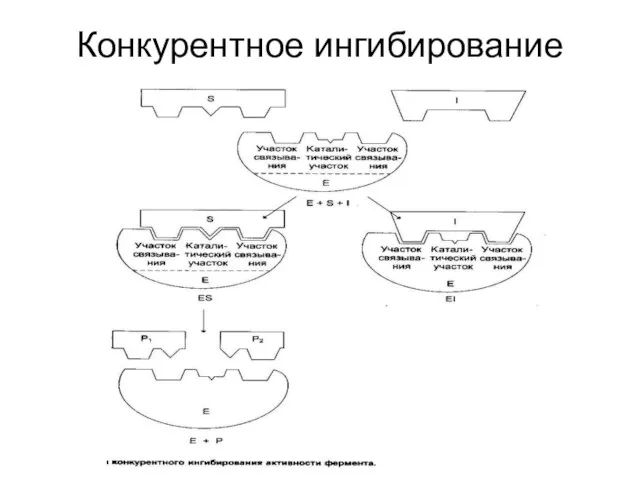
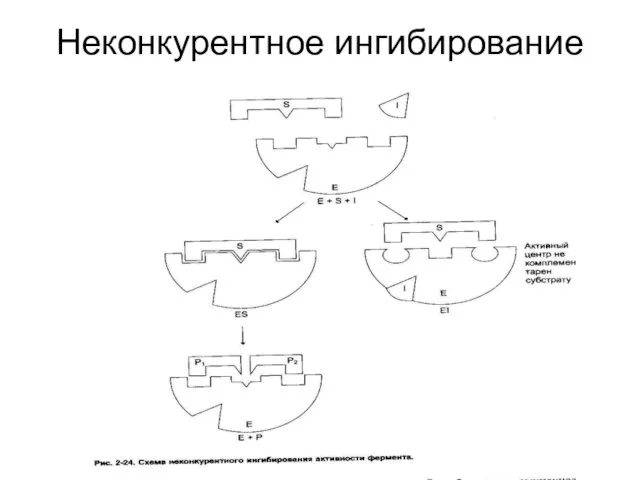
Слайд 40Ингибирование ферментативной активности
снижение каталитической активности в присутствии определенных веществ – ингибиторов.
Виды

ингибирования:
По механизму (конкурентное, неконкурентное);
По обратимости (обратимое, необратимое);
По специфичности (специфическое, неспецифическое).
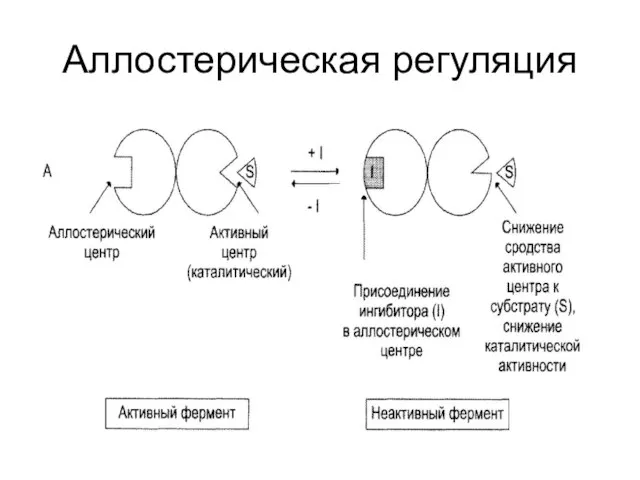
Слайд 43Способы регуляции активности ферментов:
Аллостерическая регуляция;
Регуляция с помощью белок-белковых взаимодействий;
Фосфорилирование / дефосфорилирование;
Частичный протеолиз.































 Лишайники
Лишайники Дыхательная система человека
Дыхательная система человека Вегетативная нервная система
Вегетативная нервная система Что такое удобрения
Что такое удобрения Презентация на тему Внутренняя среда организма. Кровь
Презентация на тему Внутренняя среда организма. Кровь  Витаминная азбука
Витаминная азбука Тема урока: Состав крови. Эритроциты. Задачи урока: сформировать знания о составе крови и её функциях. О значении крови для жизнеде
Тема урока: Состав крови. Эритроциты. Задачи урока: сформировать знания о составе крови и её функциях. О значении крови для жизнеде Метаболизм, или обмен веществ
Метаболизм, или обмен веществ Размножение организмов
Размножение организмов Строение волос
Строение волос Гипоксия (кислородное голодание)
Гипоксия (кислородное голодание) Популярные мульты глазами биолога
Популярные мульты глазами биолога Дигибридное скрещивание. Цитологические основы дигибридного скрещивания
Дигибридное скрещивание. Цитологические основы дигибридного скрещивания Презентация на тему Введение в зоологию
Презентация на тему Введение в зоологию  Семейства рыб
Семейства рыб Обмен веществ и энергии
Обмен веществ и энергии Цитогенетические методы и их классификация
Цитогенетические методы и их классификация Майские растения луга и сада. Рекомендуемые наблюдения, лексические игры и упражнения с ребенком на прогулке
Майские растения луга и сада. Рекомендуемые наблюдения, лексические игры и упражнения с ребенком на прогулке Опасные растения и насекомые Крыма
Опасные растения и насекомые Крыма Кровообращение
Кровообращение Skelet_kosti_verkhnikh_konechnostey_s_ozvuchkoy
Skelet_kosti_verkhnikh_konechnostey_s_ozvuchkoy Домашние животные
Домашние животные Биология рака
Биология рака Как зимой помочь птицам
Как зимой помочь птицам Мой сад
Мой сад Презентация на тему МЕТОДЫ ГЕННОЙ ИНЖЕНЕРИИ
Презентация на тему МЕТОДЫ ГЕННОЙ ИНЖЕНЕРИИ  Слайды по теме Царство Грибы
Слайды по теме Царство Грибы Вирусы и их разновидности
Вирусы и их разновидности