Содержание
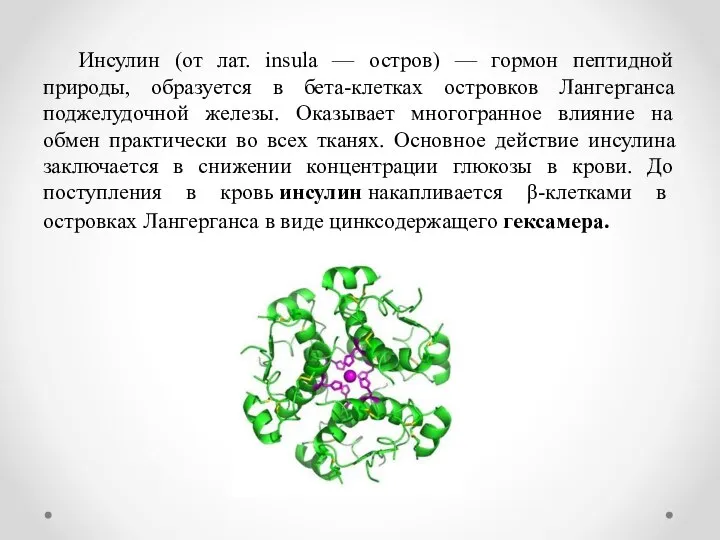
- 2. Инсулин (от лат. insula — остров) — гормон пептидной природы, образуется в бета-клетках островков Лангерганса поджелудочной
- 3. Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка,
- 4. В 1921 г. трое канадских исследователей – профессор физиологии университета в г. Торонто (Канада) Джон Маклеод,
- 5. Инсулин в кристаллическом виде впервые сумел получить в 1926 г. Дж.Абель. Именно благодаря его работам удалось
- 6. В 1972 г. английский биофизик Дороти Кроуфут-Ходжкин установила трехмерную структуру этого необычайно сложного комплекса. Белковая молекула
- 7. На схеме изображено последовательное соединение аланина, валина и глицина.
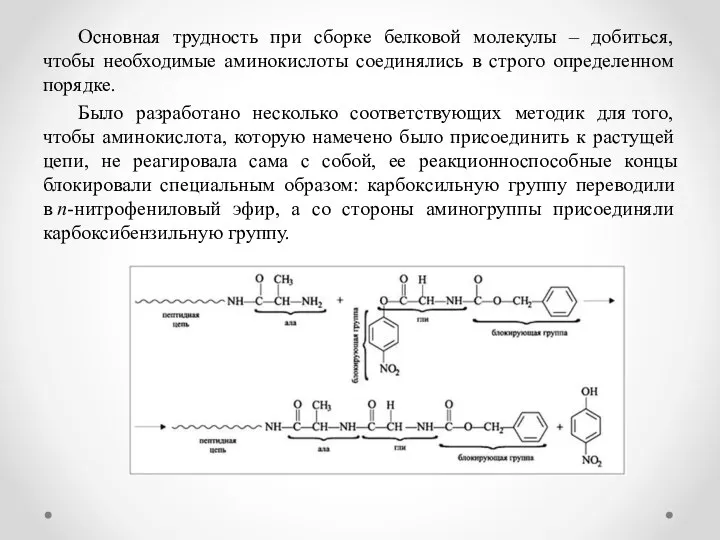
- 8. Основная трудность при сборке белковой молекулы – добиться, чтобы необходимые аминокислоты соединялись в строго определенном порядке.
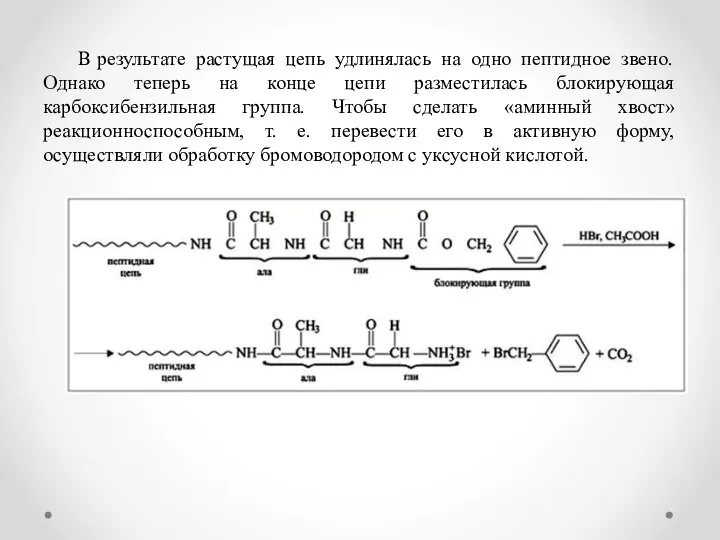
- 9. В результате растущая цепь удлинялась на одно пептидное звено. Однако теперь на конце цепи разместилась блокирующая
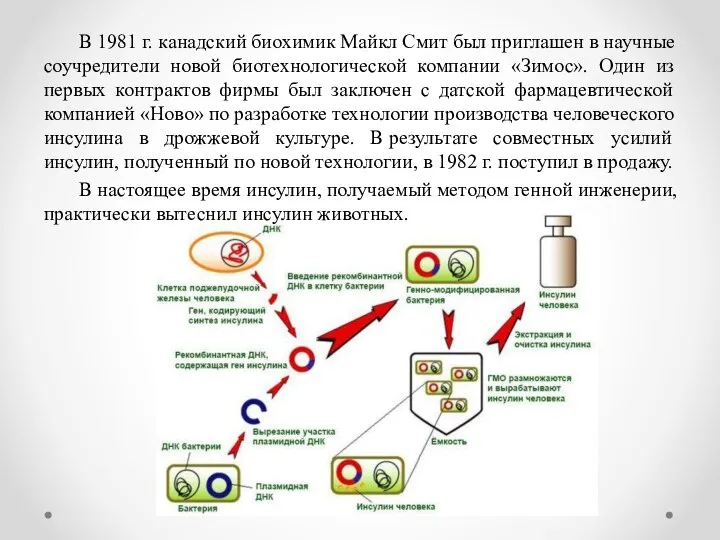
- 10. В 1981 г. канадский биохимик Майкл Смит был приглашен в научные соучредители новой биотехнологической компании «Зимос».
- 11. Химические свойства В водных растворах инсулин образует димеры и гексамеры, которые легко дают кристалличекие соединения. с
- 12. Применение в медицине для лечения сахарного диабета; фурункулеза; заболеваний ЖКТ; хронических гепатитов, начальных форм цирроза печени;
- 14. Скачать презентацию







 Триасово-Юрское вымирание динозавров
Триасово-Юрское вымирание динозавров Белки
Белки Лишайники
Лишайники Плакаты по биологии
Плакаты по биологии Круглые черви и прогресс
Круглые черви и прогресс Презентация на тему Методы изучения клетки
Презентация на тему Методы изучения клетки  Красная книга Самарской области
Красная книга Самарской области Опыление и оплодотворение
Опыление и оплодотворение Тип Хордовые
Тип Хордовые Отряд Голенастые
Отряд Голенастые Динозавры. Мезозойская эра
Динозавры. Мезозойская эра Расселение и распространение живых организмов
Расселение и распространение живых организмов Строение и жизнедеятельность водорослей
Строение и жизнедеятельность водорослей Альбом 1 семестр
Альбом 1 семестр Эволюционное учение Ч. Дарвина
Эволюционное учение Ч. Дарвина Способы размножения ( 6 класс)
Способы размножения ( 6 класс) Презентация на тему Одомашненные насекомые
Презентация на тему Одомашненные насекомые  Анализ групп крови у жителей Московского района города Твери
Анализ групп крови у жителей Московского района города Твери Презентация на тему Тип Губки. Тип Кишечнополостные
Презентация на тему Тип Губки. Тип Кишечнополостные 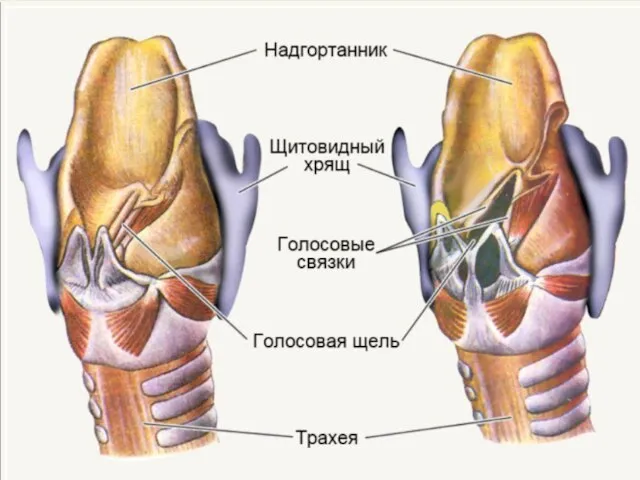 Как формируется голос? Участие носовой и ротовой полости в формировании речи (3)
Как формируется голос? Участие носовой и ротовой полости в формировании речи (3) Растения на поверхности аквариума
Растения на поверхности аквариума Для чего нужен витамин К человеку ?
Для чего нужен витамин К человеку ? Лечебно-диагностический процесс как система
Лечебно-диагностический процесс как система Вегетативная нервная система
Вегетативная нервная система Насекомые леса
Насекомые леса Части тела
Части тела Море и морские обитатели
Море и морские обитатели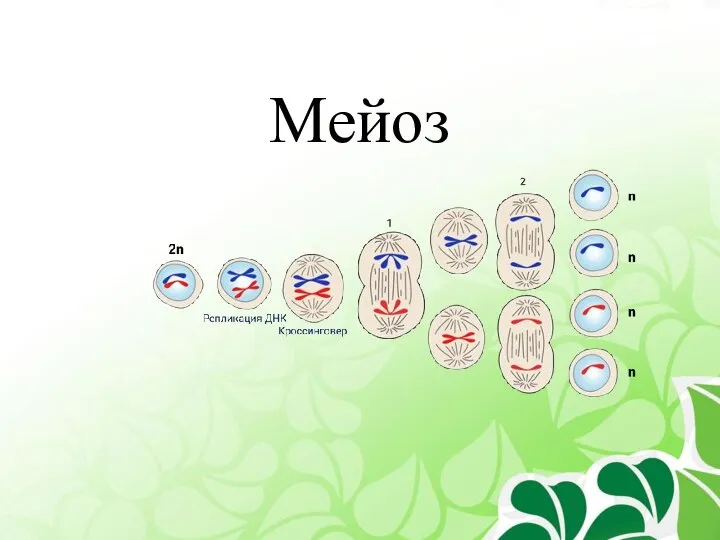 Мейоз
Мейоз