Первичная структура белка. Зависимость биологических свойств белков от первичной структуры. Вторичная структура белка
Содержание
- 2. При всем разнообразии функций, реализация функции белков всегда базируется на высоко специфическом — как у ключа
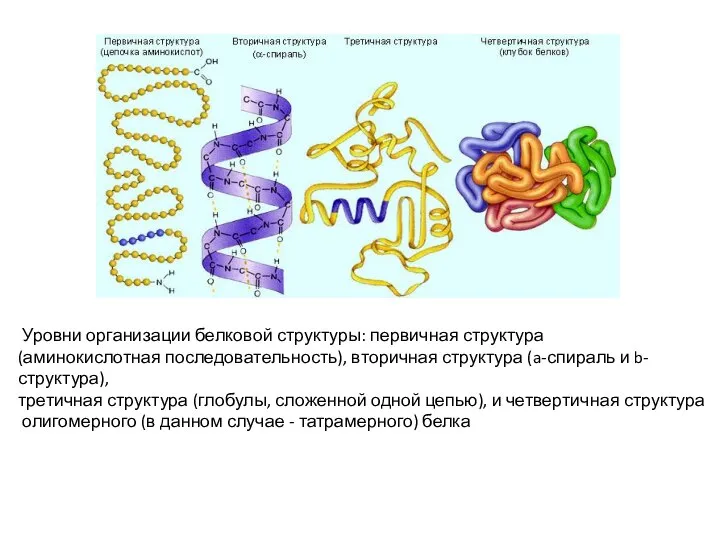
- 3. Уровни организации белковой структуры: первичная структура (аминокислотная последовательность), вторичная структура (a-спираль и b-структура), третичная структура (глобулы,
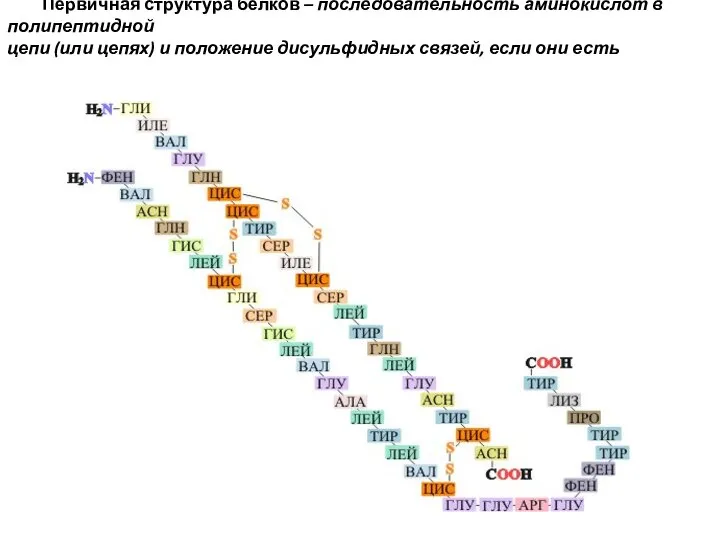
- 4. Первичная структура белков – последовательность аминокислот в полипептидной цепи (или цепях) и положение дисульфидных связей, если
- 5. Свойства первичной структуры: 1) Последовательность аминокислот в первичной структуре белка является специфической видовой характеристикой данного белка.
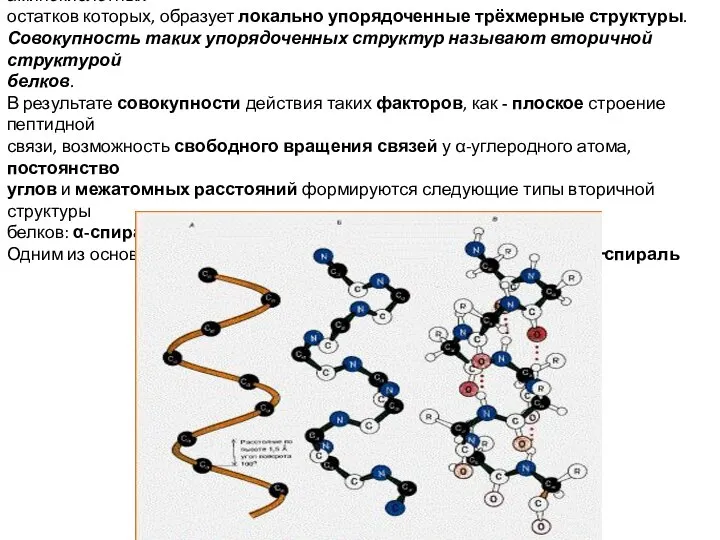
- 6. Часто в полипептидных цепях содержатся участки, последовательность аминокислотных остатков которых, образует локально упорядоченные трёхмерные структуры. Совокупность
- 7. Это — правая спираль, которую можно себе представить в виде пептидной цепи, закрученной вокруг воображаемого цилиндра.
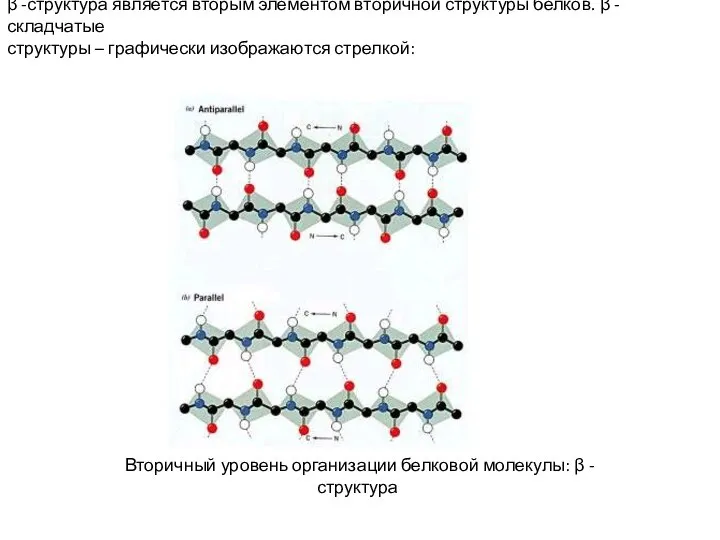
- 8. β -структура является вторым элементом вторичной структуры белков. β -складчатые структуры – графически изображаются стрелкой: Вторичный
- 9. Характеристика β-структуры: - остов полипептидной цепи в β-структуре вытянут таким образом, что имеет уже не спиральную,
- 10. Соотношение между различными типами вторичных структур в составе белков варьирует в широких приделах, причём доля неупорядоченных
- 12. Скачать презентацию





 Презентация на тему Проблема происхождения жизни
Презентация на тему Проблема происхождения жизни  Организация сообществ у голых землекопов
Организация сообществ у голых землекопов Кожа
Кожа Комнатные растения и уход за ними
Комнатные растения и уход за ними Презентация на тему РЕЙТИНГ САМЫХ ОПАСНЫХ ЖИВОТНЫХ В МИРЕ
Презентация на тему РЕЙТИНГ САМЫХ ОПАСНЫХ ЖИВОТНЫХ В МИРЕ  Насекомые. Набор развивающих карточек для детей
Насекомые. Набор развивающих карточек для детей Дикие пушные хищные звери
Дикие пушные хищные звери Орудия труда кроманьонца. Антропогенез. Эволюция человека. Часть 9
Орудия труда кроманьонца. Антропогенез. Эволюция человека. Часть 9 Рибонуклеиновые кислоты
Рибонуклеиновые кислоты Орхидейные богомолы
Орхидейные богомолы Макроанатомия экстраокулярных мышц
Макроанатомия экстраокулярных мышц Папоротникообразные. 6 класс
Папоротникообразные. 6 класс Проект по биологии Живая и мёртвая вода. 6 класс
Проект по биологии Живая и мёртвая вода. 6 класс Окружающая среда
Окружающая среда Рисунки в чашках Петри
Рисунки в чашках Петри Бычий цепень. Микробиология
Бычий цепень. Микробиология Найбільша ящірка в світі
Найбільша ящірка в світі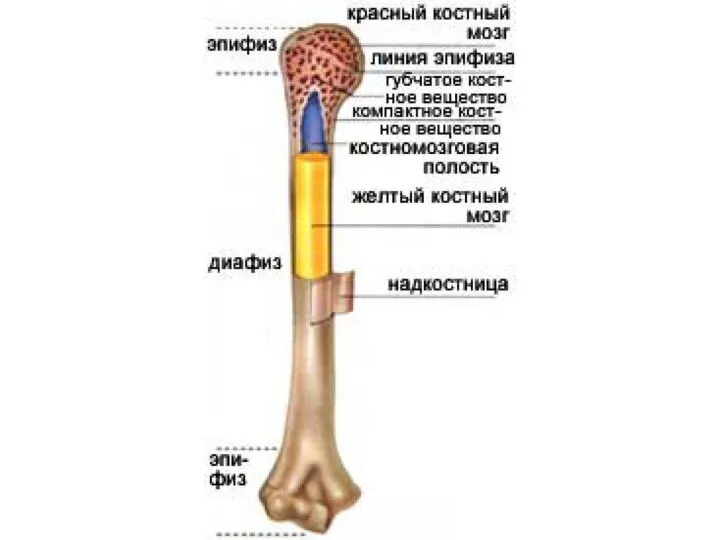 Опорно-двигательная система и кожа
Опорно-двигательная система и кожа Приспособления к паразитизму у животных разных типов
Приспособления к паразитизму у животных разных типов Путешествие по книге. Крестоцветные. Часть 1
Путешествие по книге. Крестоцветные. Часть 1 Брендбук. Хаски - центр У каменных ворот
Брендбук. Хаски - центр У каменных ворот Обмен белков и аминокислот
Обмен белков и аминокислот Питание живых организмов. Строение и функции листа. 7 класс
Питание живых организмов. Строение и функции листа. 7 класс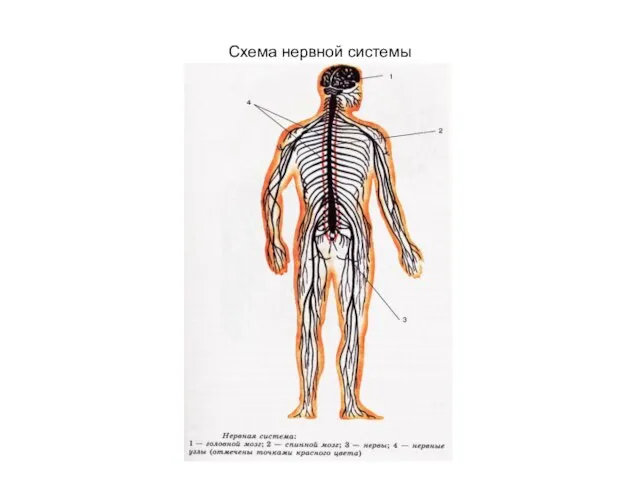 Схема нервной системы
Схема нервной системы Насекомые вредители на станции юных натуралистов г. Тайшета
Насекомые вредители на станции юных натуралистов г. Тайшета Формы иммуного ответа
Формы иммуного ответа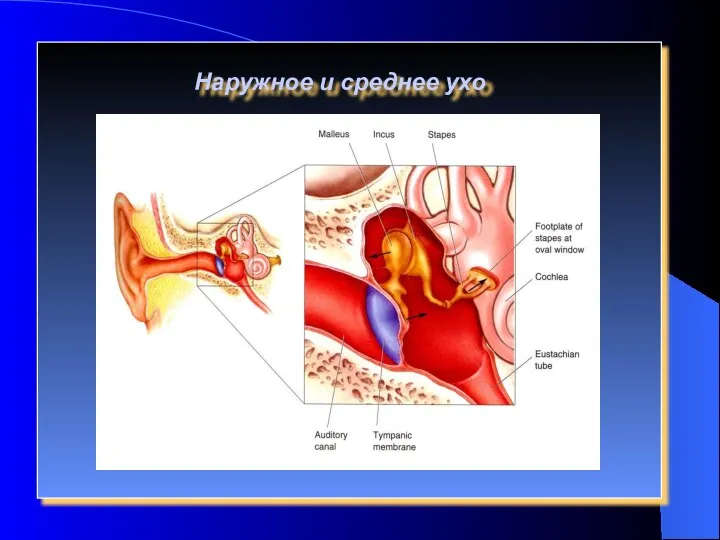 Слуховой анализатор
Слуховой анализатор Продолжительность жизни людей
Продолжительность жизни людей