Слайд 2 Обратимое
I связывается с E нековалентными связями → [IE] легко распадается, активность
![Обратимое I связывается с E нековалентными связями → [IE] легко распадается, активность E при этом восстанавливается](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1015099/slide-1.jpg)
E при этом восстанавливается
Слайд 3
Конкурентное (изостерическое)
I - структурный аналог S
I связывается с активным центром E

→ между I и S возникает конкуренция за активный центр
Слайд 4Пример конкурентного ингибирования – торможение сукцинатдегидрогеназы малоновой кислотой
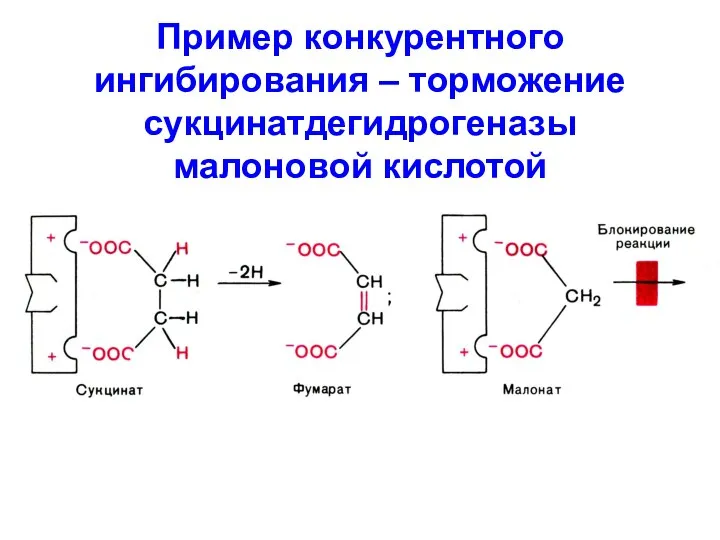
Слайд 5 Для устранения действия конкурентного I необходимо увеличить концентрацию S или удалить I

Слайд 6Конкурентное ингибирование (1 – без I, 2 – с I) графически выражается
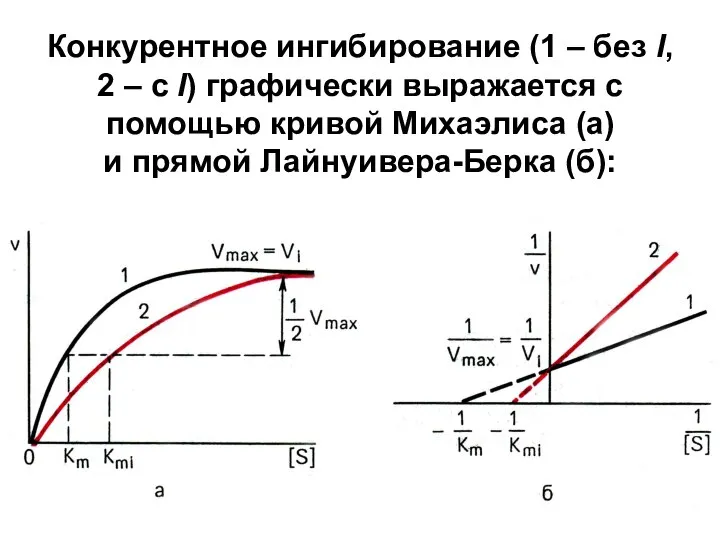
с помощью кривой Михаэлиса (а) и прямой Лайнуивера-Берка (б):
Слайд 7Т.о.,
в присутствии конкурентного I Vmax реакции не меняется, а Кm увеличивается →

сродство E к S уменьшается.
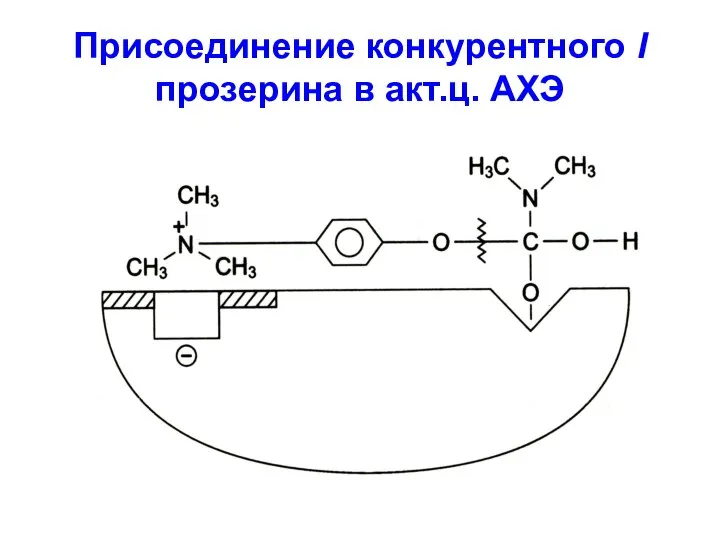
Слайд 8 На принципе конкурентного ингибирования основано действие многих ЛВ, например, группа ацетилхолинэстеразных препаратов,

являющихся конкурентными I АХЭ по отношению к S ацетилхолину: прозерин, физостигмин, эндофоний, севин и др.
Слайд 9Присоединение конкурентного I прозерина в акт.ц. АХЭ
Слайд 10 Необратимо действуют фосфоорганические препараты: армин, нибуфин, хлорофос, зарин, зоман, фосфорилируя каталитический участок

АХЭ
Слайд 11Сульфаниламид – структурный аналог парааминобензойной кислоты
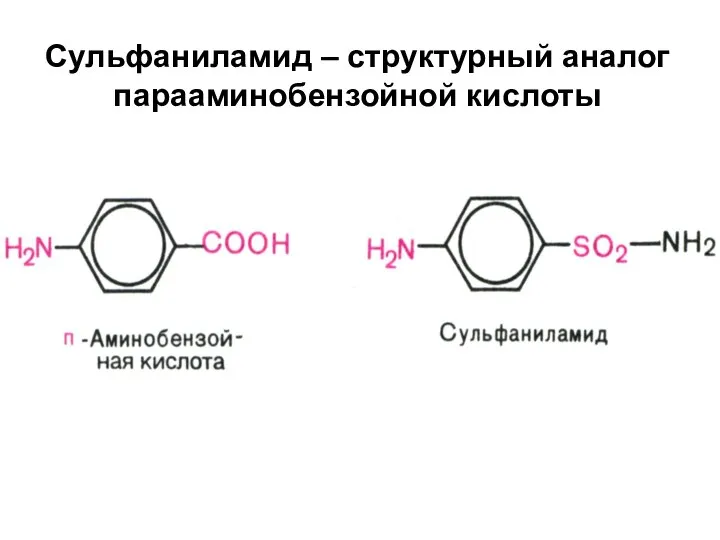
Слайд 12 Фолиевая кислота образуется в клетках бактерий, если они получают п-аминобензойную кислоту.
Сульфаниламиды

ингибируют Е, у которых при синтезе фолиевой кислоты используется п-аминобензойная кислота
Слайд 13 Эти Е могут использовать в качестве S сульфаниламиды → синтезируется не фолиевая

кислота, а ее аналог, не способный выполнять функции кофермента →
Слайд 14→ в бактериальных клетках возникает недостаток фолиевой кислоты, нарушаются все реакции, в

которых она участвует, и размножение бактерий становится невозможным
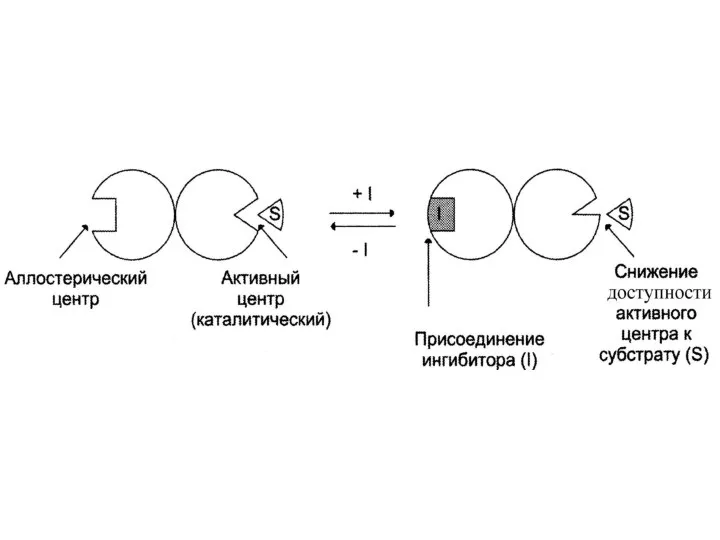
Слайд 15Неконкурентное (аллостерическое)
Это такое ингибирование, при котором I взаимодействует с Е не в

активном центре (А), а в аллостерическом (R).
Связывание I с R приводит к изменению конформации А и ↓ способности связываться с S.
Слайд 17Неконкурентное ингибирование (1 – без I, 2 – с I) графически выражается
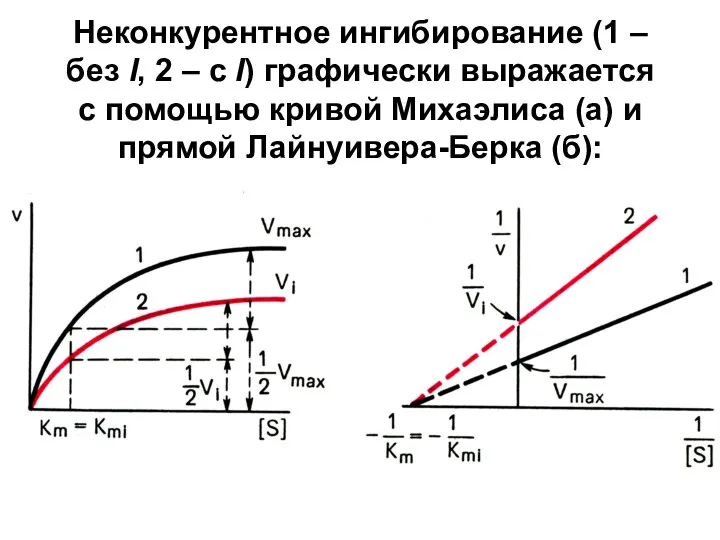
с помощью кривой Михаэлиса (а) и прямой Лайнуивера-Берка (б):
Слайд 18Т.о.
под действием неконкурентного I Vmax уменьшается, а Кm не изменяется → сродство

E к S остается без изменений
Слайд 19 В роли регуляторов V ферментативных реакций наиболее часто выступают: гормоны, медиаторы, ионы

металлов, коферменты, различные метаболиты и т.д.
Ингибиторами аллостерических ферментов являются часто конечные продукты (Р), а исходные (S) активаторами.
Слайд 21
Активаторы ферментов
1. Ионы
K+, Na+, Mg2+, Mn2+, Co2+, Zn2+, Fe2+, Cl-, SO42-,

PO43- и др.
Механизм их действия:
способствуют стабилизации А;
участвуют в образовании мостика между E и S.
Слайд 22 2. Специфические агенты (н-р, HCl) и другие ферменты
Регуляция сводится к превращению проферментов

(неактивных предшественников Е) в активные Е под влиянием специфических агентов или других ферментов-протеиназ.
Слайд 23Н-р, пепсиноген превращается в пепсин в результате ограниченного протеолиза:
под действием HCl отщепляется

пептид, который затрудняет доступ S к A профермента → E переходит в активную форму - пепсин, к-рый действуя на пепсиноген, делает то же самое, но с большей скоростью (аутокатализ).
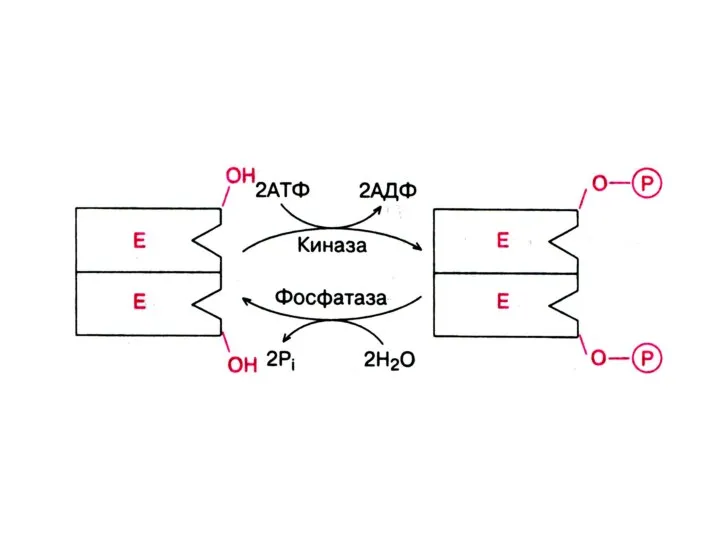
Слайд 24Активность некоторых Е может регулироваться с помощью химической модификации, н-р, путем фосфорилирования-дефорилирования:

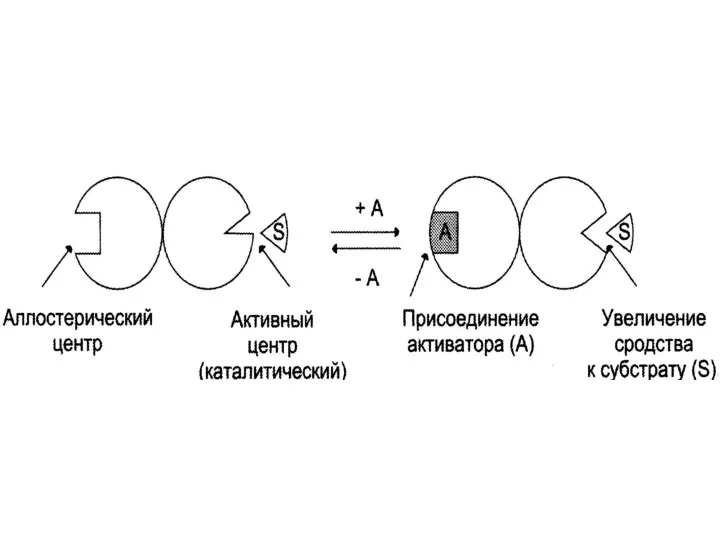
Слайд 263. Аллостерические активаторы
Связываются с R, в результате чего конформация E изменяется

т.о., что она оптимально соответствует структуре S
Слайд 28 4. Активаторы, способствующие объединению неактивных субъединиц E в активный надмолекулярный комплекс, имеющий

четвертичную структуру
Слайд 29
Изоферменты
Это различные молекулярные формы одного и того же фермента, катализирующие одну и

ту же реакцию, отличающиеся вследствие генетических различий особенностями строения и физико-химическими свойствами (первичной структурой, электрофоретической подвижностью, Кm, локализацией в клетке).
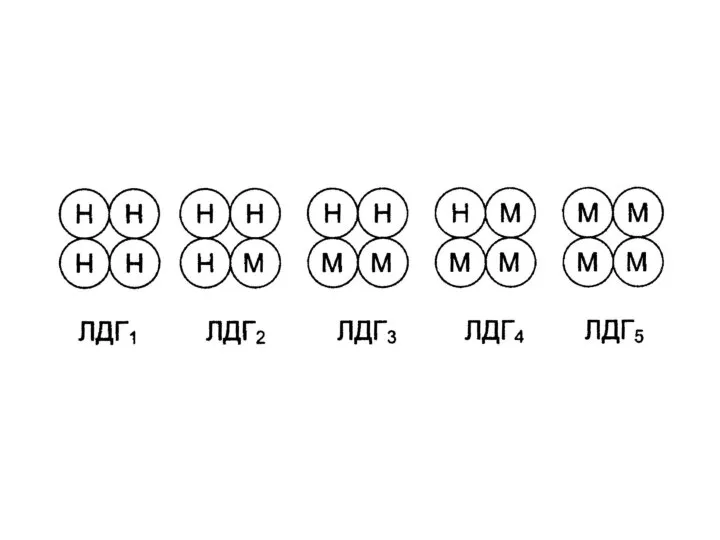
Слайд 30 Например, лактатдегидрогеназа (ЛДГ) имеет четвертичную структуру, содержит 2 типа субъединиц М и

H (от heart - сердце). Путем комбинации этих двух субъединиц образуются 5 изоформ ЛДГ:
Слайд 31ЛДГ1 – НННН (Н4)
ЛДГ2 – НННМ (Н3М)
ЛДГ3 – ННММ (Н2М2)
ЛДГ4 – НМММ
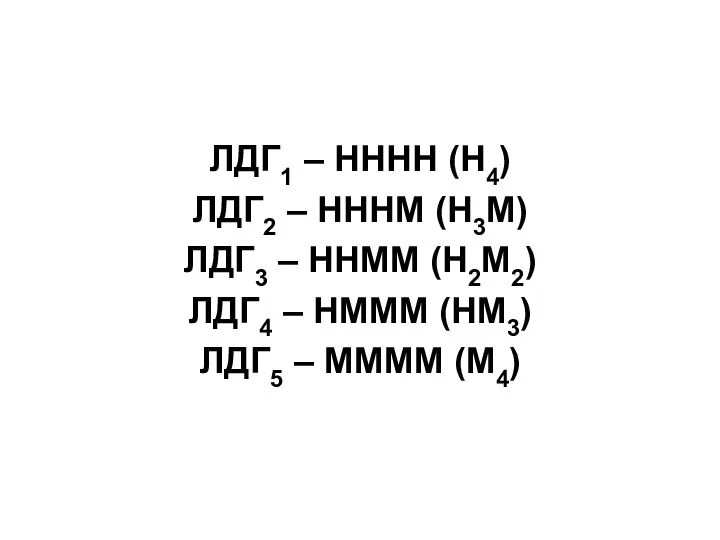
(НМ3)
ЛДГ5 – ММММ (М4)
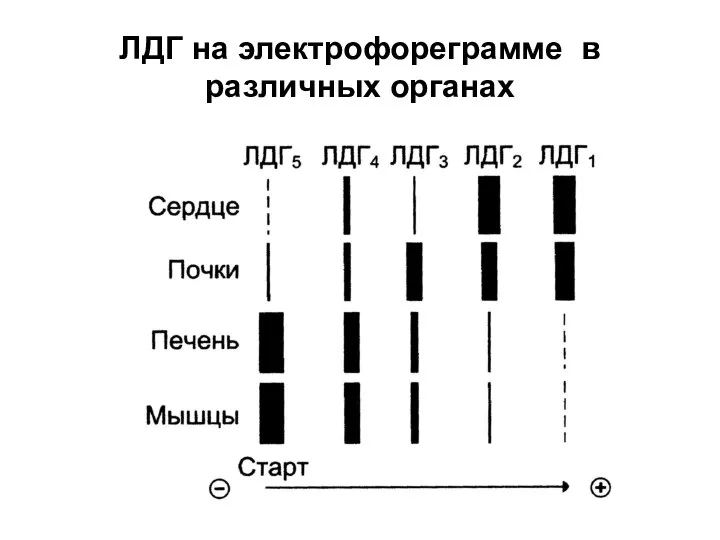
Слайд 33ЛДГ на электрофореграмме в различных органах
Слайд 34Мультиэнзимные комплексы (МЭК) -
надмолекулярные ферментативные системы, состоящие из различных Е, катализирующих последовательные

этапы одного метаболического пути. Отдельные компоненты этих комплексов связаны между собой и функционируют только совместно.
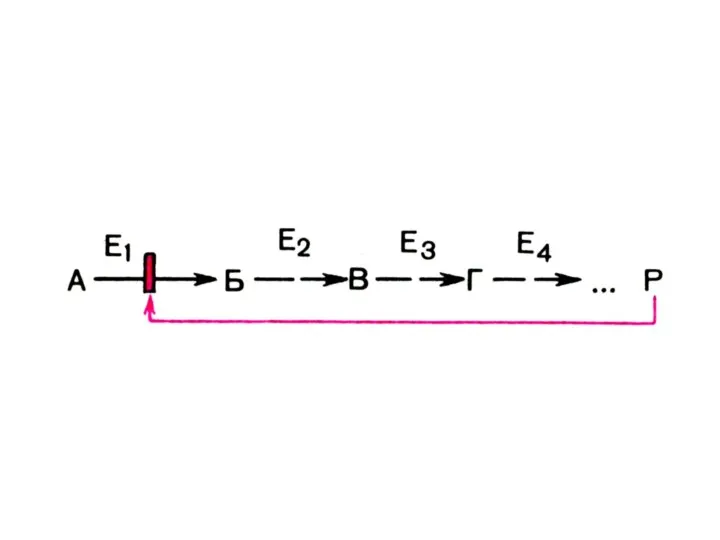
Слайд 35т.е.
МЭК – это группа Е, катализирующая последовательное превращение S:
А → В →
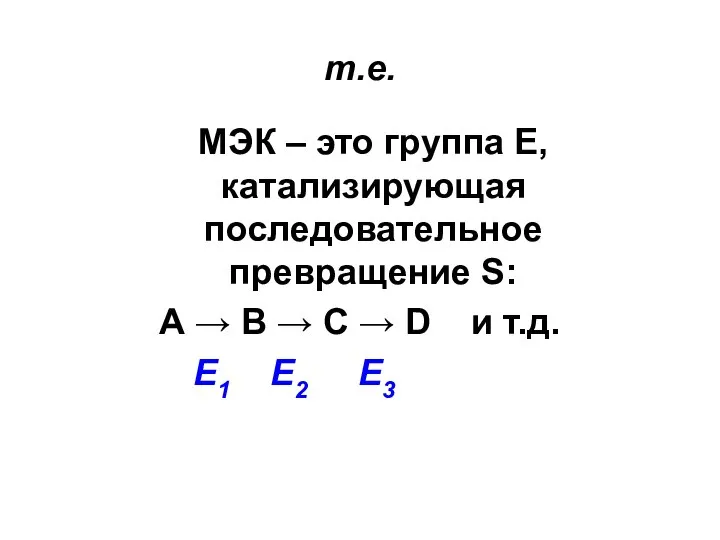
С → D и т.д.
Е1 Е2 Е3
Слайд 36 Существует несколько видов МЭК, в основе организации которых лежит единство:
1 – функциональное
2

– структурно-функциональное
3 – смешанный тип
Слайд 371
Отдельные Е объединены в полиферментную систему. Н-р, гликолиз: S1 → P1(S2) →

P2 (S3) →... → P
Е1 Е2 Е11
Каждая реакция катализируется отдельным Е и каждый из P является S следующего Е
Слайд 382
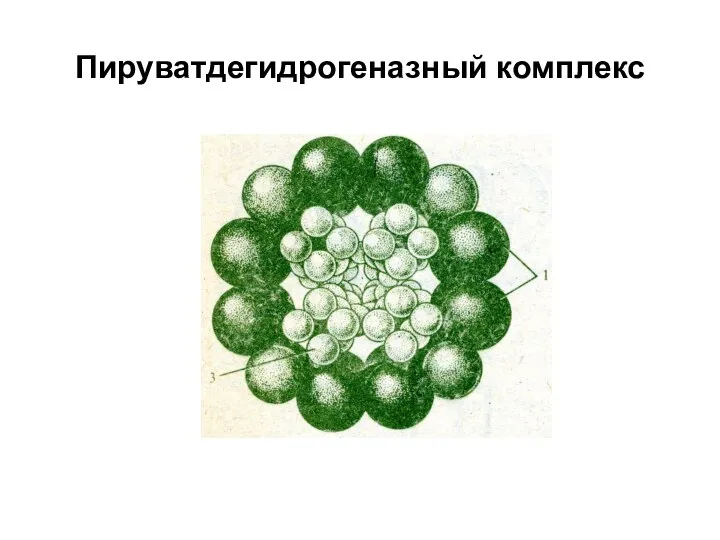
Е образуют структурные системы с определенной функцией при помощи Е-Е взаимодействий. Н-р,

полиферментный комплекс – пируватдегидрогеназа, состоящий из 3-х E и 5 коферментов, участвующих в окислении ПВК
Слайд 40синтетаза высших жирных кислот, состоящая из 7 структурно связанных Е, в целом

выполняющих общую функцию – синтез жирных кислот.
Слайд 413
Представляет комбинацию обоих типов организации. Н-р, цикл Кребса, в котором часть Е

объединена в α-кетоглутаратдегидрогеназный комплекс (2), а другая часть соединена функционально (1)
Слайд 42Биологическое значение
Образуется «молекулярный конвейер», благодаря которому:
значительно сокращается расстояние, на которое переносятся

субстраты;
Е работают более согласованно;
облегчается регуляция Е;
значительно экономится энергия.
Слайд 43Медицинская энзимология
Энзимопатология
Энзимодиагностика
Энзимотерапия

Слайд 44Энзимопатология изучает наследственные или приобретенные дефекты ферментных систем – энзимопатии. Различают энзимопатии:

1 – первичные (наследственные)
2 – вторичные (приобретенные), наблюдающиеяся при всех болезнях
Слайд 45Н-р, 1:
Фенилкетонурия – заболевание, при котором отсутствует Е гидроксилаза, превращающая фенилаланин в

тирозин. В результате накапливается фен и продукты его метаболизма, повреждающие нервную систему новорожденного ребенка → олигофрения (слабоумие)
Слайд 46Энзимодиагностика заключается в постановке диагноза заболевания на основе определения активности Е в

биологических жидкостях
Слайд 47Например:
При инфаркте миокарда увеличивается содержание ферментов ЛДГ1 и ЛДГ2, аспартатаминотрансферазы.
При вирусном гепатите

увеличивается содержание ЛДГ4 и ЛДГ5
Слайд 48Энзимотерапия – использование ферментов в качестве лекарственных средств.
Имеет много ограничений вследствие

высокой иммуногенности ферментов.
Слайд 49Имеет следующие направления:
Заместительная терапия – использование ферментов в качестве лечебных препаратов в

случае их недостаточности (пепсин, панкреатин)
Слайд 50Использование в качестве дополнительных терапевтических средств
(н-р, различные гидролитические ферменты для ускорения

заживления ран – пепсин, трипсин, ДНК-азы, РНК-азы, гиалуронидазы)
Слайд 51
Трудности в использовании ферментов:
нестабильность
антигенные свойства
практически невозможность доставки к клеткам-мишеням

Слайд 52Для увеличения стабильности Е их связывают с различными инертными носителями (целлюлоза, крахмал).
Для

снижения антигенных свойств используют микрокапсулы (н-р, липосомы), тени эритроцитов (эритроцитарные молекулы без содержимого)
Слайд 53Для направленного действия Е на мишень, на поверхности микрокапсулы прикрепляют векторную молекулу

антитела, которое взаимодействует только со специфическим антигеном на поверхности клетки-мишени
Слайд 54Ферменты широко используются для определения содержания различных веществ в биологических жидкостях
Н-р, с

помощью иммуноферментного анализа (ИФА)
![Обратимое I связывается с E нековалентными связями → [IE] легко распадается, активность E при этом восстанавливается](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1015099/slide-1.jpg)
























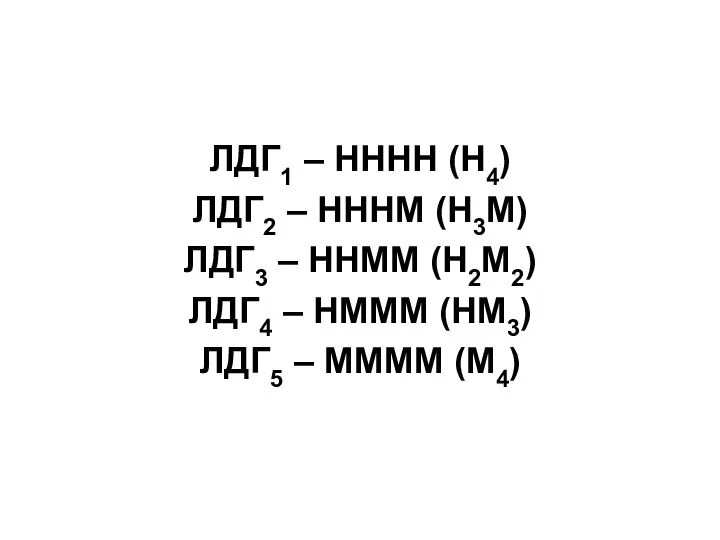





















 Презентация на тему Доказательства происхождения человека
Презентация на тему Доказательства происхождения человека  Механические ткани
Механические ткани Видоизменения корней растений
Видоизменения корней растений Тип аннелиды или кольчатые черви
Тип аннелиды или кольчатые черви Биологическая изменчивость людей в связи с биогеографическими особенностями среды. Формирование адаптивных экотипов людей
Биологическая изменчивость людей в связи с биогеографическими особенностями среды. Формирование адаптивных экотипов людей Строение зрительного анализатора
Строение зрительного анализатора Паразитизм
Паразитизм Основные методы селекции и биотехнологии. 11 класс
Основные методы селекции и биотехнологии. 11 класс Презентация на тему ШЛЯПОЧНЫЕ ГРИБЫ
Презентация на тему ШЛЯПОЧНЫЕ ГРИБЫ  Иммунитет. Иммунная система человека
Иммунитет. Иммунная система человека Этиология и патогенез. Стресс. Общий адаптационный синдром. Лекция №2
Этиология и патогенез. Стресс. Общий адаптационный синдром. Лекция №2 Тренировочный тест. Черви
Тренировочный тест. Черви Строение и функции головного мозга
Строение и функции головного мозга Вірусні захворювання рослин
Вірусні захворювання рослин Микрофлора тела здорового человека. Дисбактериоз
Микрофлора тела здорового человека. Дисбактериоз Онтогенез – процесс индивидуального развития особи от момента образования зиготы до конца жизни организма
Онтогенез – процесс индивидуального развития особи от момента образования зиготы до конца жизни организма Пресмыкающиеся - обитатели леса
Пресмыкающиеся - обитатели леса Гуморальная регуляция жизнедеятельности организмов
Гуморальная регуляция жизнедеятельности организмов Клиническое обоснование строения органа зрения
Клиническое обоснование строения органа зрения Воздушное питание растений. Фотосинтез
Воздушное питание растений. Фотосинтез Одуванчик
Одуванчик Грибы
Грибы Презентация на тему Репликация ДНК
Презентация на тему Репликация ДНК  Животные жарких стран
Животные жарких стран Окружающий мир’мир
Окружающий мир’мир Строение глаза
Строение глаза Динамика макромолекул
Динамика макромолекул Надкласс Рыбы. Класс Костные рыбы
Надкласс Рыбы. Класс Костные рыбы