Секреторная активность мезенхимных стромальных клеток жировой ткани человека в стимуляции роста кровеносных сосудов
Содержание
- 2. Актуальность работы: Достигнутый за последние несколько лет мировым научным сообществом прогресс отражается в активном внедрении в
- 3. Цель работы: оценить содержание ангиогенных факторов в среде культивирования и внеклеточных везикулах, продуцируемых МСК
- 4. Задачи: Выделение и культивирование человеческих ЖТ-МСК; Получение фракций внеклеточных везикул и белков в свободной форме ;
- 5. Методы: Выделение МСК из жировой ткани человека; Культивирование МСК; Иммунофенотипирование популяции МСК с помощью проточной цитофлуориметрии;
- 6. Культура: human ADSC (adipose tissue-derived stem cells) МСК-ЖТ человека (мезенхимальные стромальные клетки жировой ткани) Среда культивирования:
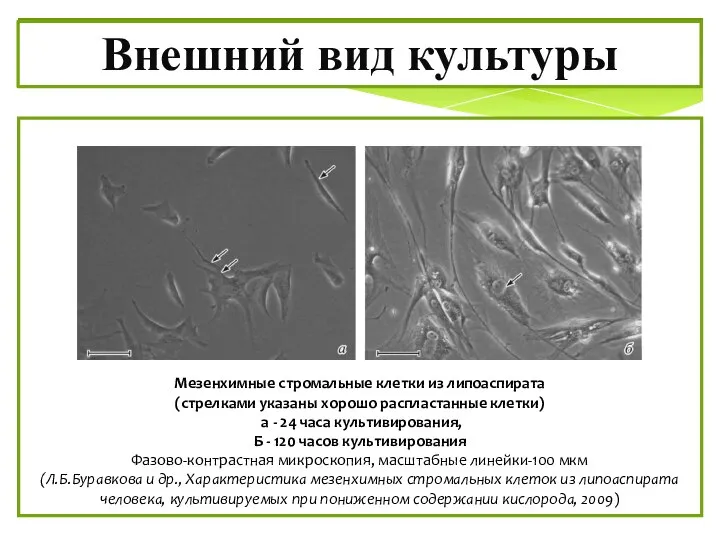
- 7. Мезенхимные стромальные клетки из липоаспирата (стрелками указаны хорошо распластанные клетки) а - 24 часа культивирования, Б
- 8. Нуклеофекция Образцы: 1 - отрицательный контроль (Ambion, Pre-miR, Negative control #1) 2 - miR-92a (Ambion, Pre-miR,
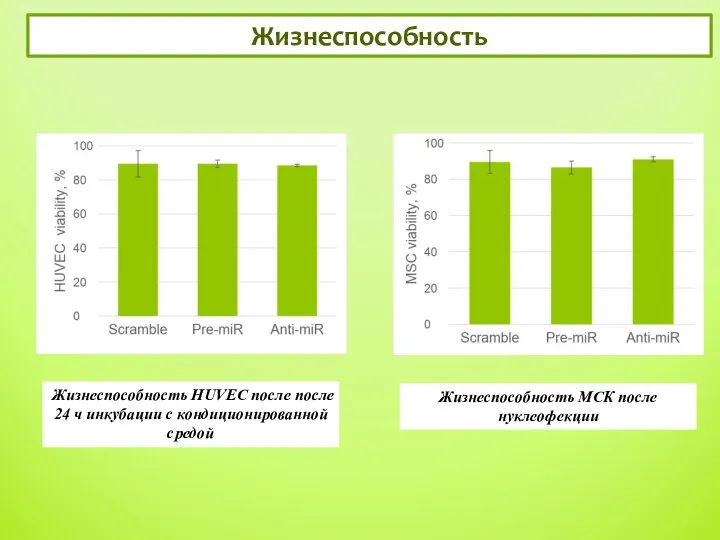
- 9. Жизнеспособность 5 Жизнеспособность МСК после нуклеофекции Жизнеспособность HUVEC после после 24 ч инкубации с кондиционированной средой
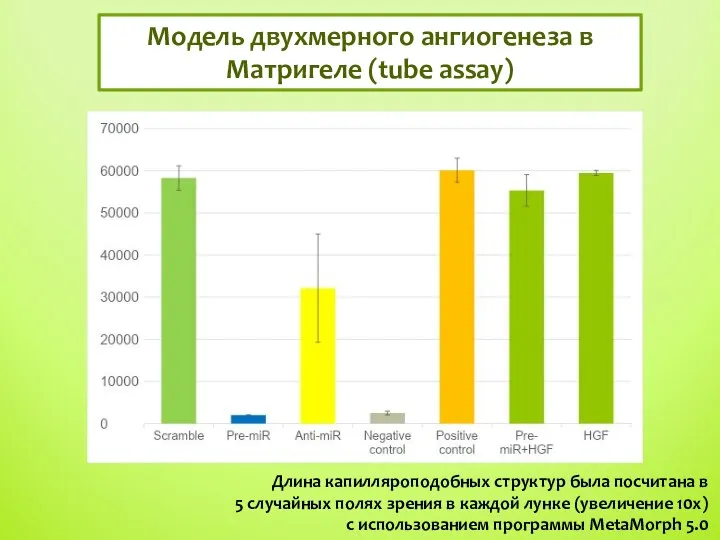
- 10. Модель двухмерного ангиогенеза в Матригеле (tube assay) Длина капилляроподобных структур была посчитана в 5 случайных полях
- 11. Модель двухмерного ангиогенеза в Матригеле (tube asssay) Позитивный контроль Негативный контроль Pre-miRNA Anti-miRNA 100µm 100µm 100µm
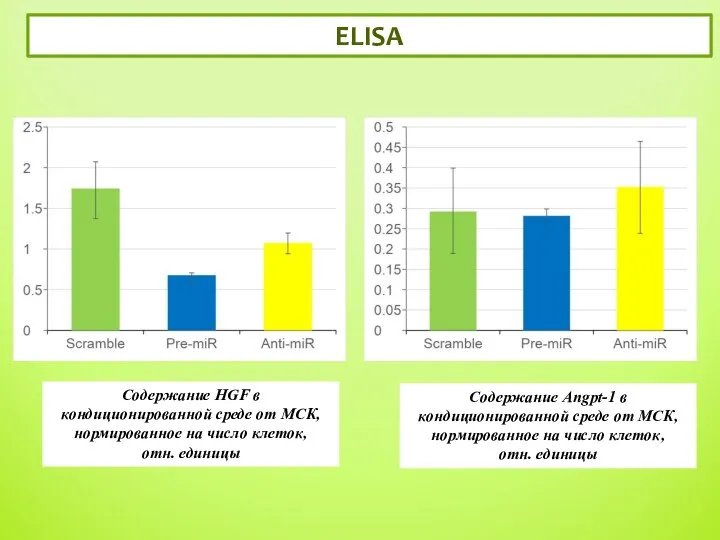
- 12. ELISA 5 Содержание Angpt-1 в кондиционированной среде от МСК, нормированное на число клеток, отн. единицы Содержание
- 13. Модель трёхмерного ангиогенеза в фибриновом геле (fibrin bead assay) Схема эксперимента 2 день культивирования, начало образования
- 15. Скачать презентацию








 Сова. Аппликация
Сова. Аппликация Обработка протеомных данных (массспектрометрия)
Обработка протеомных данных (массспектрометрия) Среда обитания
Среда обитания Хемиосмотическая теория Митчелла
Хемиосмотическая теория Митчелла Методы исследования в биологии
Методы исследования в биологии Методы стерилизации в микробиологии
Методы стерилизации в микробиологии Використання тваринами знарядь праці
Використання тваринами знарядь праці Жизненный цикл клетки. Митоз
Жизненный цикл клетки. Митоз Цитология – наука о клетке. История открытия и изучения клетки. Клеточная теория
Цитология – наука о клетке. История открытия и изучения клетки. Клеточная теория Презентация на тему "Голосеменные. Классификация" - презентации по Биологии
Презентация на тему "Голосеменные. Классификация" - презентации по Биологии Протерозойская эра
Протерозойская эра Зимующие птицы
Зимующие птицы Северный олень
Северный олень Строение органов дыхания
Строение органов дыхания Пищеварение в тонкой кишке
Пищеварение в тонкой кишке Презентация на тему Развитие жизни на Земле
Презентация на тему Развитие жизни на Земле  Побег. Строение и значение побега
Побег. Строение и значение побега Презентация на тему Лекарственные растения Ростовской Области
Презентация на тему Лекарственные растения Ростовской Области  Грибы, цветы и ягоды леса
Грибы, цветы и ягоды леса Скаты
Скаты Курс ботаники. Тема: Систематика покрытосемянных
Курс ботаники. Тема: Систематика покрытосемянных lektsia_4_Nasledstvennost_Mendel_Morgan
lektsia_4_Nasledstvennost_Mendel_Morgan Reptiles: eublefars
Reptiles: eublefars Презентация на тему Миграции животных
Презентация на тему Миграции животных  Веселая биология. Загадки
Веселая биология. Загадки Морфология
Морфология Органы чувств человека
Органы чувств человека В царстве грибов
В царстве грибов