Содержание
- 2. Секреторная мембранная система В клетках эукариот белки, предназначенные для выведения из клетки, для внутриклеточного использования (гидролитические
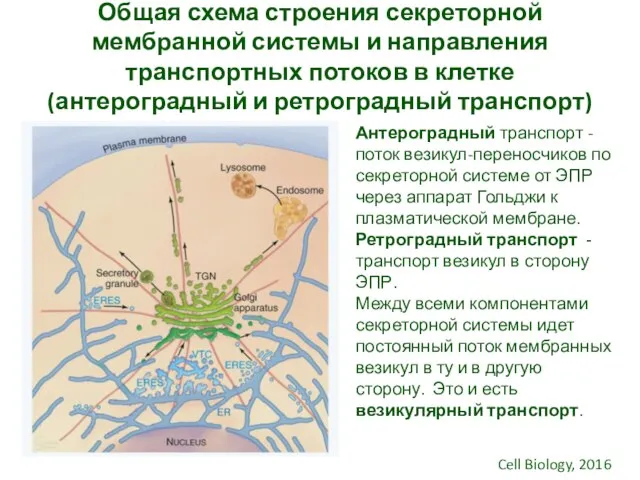
- 3. Общая схема строения секреторной мембранной системы и направления транспортных потоков в клетке (антероградный и ретроградный транспорт)
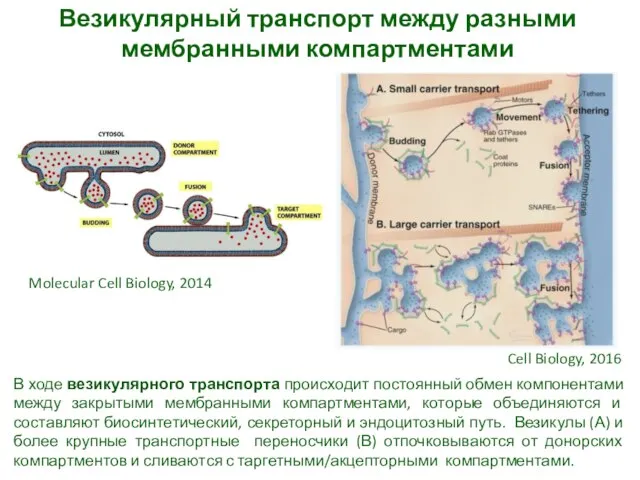
- 4. Везикулярный транспорт между разными мембранными компартментами В ходе везикулярного транспорта происходит постоянный обмен компонентами между закрытыми
- 5. Нобелевскую премию по медицине в 2013 году присудили за исследования, посвященные механизмам везикулярного транспорта. Джеймс Ротман,
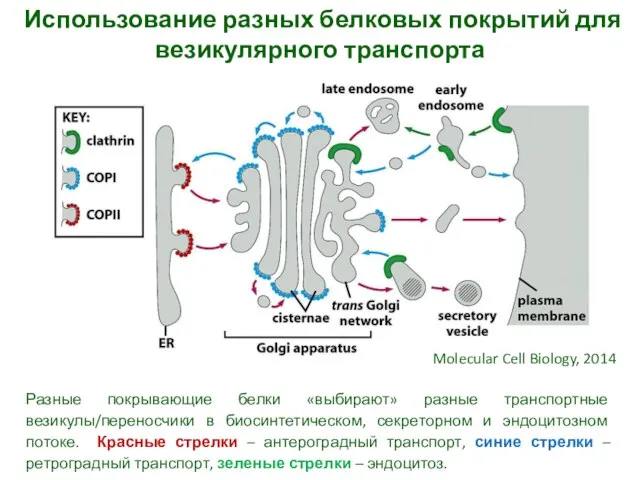
- 6. Использование разных белковых покрытий для везикулярного транспорта Разные покрывающие белки «выбирают» разные транспортные везикулы/переносчики в биосинтетическом,
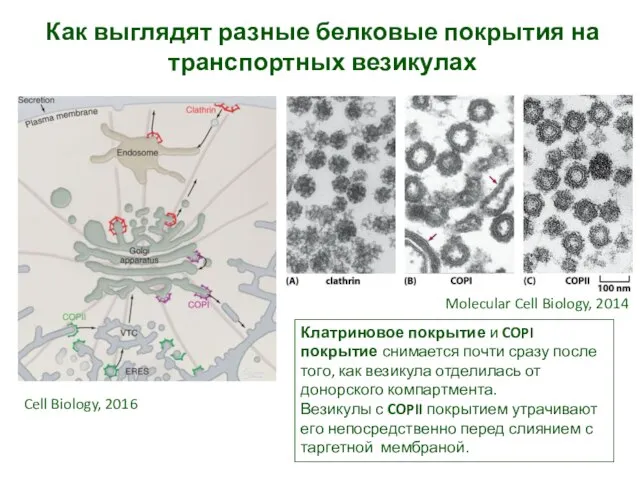
- 7. Как выглядят разные белковые покрытия на транспортных везикулах Molecular Cell Biology, 2014 Cell Biology, 2016 Клатриновое
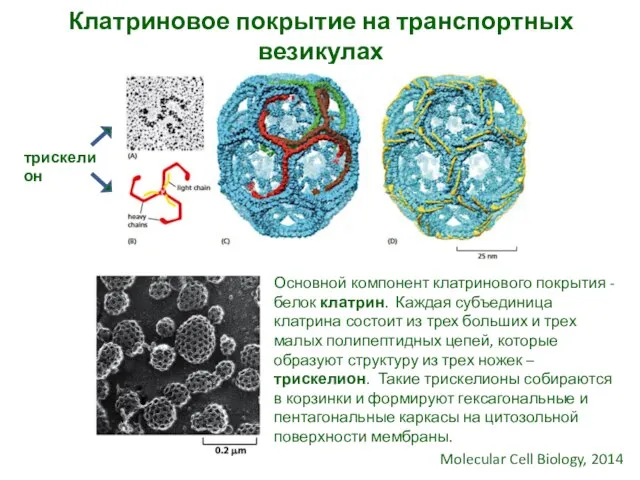
- 8. Клатриновое покрытие на транспортных везикулах Molecular Cell Biology, 2014 Основной компонент клатринового покрытия - белок клатрин.
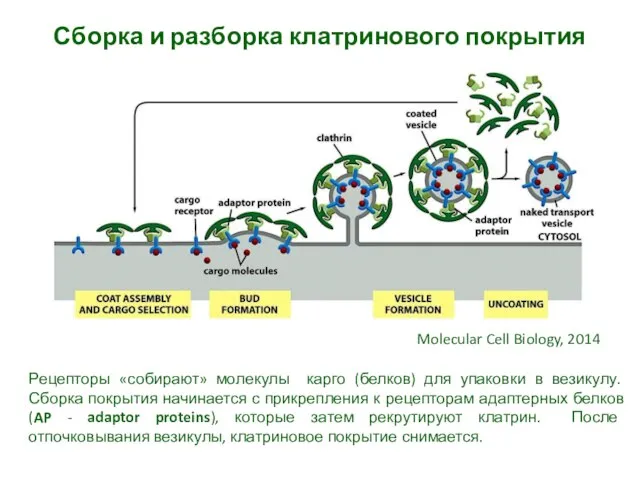
- 9. Сборка и разборка клатринового покрытия Рецепторы «собирают» молекулы карго (белков) для упаковки в везикулу. Сборка покрытия
- 10. Сборка клатринового, COPI и COPII покрытий нужна для сортировки рецепторов, связанных с карго, и контролируется белками
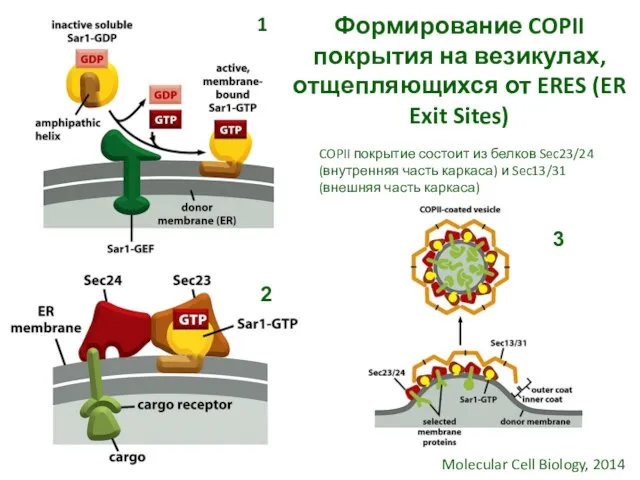
- 11. Формирование COPII покрытия на везикулах, отщепляющихся от ERES (ER Exit Sites) Molecular Cell Biology, 2014 1
- 12. При образовании везикул-переносчиков, на донорских мембранах собирается белковое покрытие из клатрина, COPI или COPII, которое сортирует
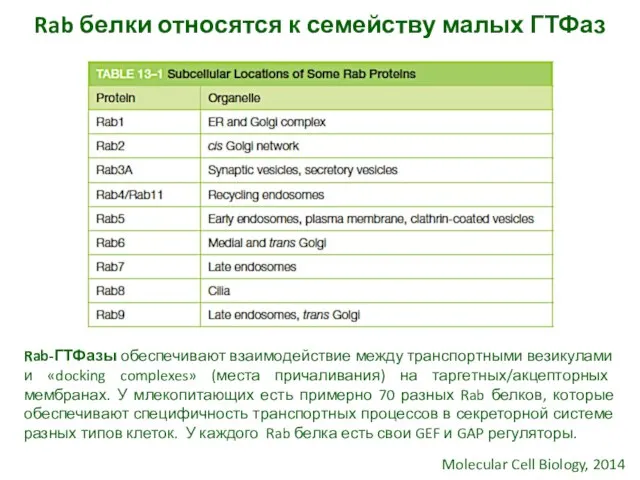
- 13. Rab белки относятся к семейству малых ГТФаз Rab-ГТФазы обеспечивают взаимодействие между транспортными везикулами и «docking complexes»
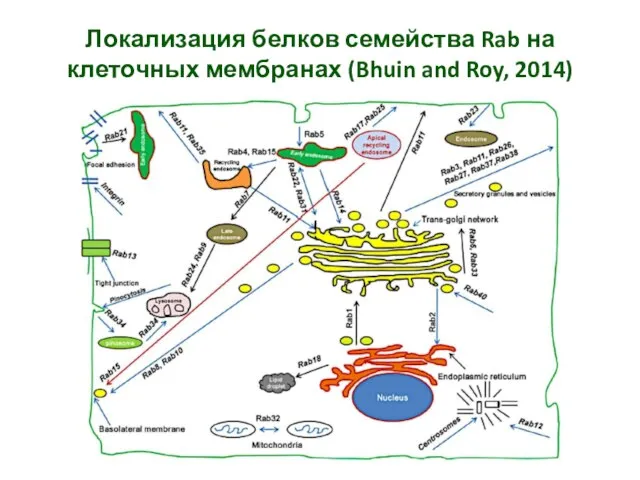
- 14. Локализация белков семейства Rab на клеточных мембранах (Bhuin and Roy, 2014)
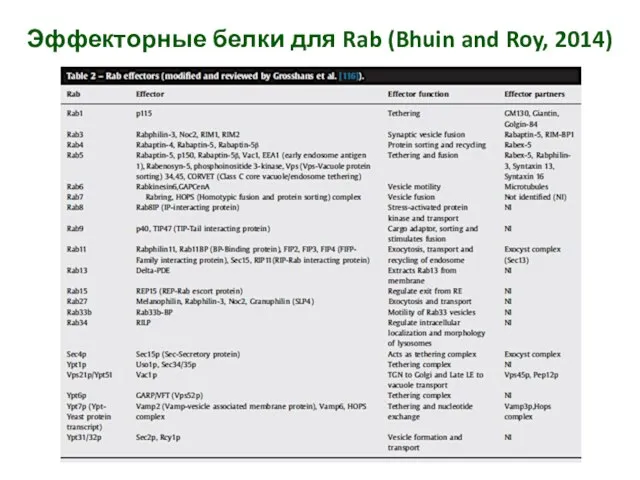
- 15. Эффекторные белки для Rab (Bhuin and Roy, 2014)
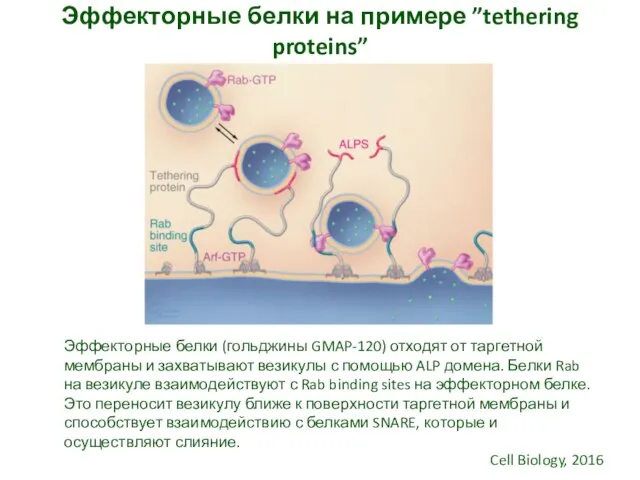
- 16. Эффекторные белки на примере ”tethering proteins” Эффекторные белки (гольджины GMAP-120) отходят от таргетной мембраны и захватывают
- 17. Непосредственное слияние мембран катализируется белками семейства SNARE В функциональном плане SNARE белки существуют в виде комплементарных
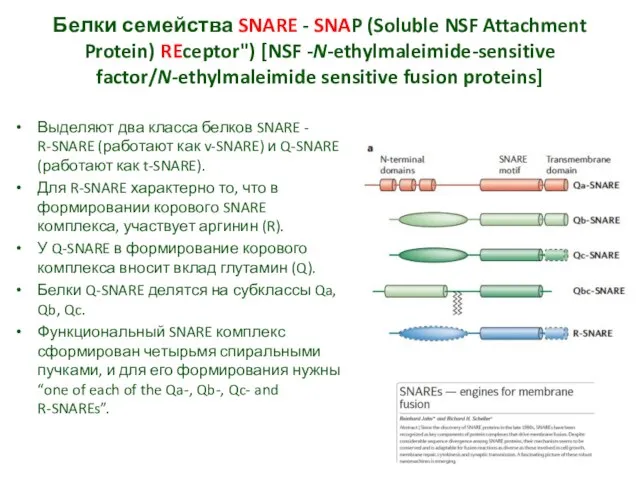
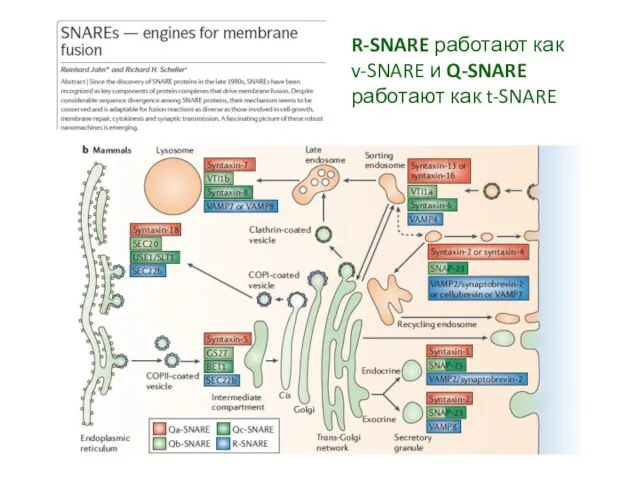
- 18. Белки семейства SNARE - SNAP (Soluble NSF Attachment Protein) REceptor") [NSF -N-ethylmaleimide-sensitive factor/N-ethylmaleimide sensitive fusion proteins]
- 19. R-SNARE работают как v-SNARE и Q-SNARE работают как t-SNARE
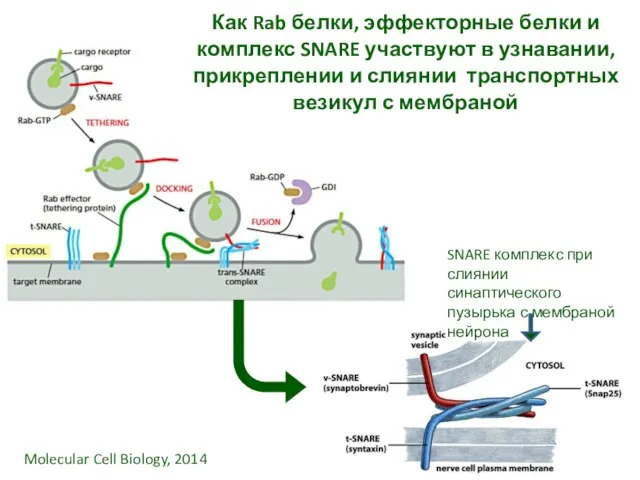
- 20. Как Rab белки, эффекторные белки и комплекс SNARE участвуют в узнавании, прикреплении и слиянии транспортных везикул
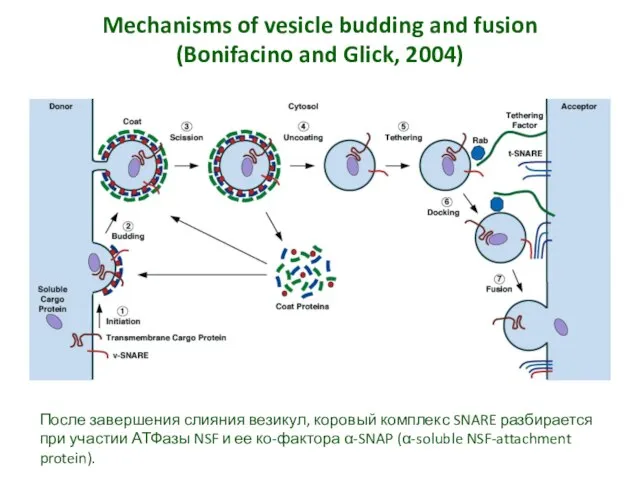
- 21. Mechanisms of vesicle budding and fusion (Bonifacino and Glick, 2004) После завершения слияния везикул, коровый комплекс
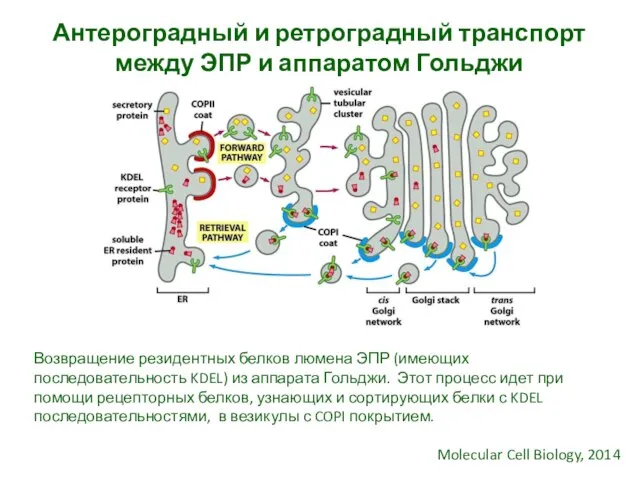
- 22. Антероградный и ретроградный транспорт между ЭПР и аппаратом Гольджи Molecular Cell Biology, 2014 Возвращение резидентных белков
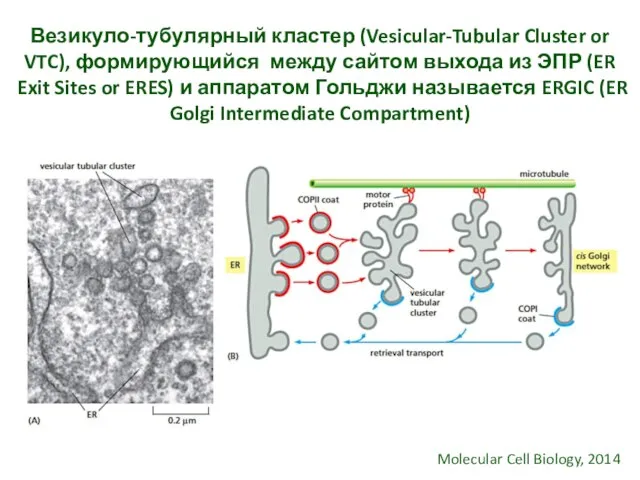
- 23. Везикуло-тубулярный кластер (Vesicular-Tubular Cluster or VTC), формирующийся между сайтом выхода из ЭПР (ER Exit Sites or
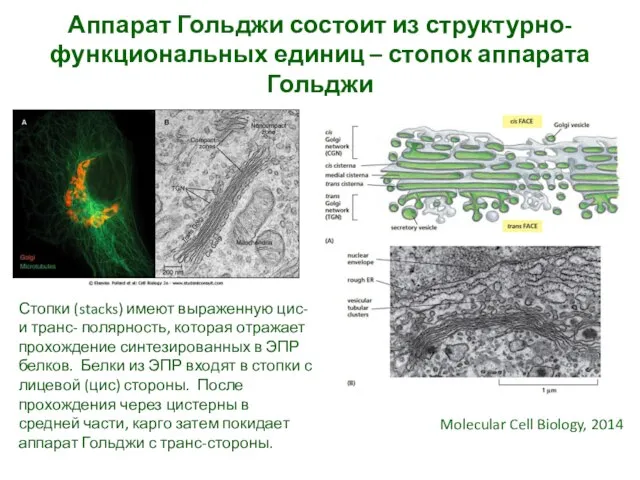
- 24. Аппарат Гольджи состоит из структурно-функциональных единиц – стопок аппарата Гольджи Molecular Cell Biology, 2014 Стопки (stacks)
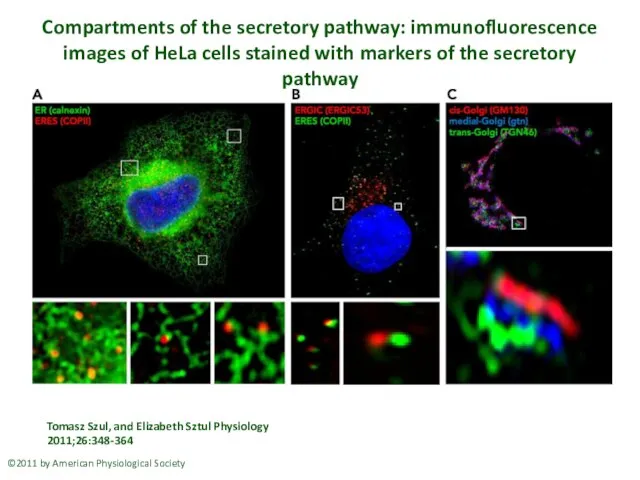
- 25. Compartments of the secretory pathway: immunofluorescence images of HeLa cells stained with markers of the secretory
- 26. Функции комплекса Гольджи 1) В комплексе Гольджи продолжается дальнейшая модификация/процессинг гликопротеидов (вторичное гликозилирование); соединение синтезированных олигосахаридов
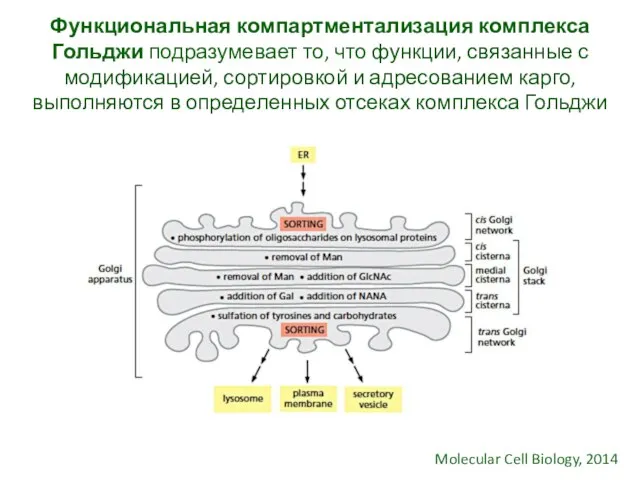
- 27. Функциональная компартментализация комплекса Гольджи подразумевает то, что функции, связанные с модификацией, сортировкой и адресованием карго, выполняются
- 28. ФУНКЦИИ АППАРАТА ГОЛЬДЖИ: 1. ПРОЦЕССИНГ ГЛИКОПРОТЕИДОВ (ВТОРИЧНОЕ ГЛИКОЗИЛИРОВАНИЕ) И СИНТЕЗ ПРОТЕОГЛИКАНОВ
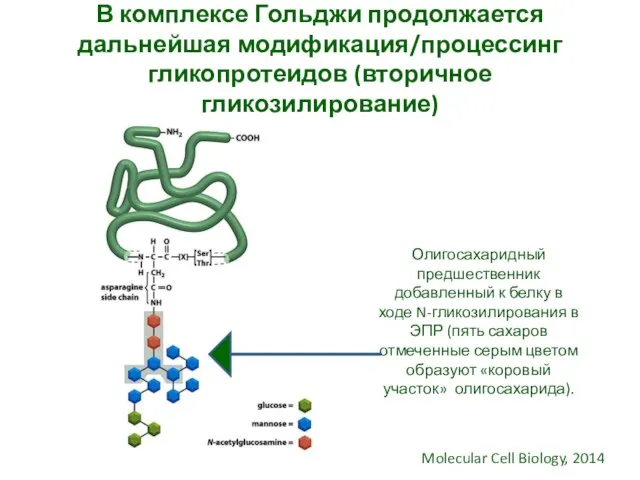
- 29. В комплексе Гольджи продолжается дальнейшая модификация/процессинг гликопротеидов (вторичное гликозилирование) Олигосахаридный предшественник добавленный к белку в ходе
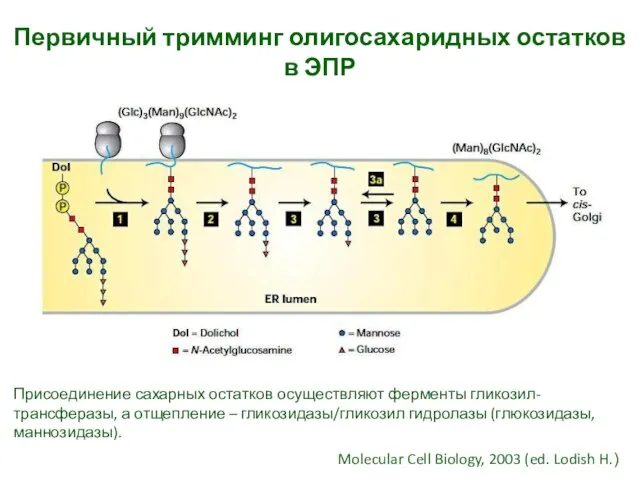
- 30. Первичный тримминг олигосахаридных остатков в ЭПР Molecular Cell Biology, 2003 (ed. Lodish H.) Присоединение сахарных остатков
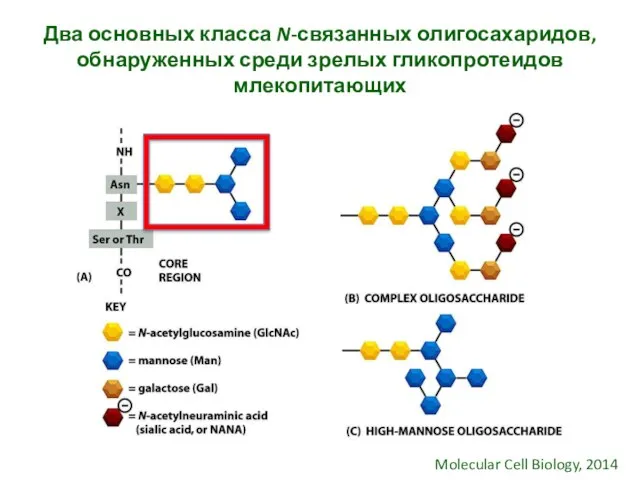
- 31. Два основных класса N-связанных олигосахаридов, обнаруженных среди зрелых гликопротеидов млекопитающих Molecular Cell Biology, 2014
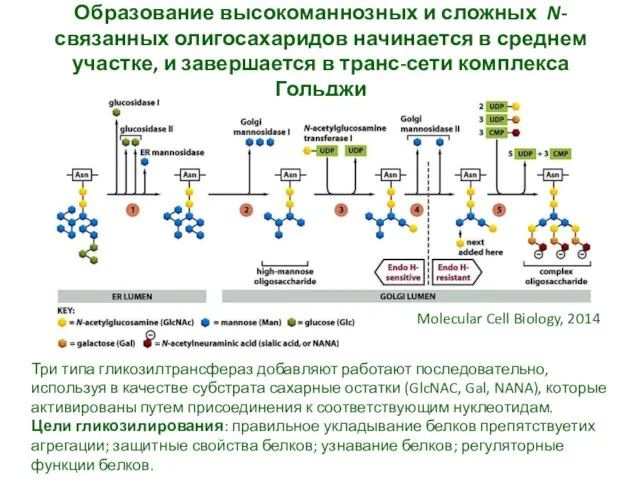
- 32. Образование высокоманнозных и сложных N-связанных олигосахаридов начинается в среднем участке, и завершается в транс-сети комплекса Гольджи
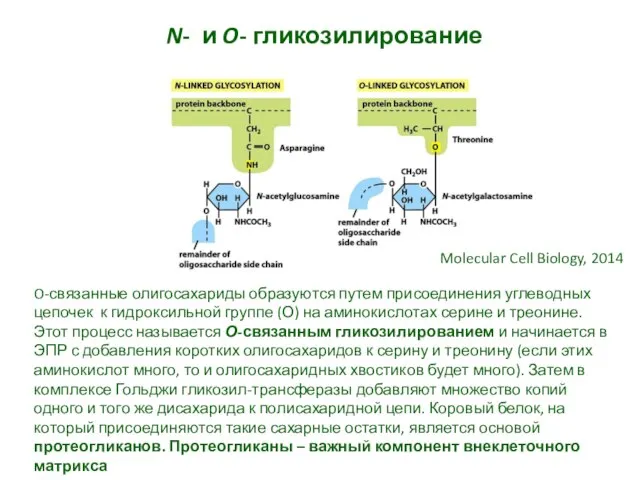
- 33. N- и O- гликозилирование Molecular Cell Biology, 2014 O-связанные олигосахариды образуются путем присоединения углеводных цепочек к
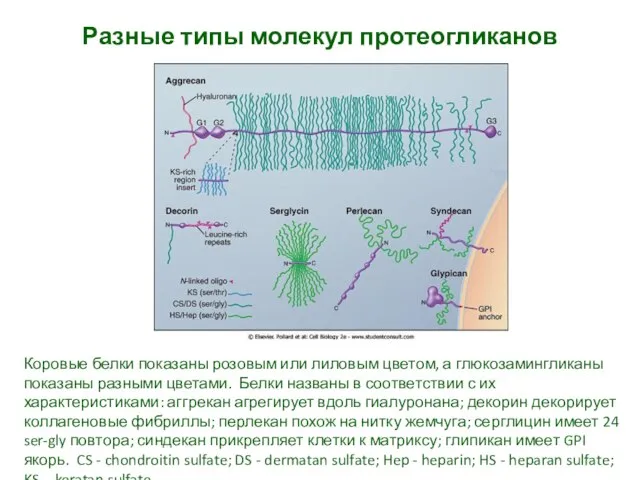
- 34. Разные типы молекул протеогликанов Коровые белки показаны розовым или лиловым цветом, а глюкозамингликаны показаны разными цветами.
- 35. Биосинтез и метаболизм липидов в комплексе Гольджи Одной из функций комплекса Гольджи является синтез сфинголипидов. Основой
- 37. Скачать презентацию








 Природа и её значение в жизни человека
Природа и её значение в жизни человека Презентация на тему Словарная работа
Презентация на тему Словарная работа  Иммунная система. Иммунитет
Иммунная система. Иммунитет Моё хобби. Поле крокусов
Моё хобби. Поле крокусов Загадочный мир китов и дельфинов
Загадочный мир китов и дельфинов Кровь лягушки
Кровь лягушки Органы чувств
Органы чувств Ствол мозга. Строение и кровоснабжение
Ствол мозга. Строение и кровоснабжение Презентация на тему Дыхание растений 6 класс
Презентация на тему Дыхание растений 6 класс  Понятие морфогенов и градиентов их концентраций
Понятие морфогенов и градиентов их концентраций Периоды онтогенеза
Периоды онтогенеза Эмбриогенез млекопитающих
Эмбриогенез млекопитающих Биотические связи в природе
Биотические связи в природе Ткани человека
Ткани человека Отряд журавлеобразные
Отряд журавлеобразные Презентация на тему Питания (5 класс)
Презентация на тему Питания (5 класс)  Бесполое размножение
Бесполое размножение Сорго. Значение и использование
Сорго. Значение и использование Применение водорослей в медицине
Применение водорослей в медицине грибы
грибы Презентация на тему Класс Земноводные
Презентация на тему Класс Земноводные  Ткани
Ткани Альтернативные источники энергии
Альтернативные источники энергии Розмноження рослин
Розмноження рослин Ненаследственная изменчивость
Ненаследственная изменчивость Презентация на тему Антропоген
Презентация на тему Антропоген  Грыбное царство
Грыбное царство Дыхательная система
Дыхательная система