Содержание
- 2. История открытия белков 17 – 18 вв – выделение из различных растительных и животных источников вязких,
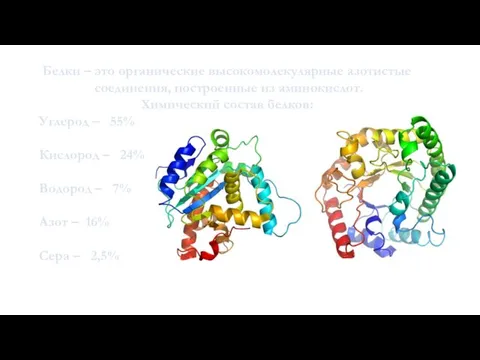
- 3. Белки – это органические высокомолекулярные азотистые соединения, построенные из аминокислот. Химический состав белков: Углерод – 55%
- 4. Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов
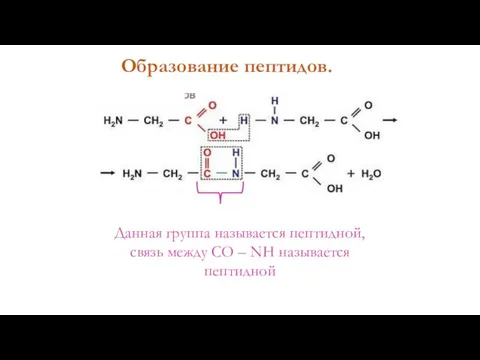
- 5. Образование пептидов. Данная группа называется пептидной, связь между СО – NH называется пептидной
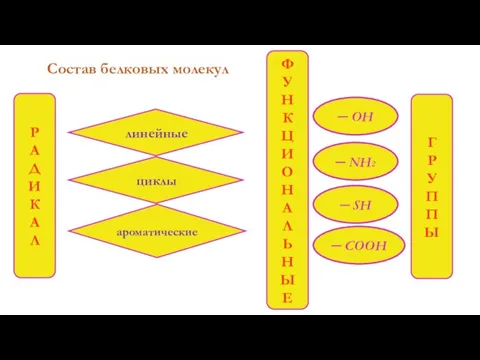
- 6. Состав белковых молекул ─ SH ─ OH ─ COOH ─ NH2 линейные циклы ароматические Р А
- 7. Виды белков Сложные Простые Альбумины Глобулины Металлопротеины Фосфопротеины Липопротеиды Данное деление белков на простые и сложные
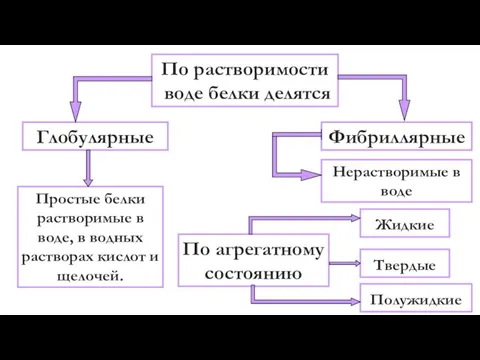
- 8. По растворимости воде белки делятся Глобулярные Фибриллярные Простые белки растворимые в воде, в водных растворах кислот
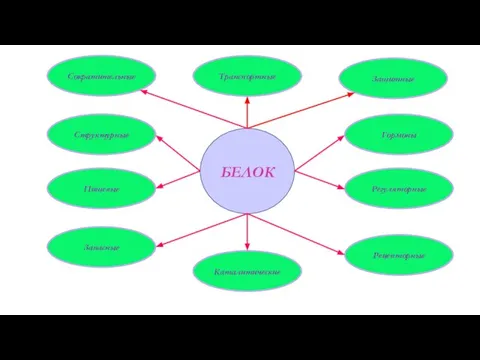
- 9. Структурные Пищевые Запасные Сократительные Транспортные Каталитические Защитные Гормоны Регуляторные Рецепторные БЕЛОК
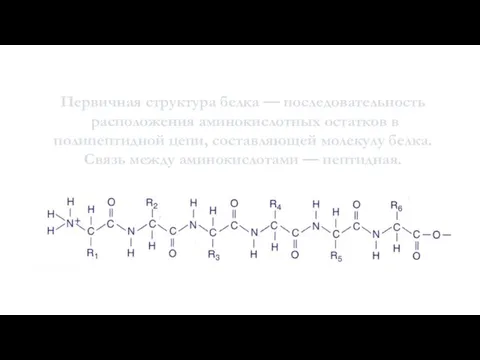
- 10. Строение белков. Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка.
- 11. Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины) Витки спирали укрепляются
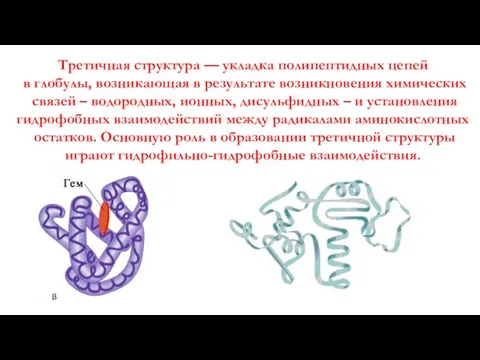
- 12. Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей – водородных,
- 13. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в
- 15. Скачать презентацию





 Северная собака Лайка
Северная собака Лайка portfoli
portfoli Трудные вопросы биологии
Трудные вопросы биологии Презентация на тему Биогеоценоз, как особый уровень организации жизни
Презентация на тему Биогеоценоз, как особый уровень организации жизни  Ядовитые цветы
Ядовитые цветы Лекция 3. Функциональная ассиметрия полушарий
Лекция 3. Функциональная ассиметрия полушарий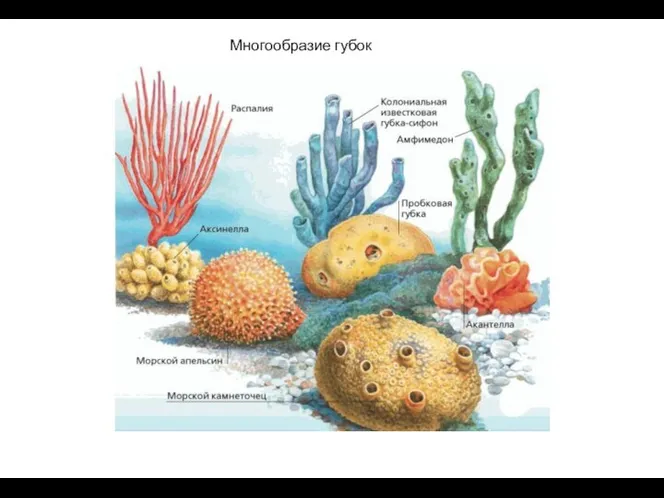 Многообразие губок
Многообразие губок Строение и функции желудка
Строение и функции желудка Нутрициология. Лекция 1
Нутрициология. Лекция 1 Возрастные особенности эндокринной системы
Возрастные особенности эндокринной системы Кровь (физиология системы крови) - Презентация
Кровь (физиология системы крови) - Презентация Экологические свойства трав
Экологические свойства трав Насколько мы неандертальцы. Мнения генетиков
Насколько мы неандертальцы. Мнения генетиков Plod a semeno
Plod a semeno Зимующие птицы
Зимующие птицы HydraMax. Оптимальная Гидратация
HydraMax. Оптимальная Гидратация Учение И.П. Павлова о высшей нервной деятельности и ее типологических особенностях
Учение И.П. Павлова о высшей нервной деятельности и ее типологических особенностях Основные компоненты клетки. 6 класс
Основные компоненты клетки. 6 класс Удельная продукция. Р/В коэффициент. Ассимиляционное число
Удельная продукция. Р/В коэффициент. Ассимиляционное число Викторина по биологии Всеросс 2013-2014
Викторина по биологии Всеросс 2013-2014 Презентация на тему Взгляды и гипотезы о происхождении жизни на Земле
Презентация на тему Взгляды и гипотезы о происхождении жизни на Земле  Технология создания настольного мини-садика в плошке. Ассортимент растений и виды ёмкостей
Технология создания настольного мини-садика в плошке. Ассортимент растений и виды ёмкостей Сорока-белобока
Сорока-белобока Физиология пищеварения
Физиология пищеварения Спинной мозг человека
Спинной мозг человека Спілкування тварин
Спілкування тварин Роль Ангаро-Байкальского территориального управления федерального агентства по рыболовству в исследовательской деятельности
Роль Ангаро-Байкальского территориального управления федерального агентства по рыболовству в исследовательской деятельности § 58. Экологические группы млекопитающих 7 класс биология
§ 58. Экологические группы млекопитающих 7 класс биология