Содержание
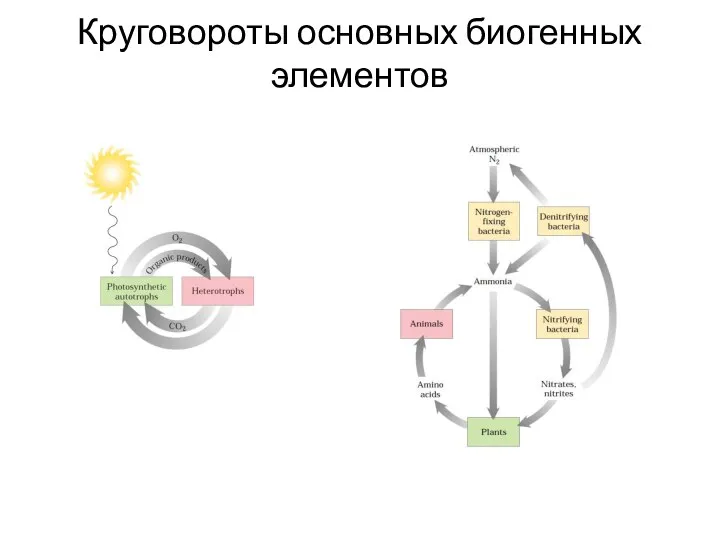
- 2. Круговороты основных биогенных элементов
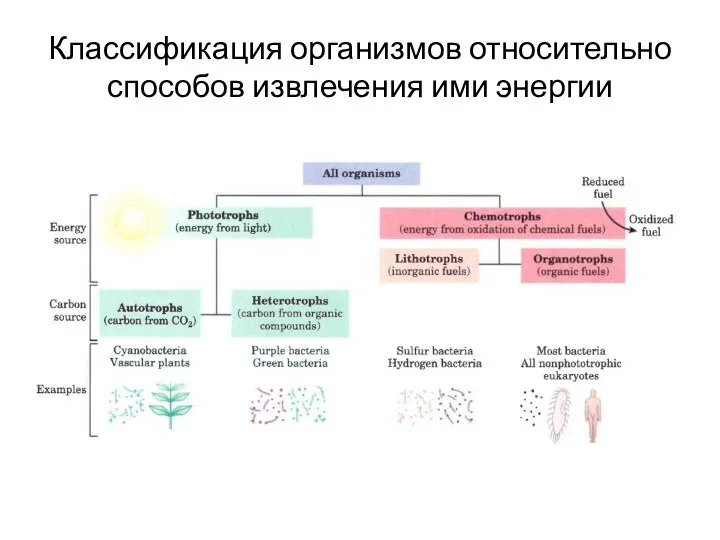
- 3. Классификация организмов относительно способов извлечения ими энергии
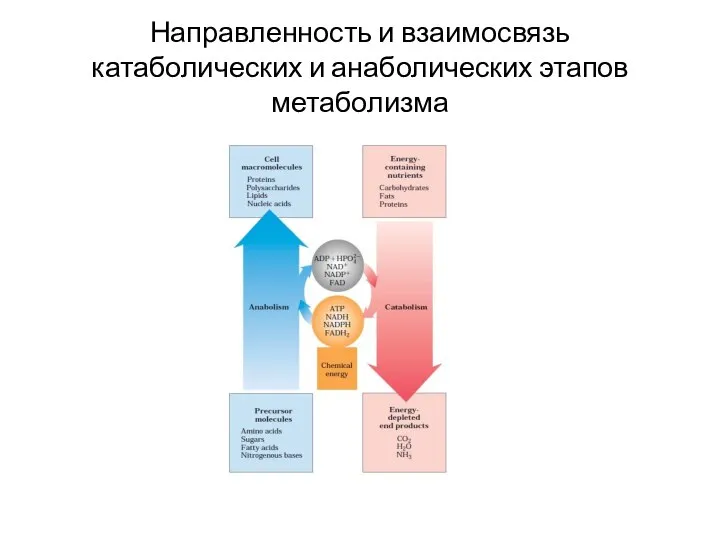
- 4. Направленность и взаимосвязь катаболических и анаболических этапов метаболизма
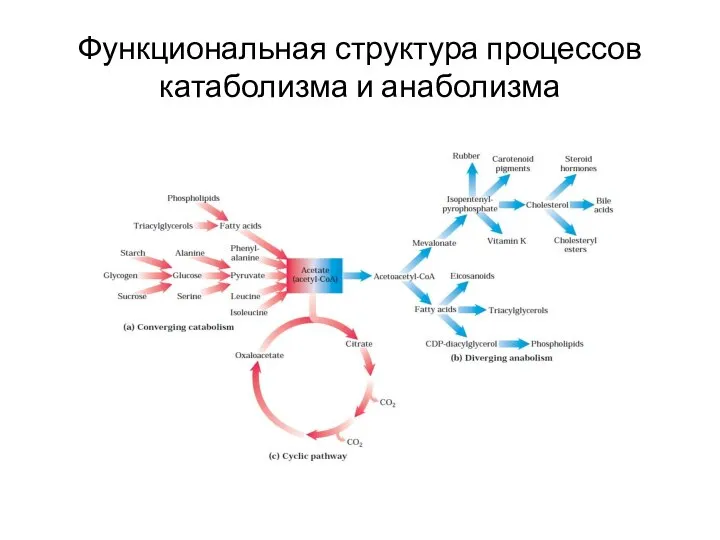
- 5. Функциональная структура процессов катаболизма и анаболизма
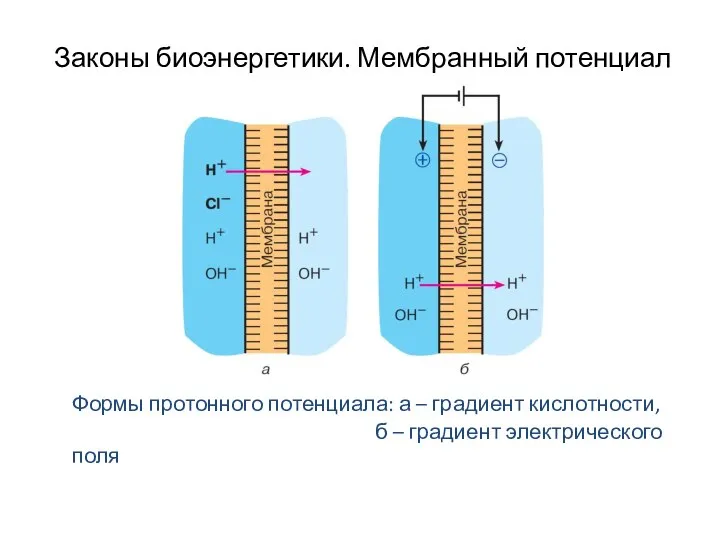
- 6. Законы биоэнергетики. Мембранный потенциал Формы протонного потенциала: а – градиент кислотности, б – градиент электрического поля
- 7. Законы биоэнергетики. Мембранный потенциал
- 8. Законы биоэнергетики. Первый закон
- 9. Законы биоэнергетики. Второй закон Клетка всегда имеет как минимум две формы энергии: макроэргические связи АТФ энергию,
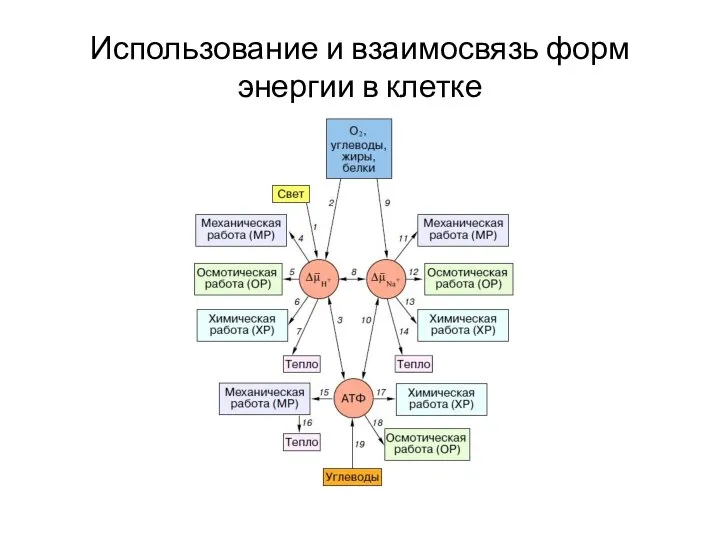
- 10. Использование и взаимосвязь форм энергии в клетке
- 11. Законы биоэнергетики. Третий закон Энергетические формы могут превращаться одна в другую Na+-АТФ-синтаза : АТФ ↔Δ μNa+,
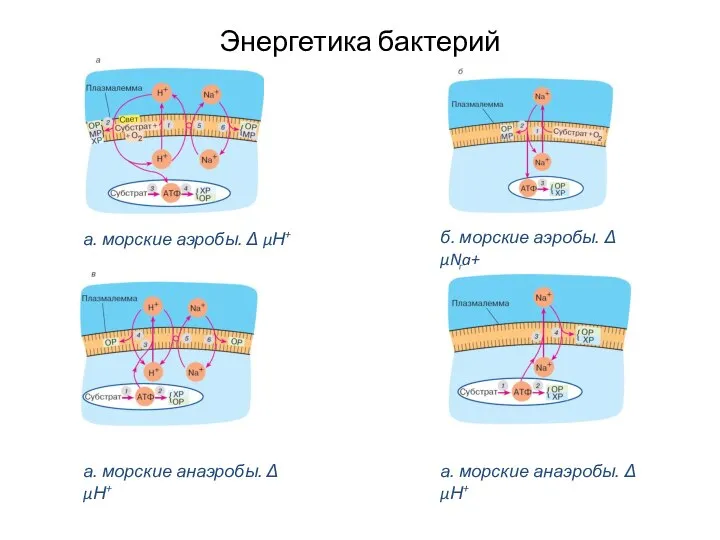
- 12. Энергетика бактерий а. морские аэробы. Δ μН+ б. морские аэробы. Δ μNa+ а. морские анаэробы. Δ
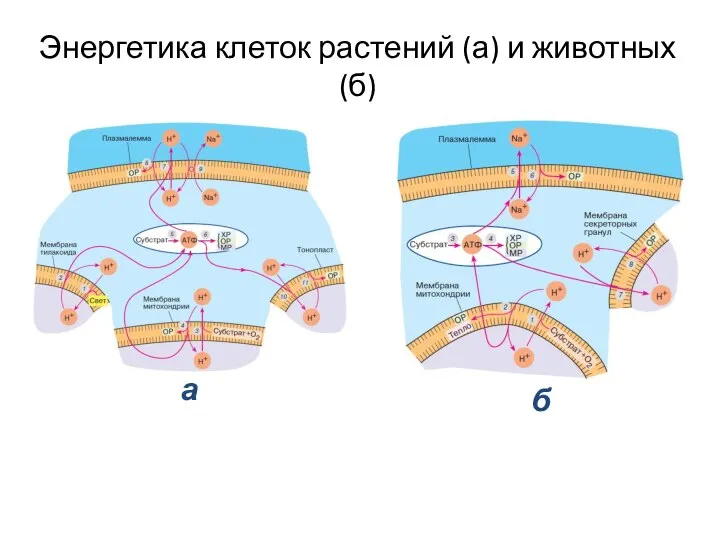
- 13. Энергетика клеток растений (а) и животных (б) а б
- 14. Основы термодинамики Энергия (от гр. energeia - деятельность) - одно из основных свойств материи, мера её
- 15. Основы термодинамики Работа - упорядоченная форма передачи энергии, связанная с преодолением внешнего сопротивления Теплота - неупорядоченная
- 16. Основы термодинамики Система - это тело или совокупность тел, выделенных из пространства Среда - всё, что
- 17. Виды системы в зависимости от фаз Гомогенные системы - состоят из одной фазы (физиологический раствор, плазма
- 18. Типы систем в зависимости от связи со средой Открытые Закрытые Изолированные
- 19. Основы термодинамики Состояние системы - совокупность условий существования и состава системы
- 21. Типы термодинамических систем
- 22. Термодинамика. Первый закон Общее количество энергии (U) замкнутой системы сохраняется постоянным U = const или ΔU
- 23. Термодинамика. Первый закон U2 – U1 = ΔU = ΔQ + ΔA ΔQ - теплообмен ΔA
- 24. Термодинамика. Второй закон Процессы, связанные с превращениями энергии, могут происходить самопроизвольно только при условии, что энергия
- 25. Свободная энергия и энтальпия U = F + TS U – внутренняя энергия F – свободная
- 26. Свободная энергия и энтальпия - при постоянном объеме и изменении давления: ΔU = ΔF + T
- 27. Связь энергии и энтальпии ΔH = ΔU + p ΔV; ΔG = ΔF + p ΔV
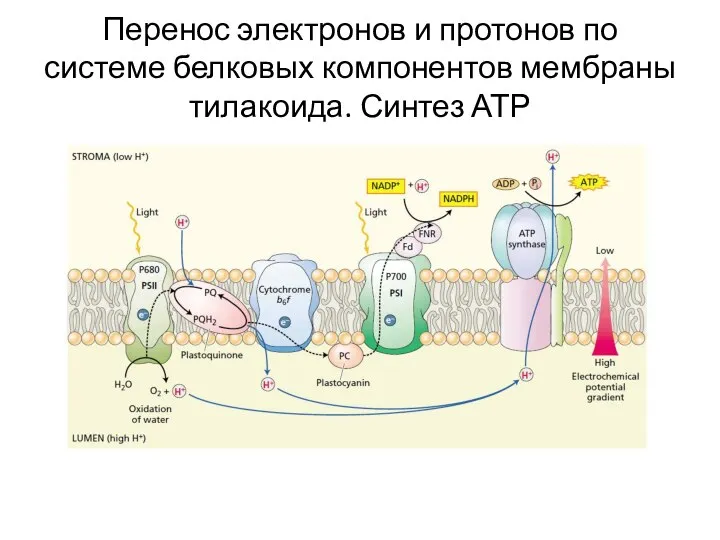
- 28. Перенос электронов и протонов по системе белковых компонентов мембраны тилакоида. Синтез АТР
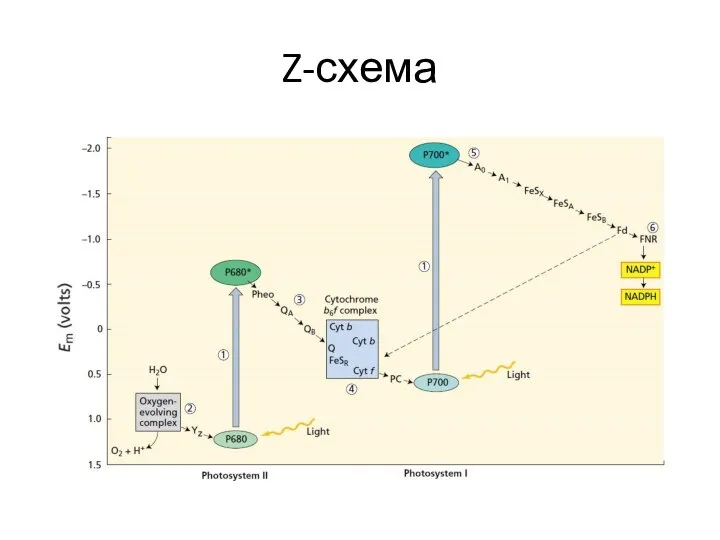
- 29. Z-схема
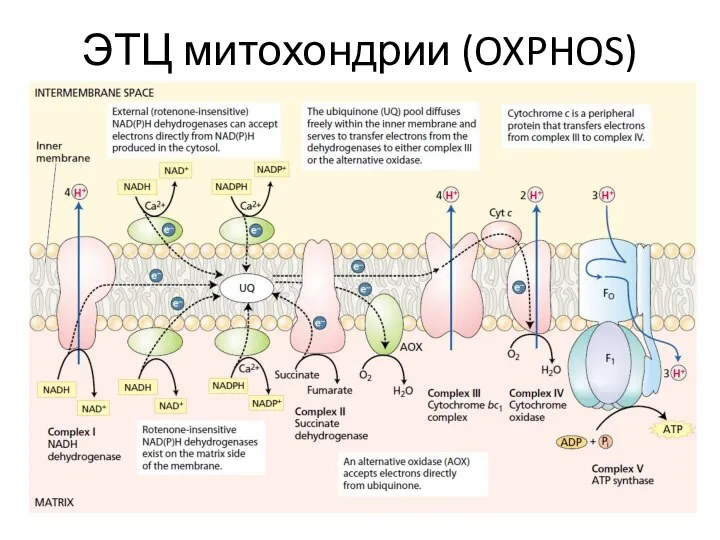
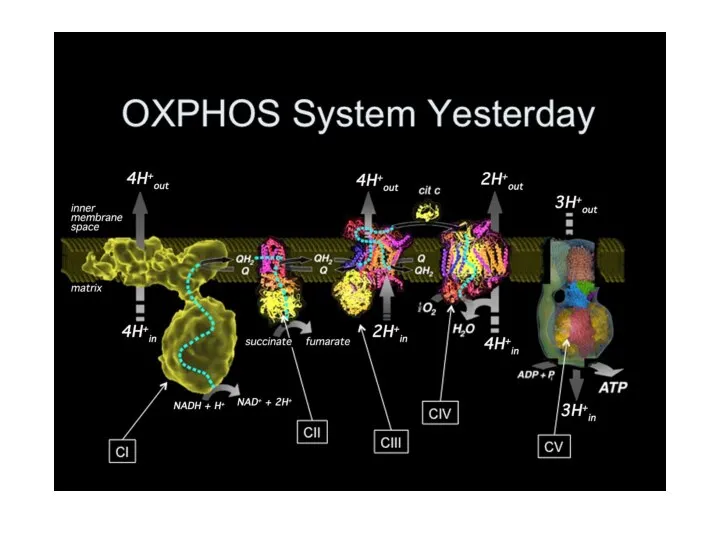
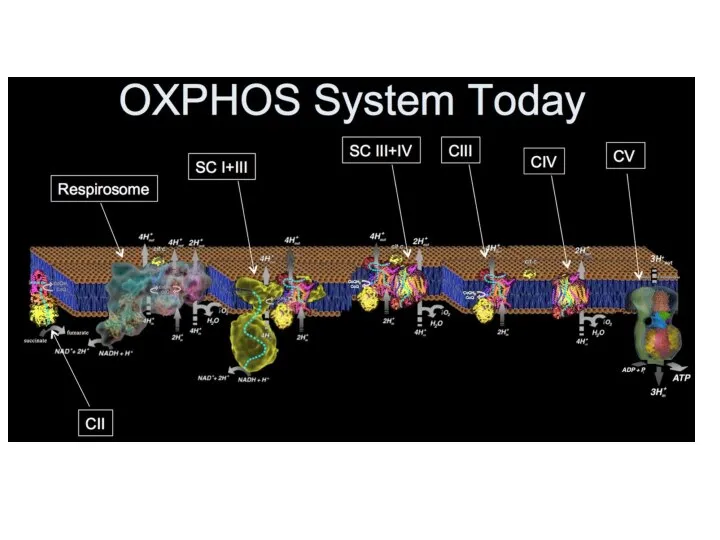
- 30. ЭТЦ митохондрии (OXPHOS)
- 40. Скачать презентацию























 Биология и биофизика
Биология и биофизика Презентация на тему Коралловые полипы
Презентация на тему Коралловые полипы  Береза. Дневник наблюдений
Береза. Дневник наблюдений Таблицы по зоологии (часть 4)
Таблицы по зоологии (часть 4) Наследственность и генетика
Наследственность и генетика Презентация на тему "Стрекоза" - презентации по Биологии
Презентация на тему "Стрекоза" - презентации по Биологии Бактерии. Значение бактерий в природе
Бактерии. Значение бактерий в природе Способы размножения многолетников
Способы размножения многолетников Предпосылки возникновения дарвинизма
Предпосылки возникновения дарвинизма МЕТАБОЛИЗМ_9
МЕТАБОЛИЗМ_9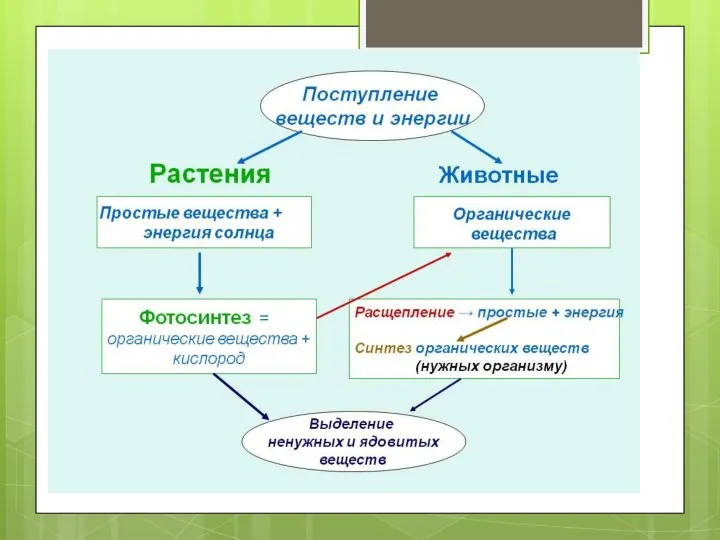 Продукты выделения жизнедеятельности организмов
Продукты выделения жизнедеятельности организмов ГМО: польза или вред для для человечества?
ГМО: польза или вред для для человечества? Внутреннее строение млекопитающих
Внутреннее строение млекопитающих Факторы антропогенеза
Факторы антропогенеза Молекулярна біологія
Молекулярна біологія Презентация на тему Русская школа генетики
Презентация на тему Русская школа генетики  Young Animals. Детеныши животных
Young Animals. Детеныши животных Презентация на тему Значение покрытосеменных в природе и жизни человека
Презентация на тему Значение покрытосеменных в природе и жизни человека  Круглые черви – паразиты человека
Круглые черви – паразиты человека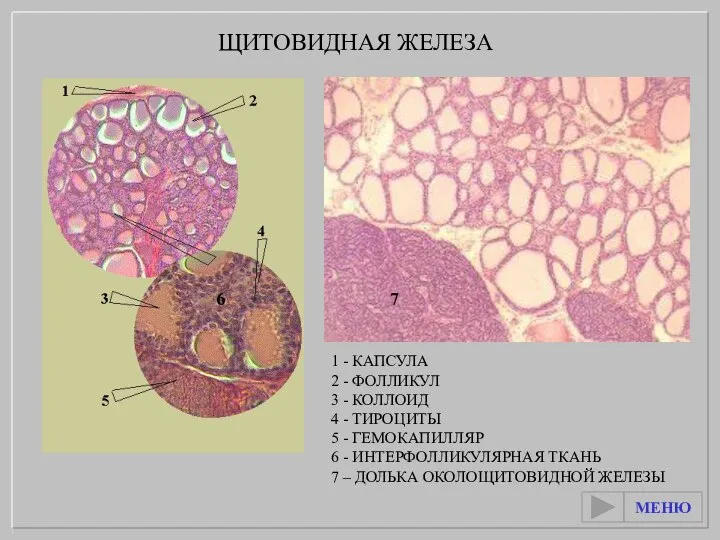 Щитовидная железа
Щитовидная железа According to the soil specialization. (And some botanical science)
According to the soil specialization. (And some botanical science) Возрастная анатомия, физиология и гигиена
Возрастная анатомия, физиология и гигиена Пищеварительная система - IV. Печень. Поджелудочная железа
Пищеварительная система - IV. Печень. Поджелудочная железа Функции желёз внутренней секреции
Функции желёз внутренней секреции Lesson_4_ Chondrichthyes
Lesson_4_ Chondrichthyes Антропогенез. Неоантропы: мы
Антропогенез. Неоантропы: мы Птицы
Птицы Проблема филогенетических отношений билатерий
Проблема филогенетических отношений билатерий