Содержание
- 2. النظرية الذرية الحديثة
- 3. مفردات الموضوع 1- حالات المادة 2- مفهوم الذرة وفق النظرية الذرية الحديثة . 3- العدد الذري
- 4. مفهوم الذرة وفق النظرية الذرية الحديثة
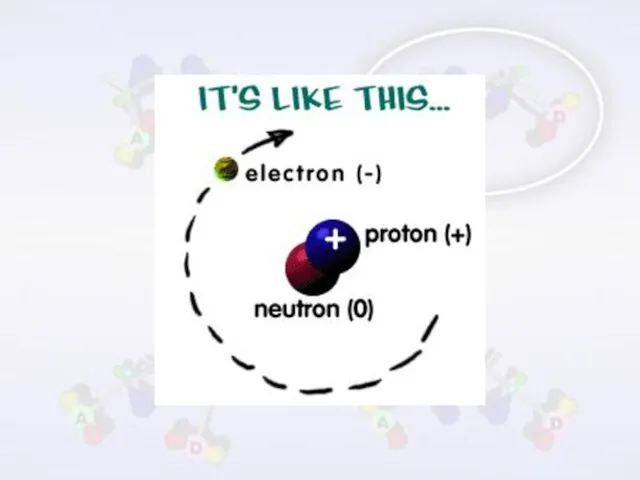
- 5. الذرة عبارة عن جسيم فراغي يتألف من نواة صغيرة الحجم ، ثقيلة الوزن ، موجبة الشحنة
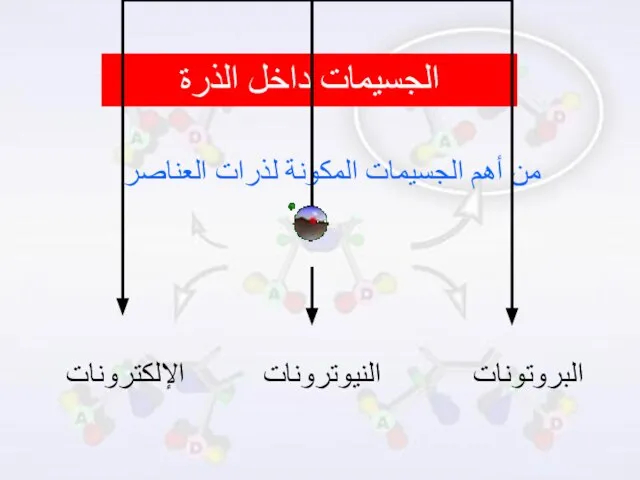
- 7. الجسيمات داخل الذرة من أهم الجسيمات المكونة لذرات العناصر البروتونات النيوترونات الإلكترونات
- 8. البروتونات جسيمات موجبة الشحنة توجد داخل النواة ، وهي الجسيمات المسؤولة عن نوع العنصر ، فالعناصر
- 9. النيوترونات جسيمات متعادلة الشحنة توجد داخل النواة ايضاً ، كتلتها مساوية تقريباً لكتلة البروتونات ، وباختلاف
- 10. الإلكترونات جسيمات سالبة الشحنة ذو طبيعة موجية توجد في الفراغ حول النواة وتتحرك حول النواة ،
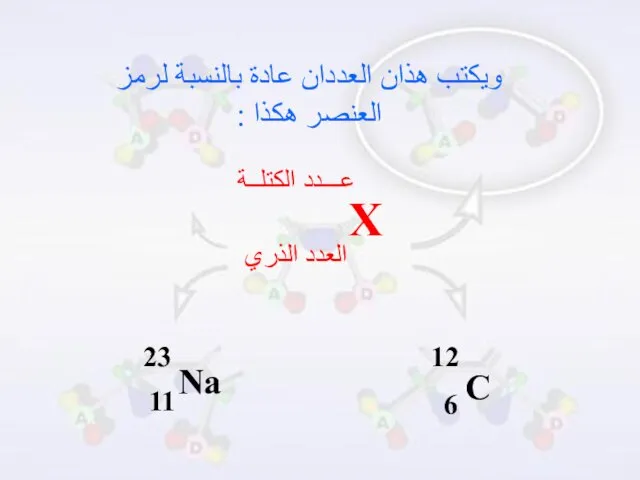
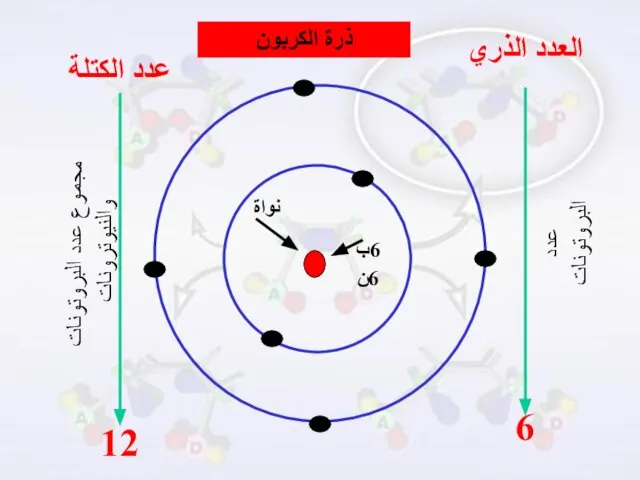
- 11. العدد الذري وعدد الكتلة العدد الذري : هو عدد البروتونات في نواة ذرة العنصر . عدد
- 12. ويكتب هذان العددان عادة بالنسبة لرمز العنصر هكذا :
- 13. العدد الذري 6 ذرة الكربون
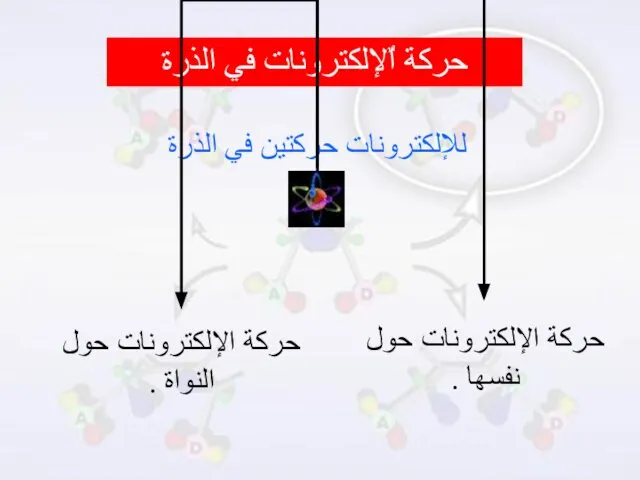
- 14. حركة اٌلإلكترونات في الذرة للإلكترونات حركتين في الذرة حركة الإلكترونات حول نفسها . حركة الإلكترونات حول
- 15. أولاً : حركة الإلكترونات حول نفسها :
- 16. تتحرك الإلكترونات حول نفسها حركة مغزلية إما باتجاه حركة عقارب الساعة أو عكس اتجاه حركة عقارب
- 17. ثانياً : حركة الإلكترونات حول النواة :
- 18. تتحرك الإلكترونات حول النواة على مسافات ومستويات متباعدة عن النواة تبعاً للطاقة التي يمتلكها الإلكترون ،
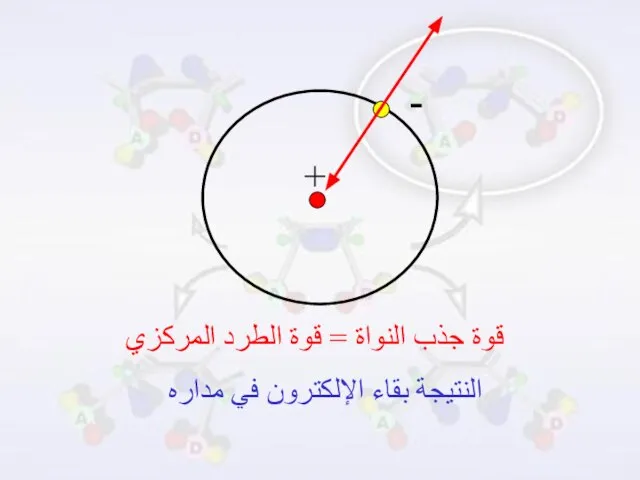
- 19. قوة جذب النواة = قوة الطرد المركزي النتيجة بقاء الإلكترون في مداره
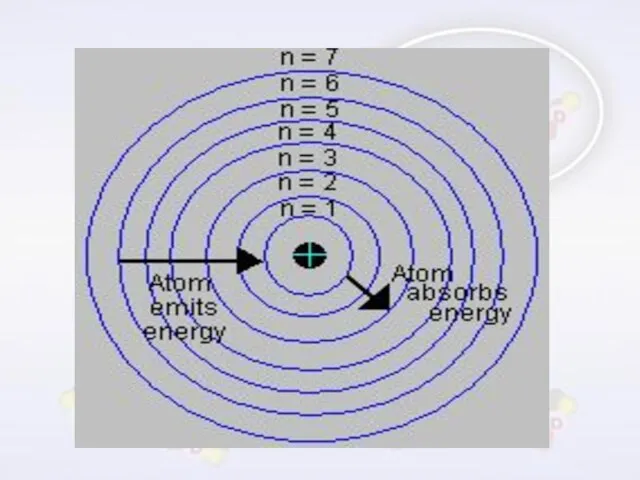
- 20. يبلغ عدد المستويات التي تتحرك فيها الإلكترونات حول النواة سبع مستويات عرفت بمستويات الطاقة الرئيسية ورمز
- 23. Скачать презентацию













 Бегущая тень
Бегущая тень Физика и познание окружающего мира
Физика и познание окружающего мира Открытие фотоэффекта
Открытие фотоэффекта Законы отражения света. Свойства изображения в плоском зеркале. Законы преломления
Законы отражения света. Свойства изображения в плоском зеркале. Законы преломления Консультация по физике
Консультация по физике Механическое движение
Механическое движение Макроскопическая намагниченность, прецессия
Макроскопическая намагниченность, прецессия Элементная база электронных устройств
Элементная база электронных устройств Многоканальная система дистанционного зондирования
Многоканальная система дистанционного зондирования Закон сохранения импульса
Закон сохранения импульса Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Дифференцирующие и интегрирующие цепи
Дифференцирующие и интегрирующие цепи Презентация на тему Силы всемирного тяготения
Презентация на тему Силы всемирного тяготения  Что такое трансформатор
Что такое трансформатор _Закон всемирного тяготения_
_Закон всемирного тяготения_ Физика для одноклассников. Индивидуальный проект
Физика для одноклассников. Индивидуальный проект Электрический конденсатор. Ёмкость конденсатора
Электрический конденсатор. Ёмкость конденсатора Презентация на тему Рентгеновские лучи
Презентация на тему Рентгеновские лучи  Виды тепловых двигателей
Виды тепловых двигателей Расчет деревянных балок
Расчет деревянных балок Физические основы механики. Лекция 1.1
Физические основы механики. Лекция 1.1 Техническая механика. Срез, смятие, расчетные формулы
Техническая механика. Срез, смятие, расчетные формулы Движение под углом к горизонту
Движение под углом к горизонту Рубка металла
Рубка металла ДИНАМИКА в задачах (1)
ДИНАМИКА в задачах (1) Электрическая цепь. Электротехнические материалы и изделия
Электрическая цепь. Электротехнические материалы и изделия Теория движения военных колесных машин. Лекция 3
Теория движения военных колесных машин. Лекция 3 Особо чистые вещества
Особо чистые вещества