Содержание
- 2. Молекулярная физика - раздел физики, изучающий строение и свойства вещества, исходя из молекулярно-кинетических представлений о его
- 3. Таким образом, при исследовании тепловых явлений выделились два научных направления: Термодинамика, изучающая тепловые процессы без учета
- 4. Основные положения МКТ. Уравнение состояния идеального газа.
- 5. Основные положения молекулярно-кинетической теории Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ, основываясь при этом на представлениях
- 6. Атом — это наименьшая частица данного химического элемента, сохраняющая все его химические свойства. Химических элементов не
- 7. Масса и размеры молекул Согласно муждунар. Соглашению массы вех атомов принято сравнивать с массой атома углерода
- 8. 1 моль — количество вещества, в котором содержится столько же молекул или атомов, сколько их в
- 9. Так как, в одном моль вещества содержится число молекул, равное числу Авогадро (Na=6,02×1023 моль-1), а масса
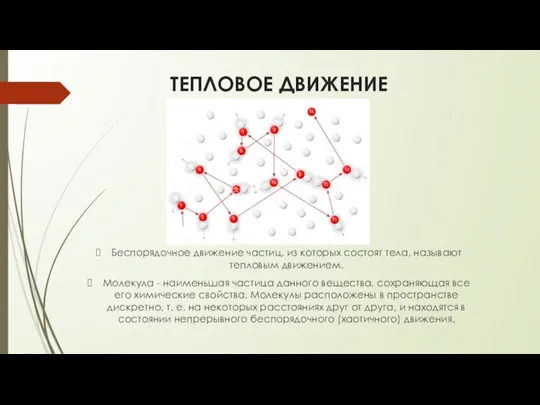
- 10. ТЕПЛОВОЕ ДВИЖЕНИЕ Беспорядочное движение частиц, из которых состоят тела, называют тепловым движением. Молекула - наименьшая частица
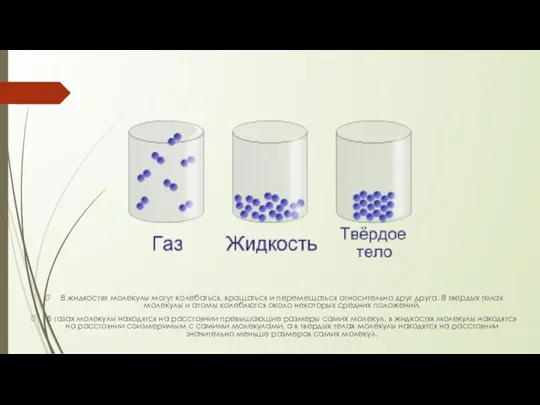
- 11. В жидкостях молекулы могут колебаться, вращаться и перемещаться относительно друг друга. В твердых телах молекулы и
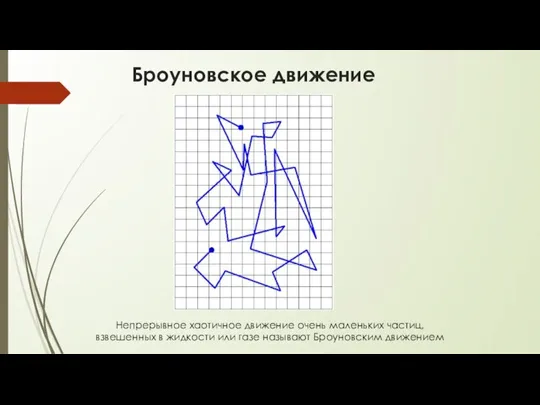
- 12. Броуновское движение Непрерывное хаотичное движение очень маленьких частиц, взвешенных в жидкости или газе называют Броуновским движением
- 13. Диффузия — явление проникновения молекул одного вещества в промежутки между молекулами другого вещества.
- 14. Температура Температура T - - это физическая величина, характеризующая степень нагрева предмета, измеряемую в градусах по
- 15. Приборы для измерения температуры посредством контакта с исследуемой средой (телом) называются термометрами (от греч. therme —
- 16. Температурная шкала, началом отсчёта которой является абсолютный нуль, а единицей температуры — градус Цельсия, называется абсолютной
- 17. Единица абсолютной температуры называется кельвином (K). Абсолютному нулю (T = 0) соответствует температура t = −273,15
- 18. Другим подтверждением существования сил межмолекулярного взаимодействия служит наличие трёх агрегатных состояний вещества
- 19. Уравнение состояния идеального газа Для описания разреженных газов в физике используется модель идеального газа. В рамках
- 20. Таким образом, идеальный газ — это газ, частицы которого являются не взаимодействующими на расстоянии материальными точками
- 21. Первый и второй закон термодинамики. Работа идеального газа. Термодинамической системой называется макроскопическое тело или система тел,
- 22. Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического
- 23. Опираясь на работы Джоуля и Майера, Клаузнус впервые высказал мысль, сформировавшуюся впоследствии в первое начало термодинамики.
- 24. Количество теплоты, сообщенное газу, идет на увеличение внутренней энергии газа и совершение газом внешней работы Q
- 25. Две эквивалентные формулировки второго закона термодинамики принадлежат Клаузиусу и Томсону (лорду Кельвину). Постулат Клаузиуса. Невозможен процесс,
- 26. Второе начало термодинамики (второй закон термодинамики) устанавливает существование энтропии как функции состояния термодинамической системы и вводит
- 27. Основное уравнение это уравнение Больцмана, которое позволяет вычислять параметр энтропия. S = Q/ T S –
- 28. Работу идеального газа можно выразить из 1 закона термодинамики: А=∆ Q-∆U где Q – количество теплоты,
- 29. Задачи 1. В баллоне находится 20 моль газа. Сколько молекул газа находится в баллоне?
- 31. 2. Определить массу молекулы кислорода.
- 32. 3. Сколько молекул содержится в 5 кг кислорода?
- 33. 4. Сколько молекул содержится в 1 л воды?
- 34. 5. Какое значение температуры по шкале Кельвина соответствует температуре 100° C?
- 35. 6. Определить число молекул, содержащихся в 1 г воды.
- 36. 7. Определить количество вещества, содержащегося в медной отливке массой 96 кг.
- 37. 8. Найти число молекул в 2 кг углекислого газа.
- 38. Задача 9. Найти массу природного горючего газа объемом 64 м3, считая, что объем указан при нормальных
- 40. Задача 10. Воздух объемом 1,45 м3, находящийся при температуре 20oC и давлении 100 кПа, превратили в
- 41. Задача 11. Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240
- 42. Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода
- 43. Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т
- 44. При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ =
- 45. Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
- 46. До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том
- 47. Газ находился в цилиндре с поршнем площадью поперечного сечения 200 см^2. После того, как газ нагрели,
- 48. Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое
- 49. Кислород нагрели при постоянном давлении p=80 кПа. Объем газа увеличился с 1 до 3 кубических метров.
- 51. Скачать презентацию












































 Движение по окружности
Движение по окружности Равномерное движение по окружности
Равномерное движение по окружности Газовые законы
Газовые законы Электричество и магнетизм магнитное поле
Электричество и магнетизм магнитное поле Презентация на тему Примеры потребления электроэнергии
Презентация на тему Примеры потребления электроэнергии  Роль звуковых колебаний в окружающем мире
Роль звуковых колебаний в окружающем мире Дифференцирующие и интегрирующие цепи
Дифференцирующие и интегрирующие цепи Физическое лото (викторина 8 класс)
Физическое лото (викторина 8 класс) кристаллические и аморфные вещества
кристаллические и аморфные вещества Подготовка машины к работе
Подготовка машины к работе Технологик жиҳозлар
Технологик жиҳозлар Задание по физике в формате ОГЭ
Задание по физике в формате ОГЭ Презентация на тему Атомная энергетика (9 класс)
Презентация на тему Атомная энергетика (9 класс)  Методы расчёта разветвленных цепей постоянного тока
Методы расчёта разветвленных цепей постоянного тока Сила Архимеда. Причина возникновения. Способы измерения
Сила Архимеда. Причина возникновения. Способы измерения Архимедова сила
Архимедова сила Особенности конструкции элементов системы неавтоматического управления
Особенности конструкции элементов системы неавтоматического управления Последовательное соединение проводников
Последовательное соединение проводников Электрические цепи постоянного тока
Электрические цепи постоянного тока Проводники в электростатическом поле
Проводники в электростатическом поле Массовая доля растворённого вещества
Массовая доля растворённого вещества Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Вычисление объёмных отношений газов
Вычисление объёмных отношений газов Молекулярно-кинетическая теория
Молекулярно-кинетическая теория Презентация OpenDocument
Презентация OpenDocument Оксид кремния и маскирующие слои на его основе
Оксид кремния и маскирующие слои на его основе Урок 22. Повторение. Законы Ньютона. Решение задач
Урок 22. Повторение. Законы Ньютона. Решение задач Презентация ЛЕКЦИЯ №11.0 колебания
Презентация ЛЕКЦИЯ №11.0 колебания