Содержание
- 2. Цель лекции – познакомиться с квантово-механической моделью атома водорода. Вопросы лекции: Атом водорода в квантовой механике
- 3. Вопрос №1 Атом водорода в квантовой механике
- 4. Воспользуемся сферической СК: Электрон движется в кулоновском поле ядра. Это поле – центрально-симметричное, стационарное.
- 5. Потенциальная энергия электрона: Волновая функция (ВФ) электрона: Плотность распределения вероятностей для координат электрона:
- 6. Квантово-механическая модель атома Заряд электрона непрерывно распределен в «электронном облаке» с плотностью Электрон – материальная точка,
- 7. Найти ВФ позволяет стационарное уравнение Шредингера Орбиталь – область пространства, в которой электрон «размазан» с неравномерной
- 8. Уравнение (12) имеет решения для дискретного набора собственных значений энергии:
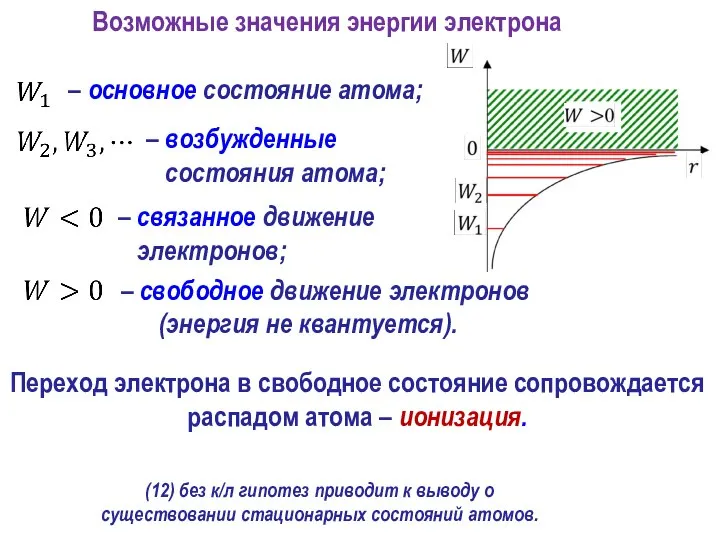
- 9. Возможные значения энергии электрона (12) без к/л гипотез приводит к выводу о существовании стационарных состояний атомов.
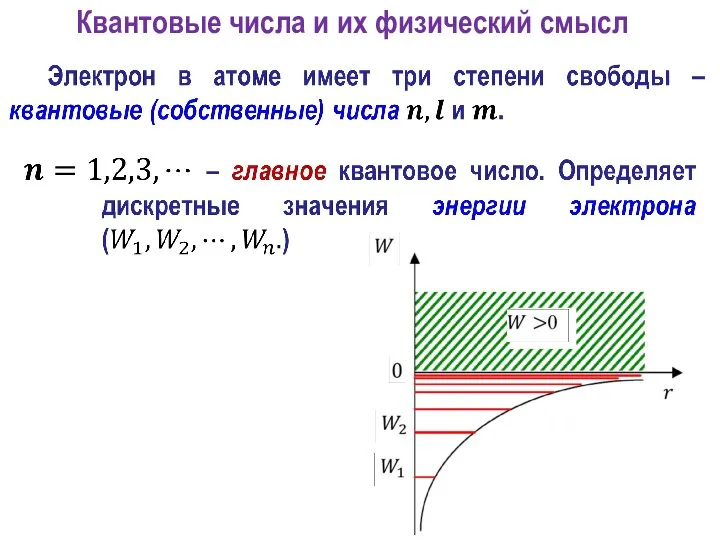
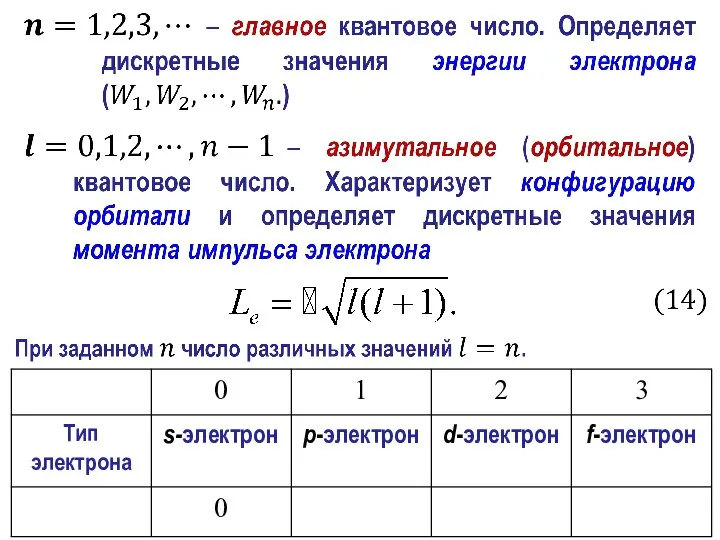
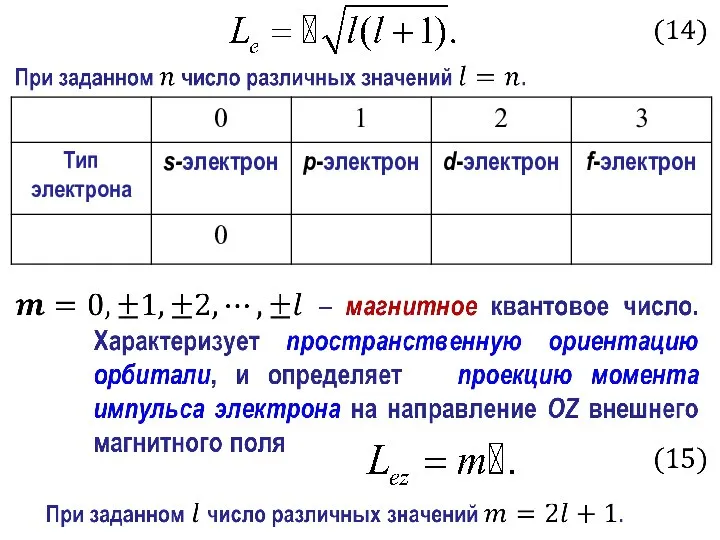
- 10. Квантовые числа и их физический смысл
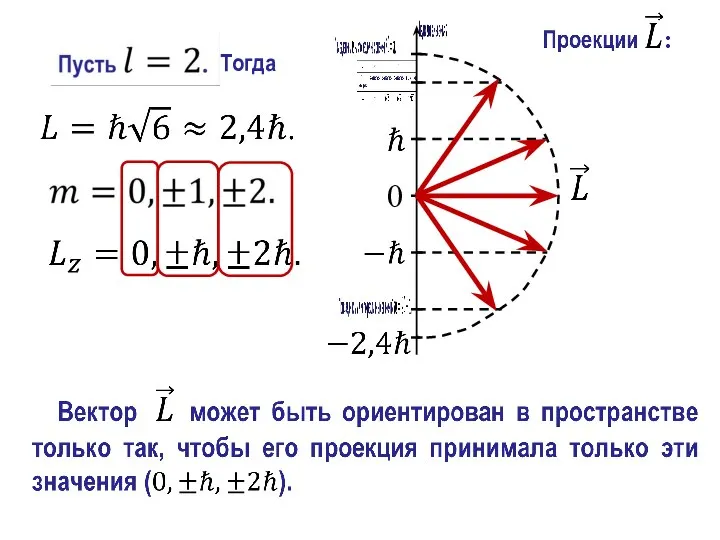
- 13. Тогда
- 14. Такие состояния называются вырожденными, а число вырожденных состояний – кратностью вырождения. Вырождение энергетического уровня Каждое конкретное
- 15. Состояния электрона, соответствующие первым трём энергетическим уровням
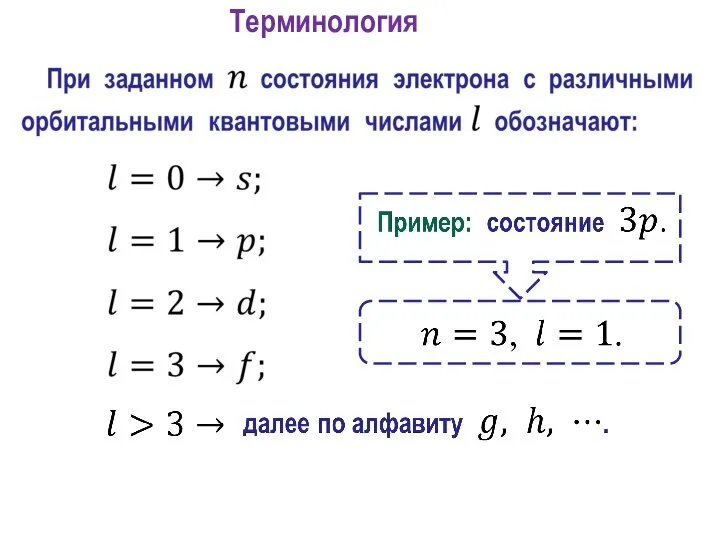
- 16. Терминология
- 17. Вопрос №2 Правила отбора. Спектр атома водорода
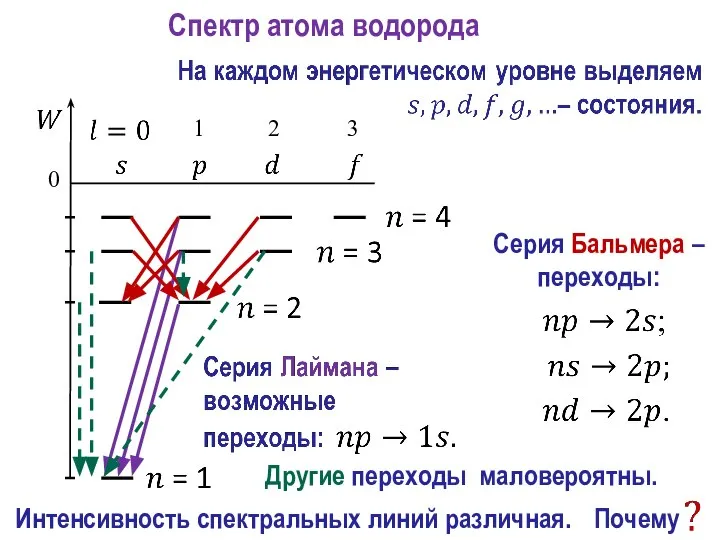
- 18. Теория Бора не объясняет различную интенсивность спектральных линий. В квантовой механике доказывается, что переход электрона с
- 19. Спектр атома водорода Серия Бальмера – переходы: Интенсивность спектральных линий различная. Другие переходы маловероятны.
- 20. значит, на него приходится большее число испускаемых фотонов и соответствующая ему спектральная линия ярче.
- 21. Вопрос №3 1s состояние электрона в атоме водорода
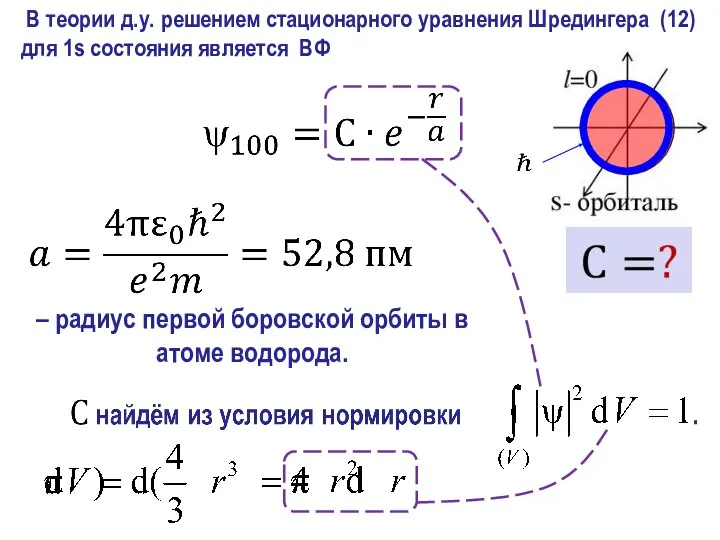
- 22. В теории д.у. решением стационарного уравнения Шредингера (12) для 1s состояния является ВФ 1s состоянию электрона
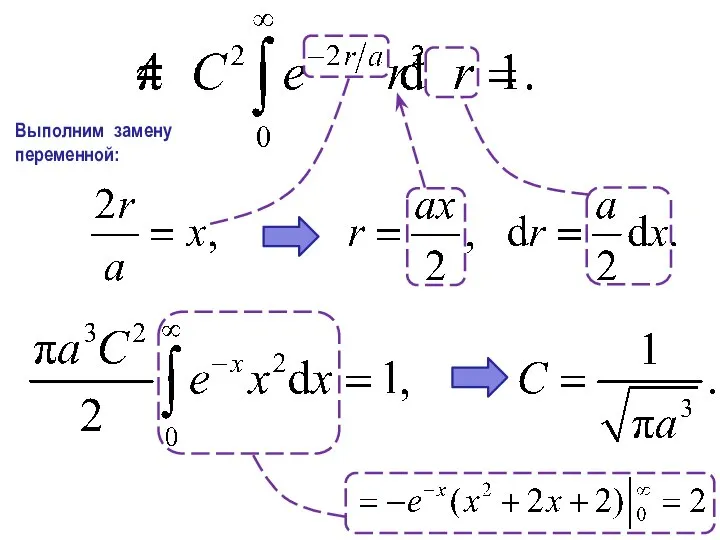
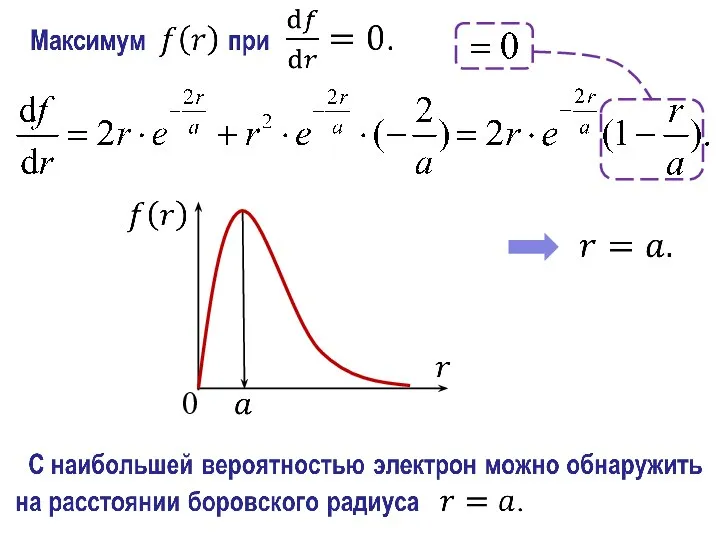
- 23. – радиус первой боровской орбиты в атоме водорода.
- 24. Выполним замену переменной:
- 26. Анализ решения Пространственная плотность распределения положения электрона: Т. обр. ВФ:
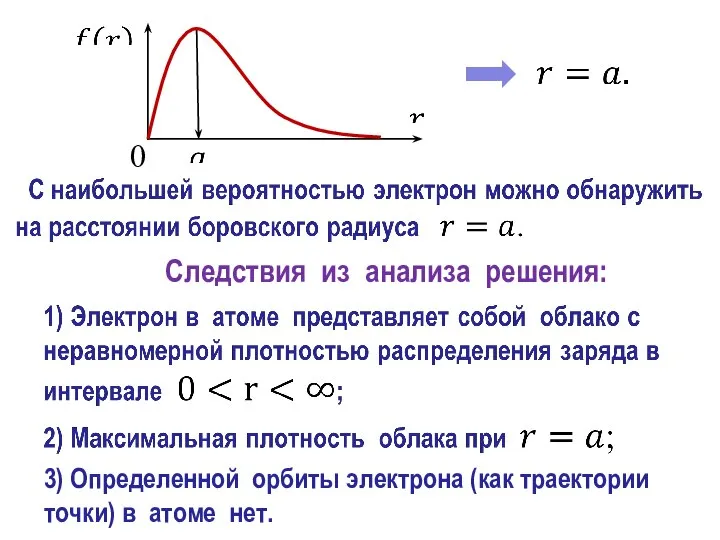
- 27. Вероятность определяется функцией
- 29. 3) Определенной орбиты электрона (как траектории точки) в атоме нет. Следствия из анализа решения:
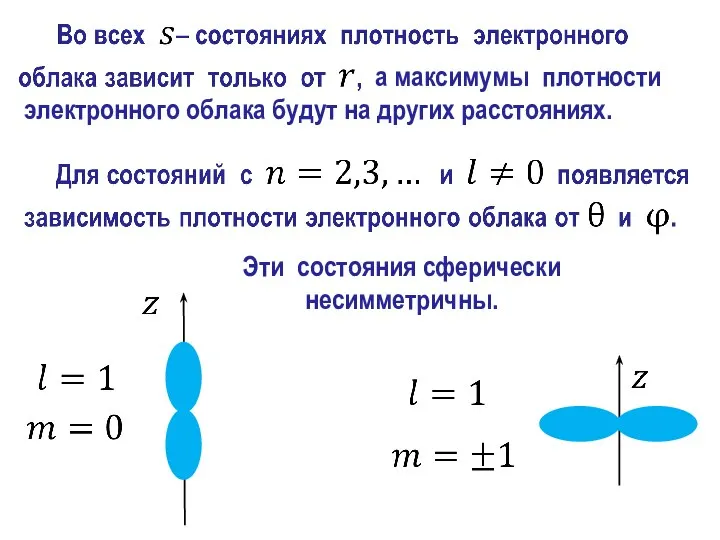
- 30. а максимумы плотности облака будут расположены на других расстояниях. Заключение Эти состояния сферически несимметричны.
- 32. Задание на самоподготовку Повторить тему лекции с использованием конспекта и рекомендованной литературы. Ответить на контрольные вопросы
- 34. Скачать презентацию



















 Вес тела. Единицы веса
Вес тела. Единицы веса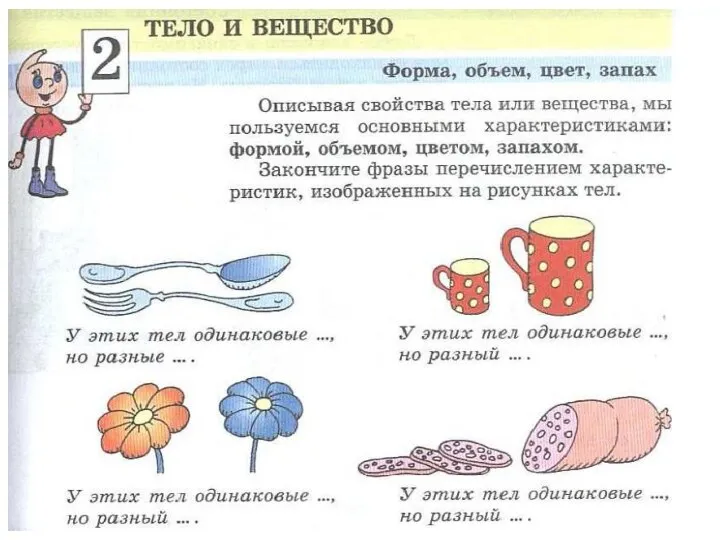 Строение вещества
Строение вещества Устройство и работа ДВС (двигателя внутреннего сгорания)
Устройство и работа ДВС (двигателя внутреннего сгорания) Тема 5. Нормирование шер-ти поверх-ти, точности формы и расположение поверх-й
Тема 5. Нормирование шер-ти поверх-ти, точности формы и расположение поверх-й opredelenie_koordinaty_dvizh_tela
opredelenie_koordinaty_dvizh_tela Эрнест Резерфорд
Эрнест Резерфорд Радиоактивные изотопы в биологии и медицине, археологии
Радиоактивные изотопы в биологии и медицине, археологии Червячные передачи
Червячные передачи Визуализация 3М сцен
Визуализация 3М сцен Задачи по физике. Электрический ток
Задачи по физике. Электрический ток Закон Джоуля-Ленца
Закон Джоуля-Ленца Неравновесные состояния и необратимые процессы. Броуновское движение
Неравновесные состояния и необратимые процессы. Броуновское движение Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Презентация по физике "Решение задач на расчет работы и мощности" -
Презентация по физике "Решение задач на расчет работы и мощности" -  Механические свойства твердых тел
Механические свойства твердых тел Презентация на тему Поле чудес Галилео Галилей
Презентация на тему Поле чудес Галилео Галилей  Статика. Динамика
Статика. Динамика Методы определения и единицы измерения влажности воздуха
Методы определения и единицы измерения влажности воздуха Электричество и магнетизм магнитное поле
Электричество и магнетизм магнитное поле Задачи на скорость движения молекул
Задачи на скорость движения молекул Радиоактивные превращения. Экспериментальные методы исследования частиц
Радиоактивные превращения. Экспериментальные методы исследования частиц Изменение агрегатного состояния вещества
Изменение агрегатного состояния вещества Механические волны
Механические волны Подготовка к ГИА по физике. Изменения в экзаменационной работе 2012 года по сравнению с 2011 годом
Подготовка к ГИА по физике. Изменения в экзаменационной работе 2012 года по сравнению с 2011 годом Тяговый расчет трактора
Тяговый расчет трактора Реконструкция установки производства фталевого ангидрида
Реконструкция установки производства фталевого ангидрида Плотность вещества
Плотность вещества Презентация на тему Лазеры
Презентация на тему Лазеры