Содержание
- 2. Цель лекции – познакомиться физическими свойствами и строением атома, выяснить природу линейчатых спектров излучения. Вопросы лекции:
- 3. Газ при нагревании начинает излучать. Введение Почему частоты излучения атомами имеют дискретные значения? Атомы каждого химического
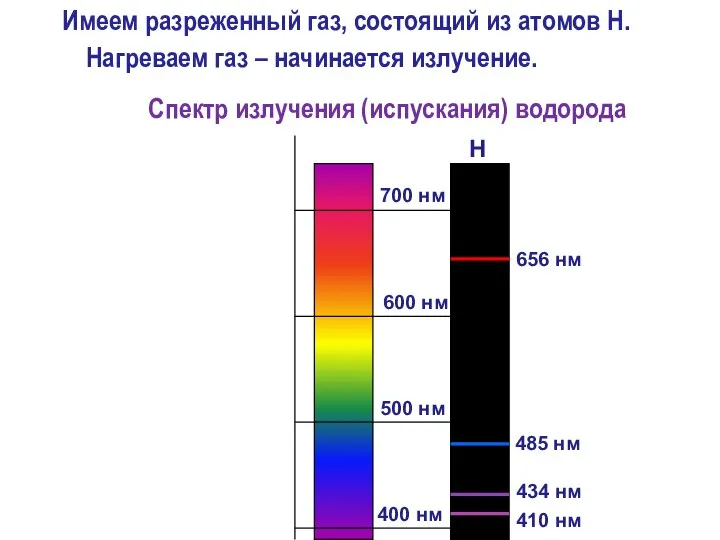
- 4. Вопрос №1 Линейчатый спектр атомов водорода
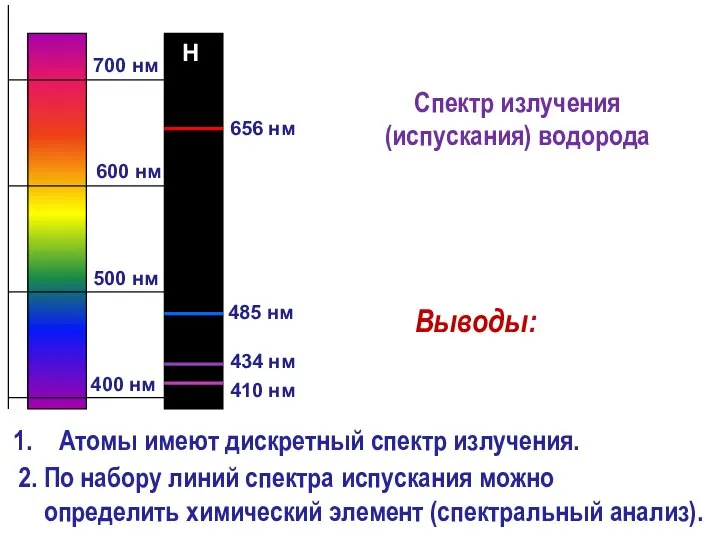
- 5. 700 нм 400 нм 656 нм 485 нм 410 нм 434 нм 600 нм 500 нм
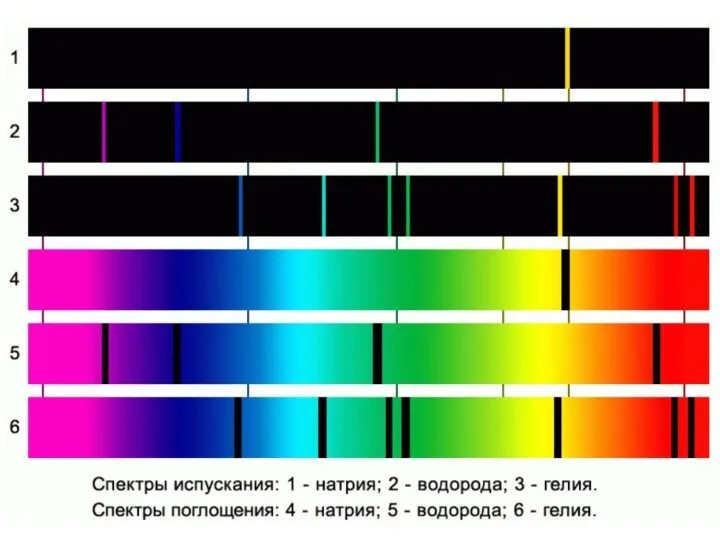
- 6. Атомы имеют дискретный спектр излучения. 2. По набору линий спектра испускания можно определить химический элемент (спектральный
- 7. Спектр поглощения водорода Имеем разреженный атомарный газ в холодном состоянии. Для перевода атомов газа в возбужденное
- 9. Темные линии в спектре поглощения газа соответствуют ярким линиям его спектра испускания. Вывод: при прямом и
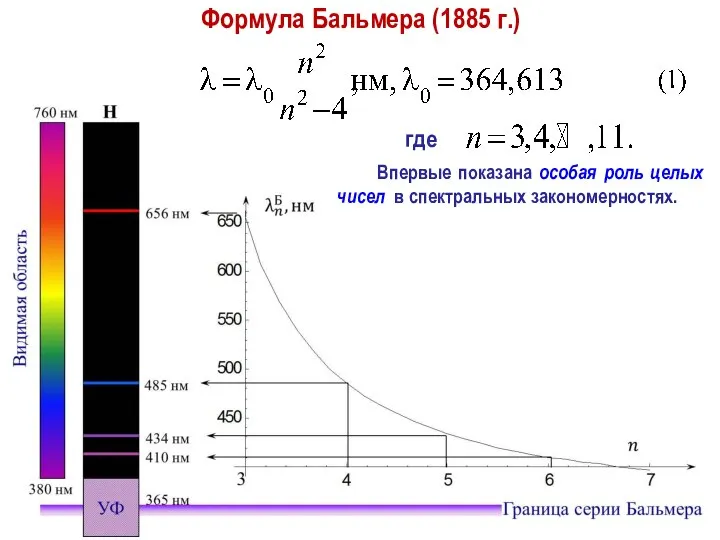
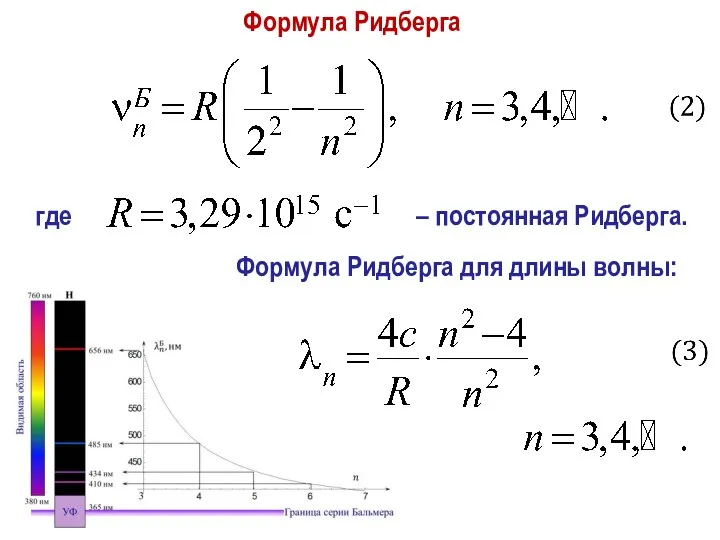
- 11. Формула Ридберга Формула Ридберга для длины волны: где – постоянная Ридберга.
- 12. Обобщенная формула Бальмера – Ридберга (для всех линий) где – целое число. 1. Спектр излучения газа
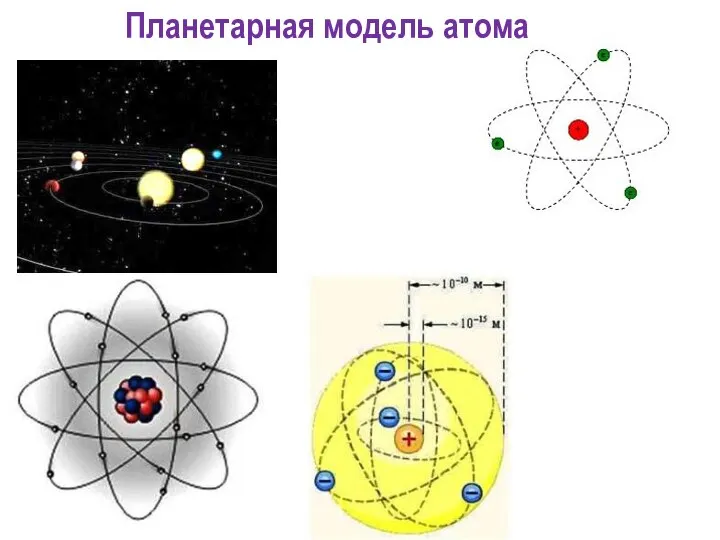
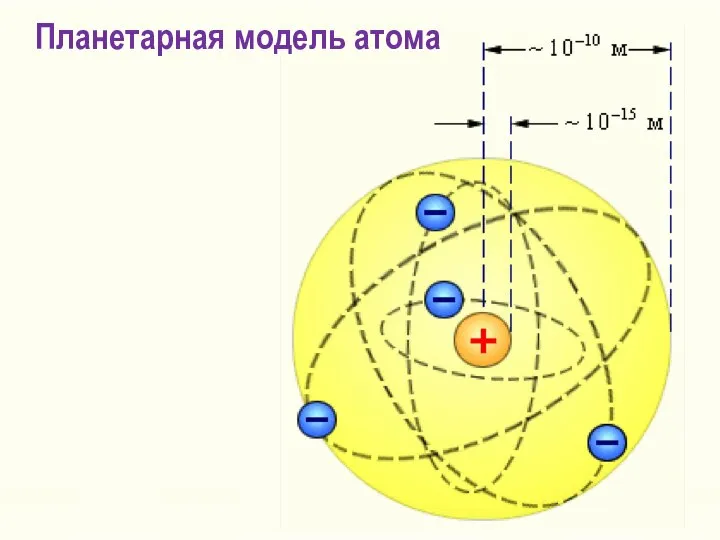
- 13. Вопрос №2 Ядерная модель атома Резерфорда
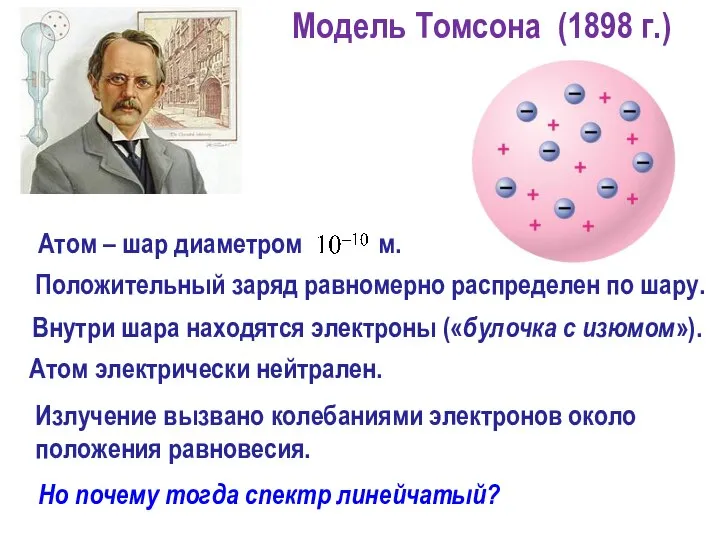
- 14. Излучение вызвано колебаниями электронов около положения равновесия. Атом электрически нейтрален. Но почему тогда спектр линейчатый? Положительный
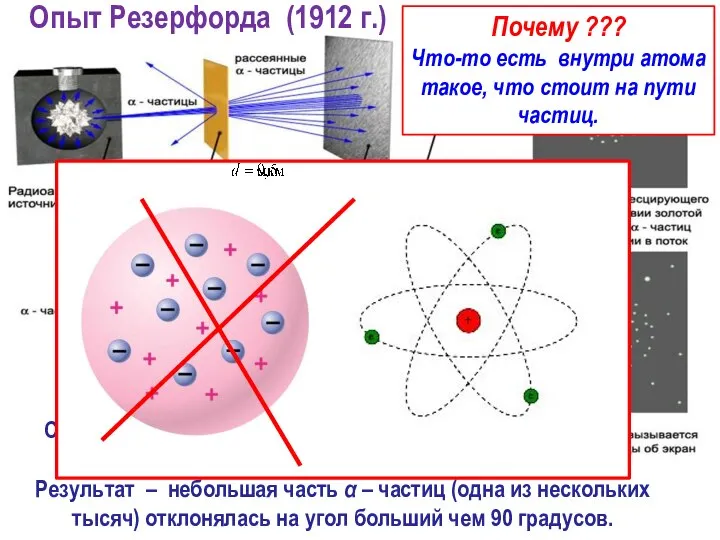
- 15. Результат – небольшая часть α – частиц (одна из нескольких тысяч) отклонялась на угол больший чем
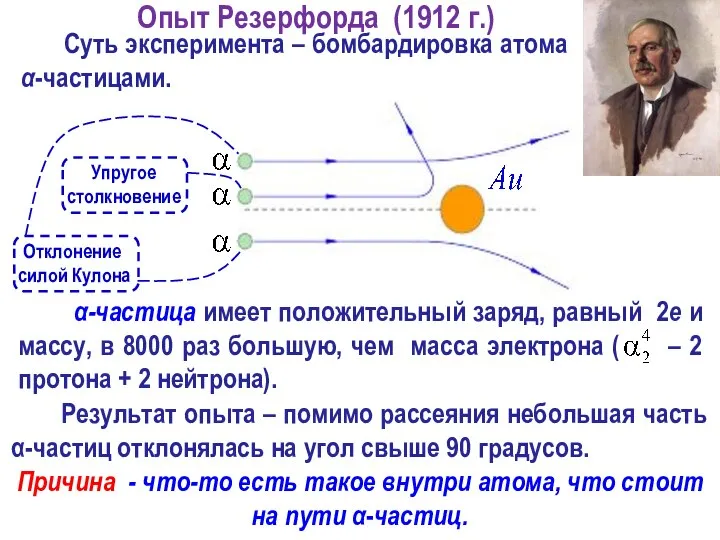
- 16. Результат опыта – помимо рассеяния небольшая часть α-частиц отклонялась на угол свыше 90 градусов. Суть эксперимента
- 19. Рассеяние α-частиц – есть результат их отклонения от ядра силой Кулона. Между ядром и электронами действуют
- 20. Всякий ускоренно движущийся заряд излучает ЭМВ, т.е. теряет энергию. Сила Кулона Полная энергия электрона Основной недостаток
- 21. Вывод: внутри атомов действуют другие законы – законы квантовой физики. Если то Атом прекратит свое существование.
- 22. Первый постулат Существуют стационарные состояния атома, находясь в которых он не излучает энергию. Каждое из этих
- 23. Первый постулат (постулат стационарных состояний) Существуют стационарные состояния атома, находясь в которых он не излучает энергию.
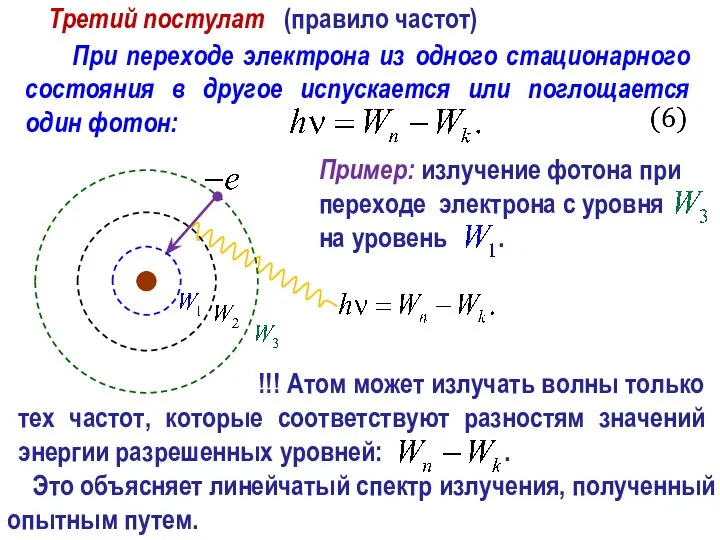
- 24. При переходе электрона из одного стационарного состояния в другое испускается или поглощается один фотон: Третий постулат
- 25. Это объясняет линейчатый спектр излучения, полученный опытным путем.
- 26. Вопрос №3 Теория Бора для водородоподобных систем
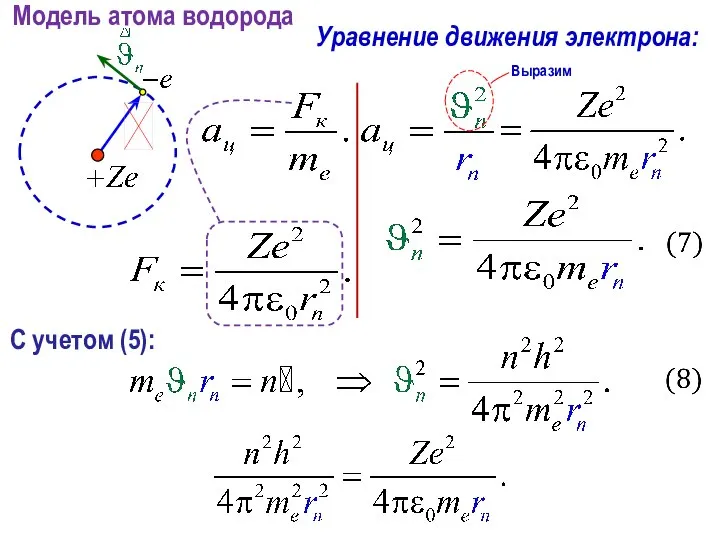
- 27. Модель атома водорода Уравнение движения электрона: С учетом (5):
- 28. Для атома водорода (Z=1) (первый Боровский радиус):
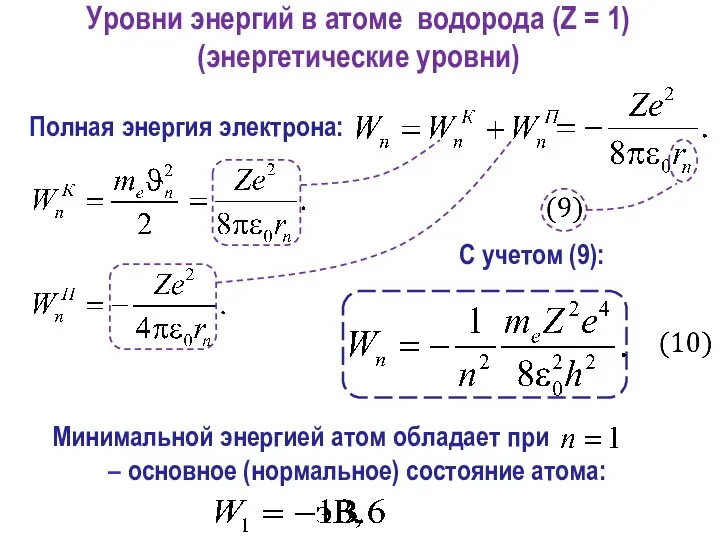
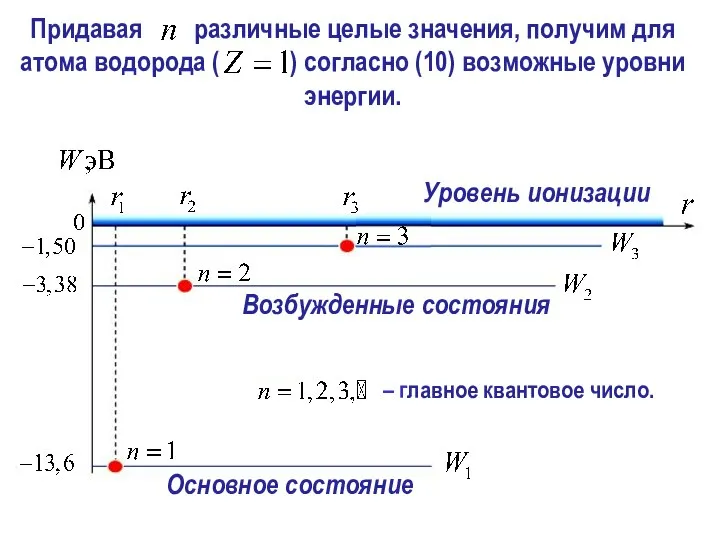
- 29. Полная энергия электрона: Уровни энергий в атоме водорода (Z = 1) (энергетические уровни) С учетом (9):
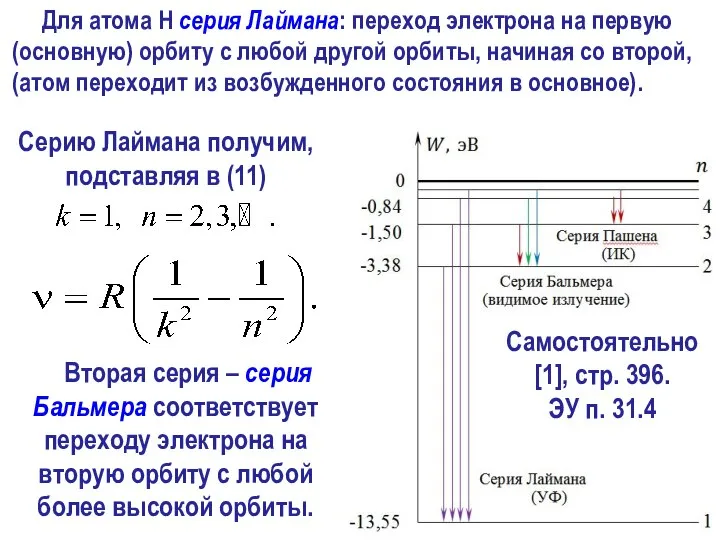
- 31. Спектральные серии Обобщенная формула Бальмера постоянная Ридберга. Выражение (11) соответствует эмпирической формуле (2).
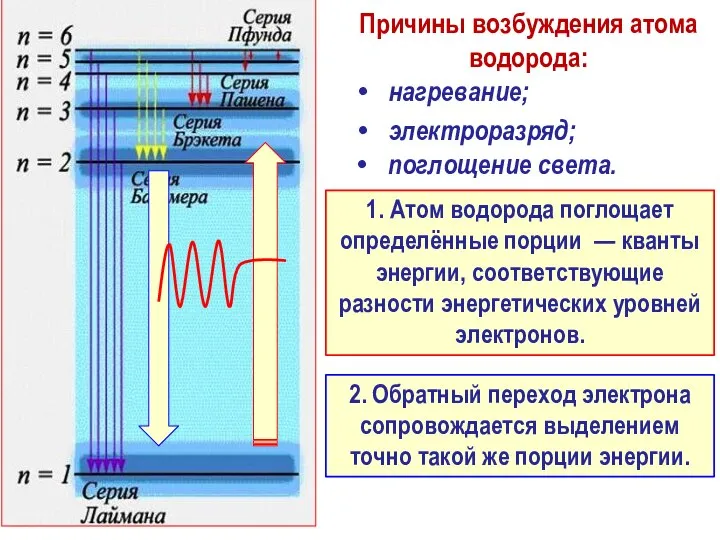
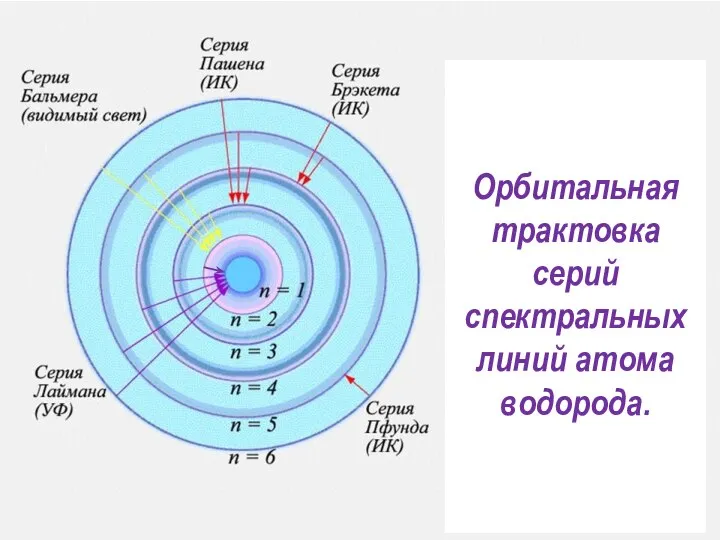
- 32. Физическая трактовка серий спектральных линий для атома водорода, наблюдаемых экспериментально
- 33. Причины возбуждения атома водорода: 1. Атом водорода поглощает определённые порции — кванты энергии, соответствующие разности энергетических
- 34. Вторая серия – серия Бальмера соответствует переходу электрона на вторую орбиту с любой более высокой орбиты.
- 36. Теория Бора объясняет наличие линейчатых спектров. 1. Каждая спектральная линия – результат перехода электрона из одного
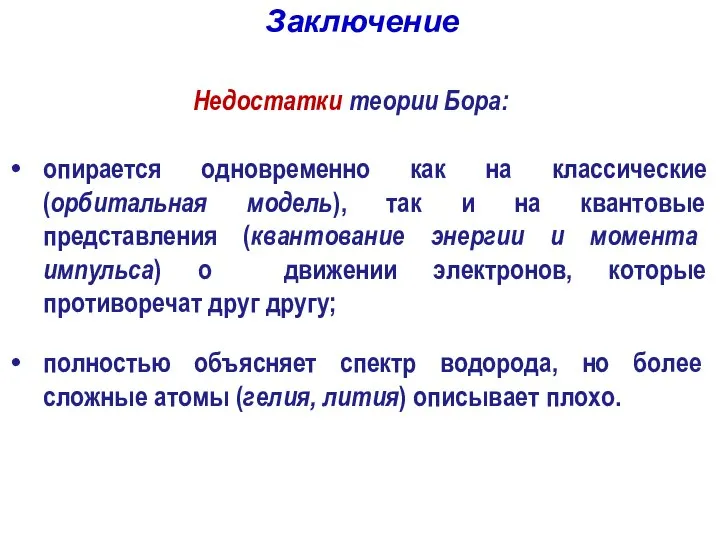
- 37. Недостатки теории Бора: опирается одновременно как на классические (орбитальная модель), так и на квантовые представления (квантование
- 38. явилась переходным звеном между классической физикой и современной квантовой механикой; Достоинства теории Бора: впервые введено понятие
- 39. Задание на самоподготовку Повторить тему лекции с использованием конспекта и рекомендованной литературы. Ответить на контрольные вопросы
- 41. Скачать презентацию




















 Тест по теме Радио
Тест по теме Радио Ньютон. Совершенны ли законы Ньютона?
Ньютон. Совершенны ли законы Ньютона? Сборка регулировка и испытание рулевого управления авто
Сборка регулировка и испытание рулевого управления авто Физика со смешариками
Физика со смешариками Упругие волны
Упругие волны Ophthalmic and Physiological Optics, Volume
Ophthalmic and Physiological Optics, Volume Вспомогательные системы дизеля (занятие 3)
Вспомогательные системы дизеля (занятие 3) Исследование физико-химических процессов получения порошковых покрытий газоплазменным методом
Исследование физико-химических процессов получения порошковых покрытий газоплазменным методом Проектирование зоны ТО-2 для парка автомобилей Volvo FM 6730
Проектирование зоны ТО-2 для парка автомобилей Volvo FM 6730 Оптические МЭМС. Актуаторы для оптических МЭМС-микрозеркала. Технология DLP
Оптические МЭМС. Актуаторы для оптических МЭМС-микрозеркала. Технология DLP Инфракрасное излучение. Характеристики и воздействие на человека. Источники излучения. Защита
Инфракрасное излучение. Характеристики и воздействие на человека. Источники излучения. Защита Электрический генератор
Электрический генератор Неньютоновская жидкость
Неньютоновская жидкость Основное уравнение МКТ
Основное уравнение МКТ Презентация на тему Телевизор
Презентация на тему Телевизор  Исследование равноускоренного движения с использованием электронного секундомера или компьютера с датчиками
Исследование равноускоренного движения с использованием электронного секундомера или компьютера с датчиками Прямолинейное равномерное движение. Скорость движения
Прямолинейное равномерное движение. Скорость движения Система питания дизельных двигателей
Система питания дизельных двигателей Работа, мощность и энергия. Задачи
Работа, мощность и энергия. Задачи Принцип работы профилемеров
Принцип работы профилемеров Сопротивление материалов
Сопротивление материалов Конвекция Подготовил ученик 8 «Б» класса МБОУ СОШ номер 15 Ахмаджонзода Артур Учитель: Гилевич О.Г.
Конвекция Подготовил ученик 8 «Б» класса МБОУ СОШ номер 15 Ахмаджонзода Артур Учитель: Гилевич О.Г. Ускорение
Ускорение Физика в космосе
Физика в космосе Термодинамические циклы. Расчет термодинамических циклов
Термодинамические циклы. Расчет термодинамических циклов Схема гідравлічна принципова. Билет 7
Схема гідравлічна принципова. Билет 7 Градуирование пружины и измерение сил динамометром
Градуирование пружины и измерение сил динамометром Биологическое действие радиоактивных излучений
Биологическое действие радиоактивных излучений