Содержание
- 2. ЦЕЛИ УРОКА: Цели урока: Формирование знаний о комплексных соединениях; Рассмотрение химических свойства комплексных соединений; Углубление знаний
- 3. Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию, как в кристаллическом виде, так
- 4. Швейцарский химик Альфред Вернер, лауреат Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал
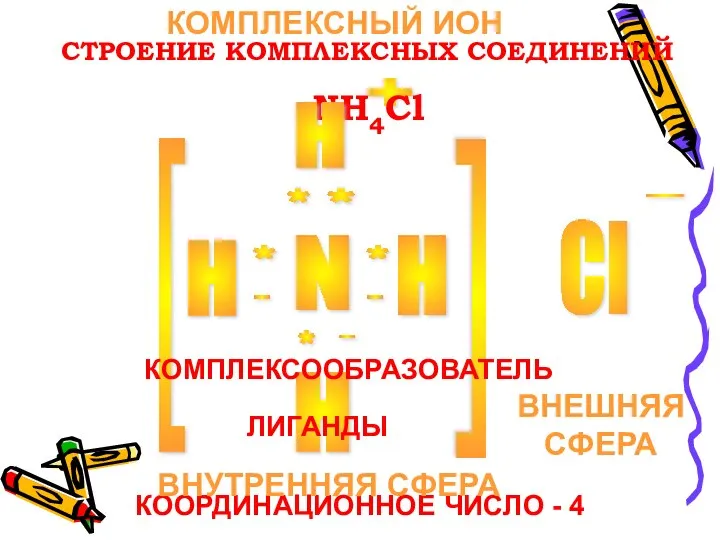
- 5. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N H H H Cl + - [ [ * * * *
- 6. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
- 7. Лигандами могут быть: а) полярные молекулы: NH3 H2O CO NO б) простые ионы CI- Br- I-
- 8. (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x
- 9. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 10. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ КАТИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au -
- 11. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
- 12. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 13. ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений. [Cu(NH3)4](OH)2. = [Cu(NH3)4]2++2ОН-. [Cu(NH3)4]2+ ↔ Cu2++ 4NH3
- 14. Химические свойства 2. Комплексные соединения взаимодействуют с оксидом углерода (IV): Na[AL(OH) 4] + CO2 = AL(OH)
- 15. Химические свойства 3. Комплексные соединения взаимодействуют с кислотами: [Cu(NH3)4]SO4 + BaCl2 = BaSO4 + [Cu(NH3)4]Cl2 FeCl3
- 16. Химические свойства 4. Комплексные соединения взаимодействуют с солями – реакции обмена: Na[AL(OH) 4] + ALCL3 =
- 17. Химические свойства 5 .Комплексные соединения вступают в окислительно-восстановительные реакции: K3[Fe3+(CN)6]3 + H2O2 + 2KOH = 2K4[Fe2+(CN)6]4
- 19. Скачать презентацию



![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-5.jpg)

![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-7.jpg)


![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-10.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-11.jpg)
2. = [Cu(NH3)4]2++2ОН-. [Cu(NH3)4]2+ ↔ Cu2++ 4NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-12.jpg)
![Химические свойства 2. Комплексные соединения взаимодействуют с оксидом углерода (IV): Na[AL(OH) 4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-13.jpg)
![Химические свойства 3. Комплексные соединения взаимодействуют с кислотами: [Cu(NH3)4]SO4 + BaCl2 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-14.jpg)

![Химические свойства 5 .Комплексные соединения вступают в окислительно-восстановительные реакции: K3[Fe3+(CN)6]3 + H2O2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1054365/slide-16.jpg)
 phpIyCLjh_ROSTOVY
phpIyCLjh_ROSTOVY Прабабушка Крикунова Лилия Степановна
Прабабушка Крикунова Лилия Степановна Тема семьи в романе Л. Н. Толстого Война и мир
Тема семьи в романе Л. Н. Толстого Война и мир Презентация на тему Державин
Презентация на тему Державин  Жизнь и творчество Константина Георгиевича Паустовского
Жизнь и творчество Константина Георгиевича Паустовского Художественные открытия Чехова
Художественные открытия Чехова Гончаров
Гончаров Презентация на тему Повторение литературы второй половины 19 века
Презентация на тему Повторение литературы второй половины 19 века  Всеволод Иванович Роборовский
Всеволод Иванович Роборовский Анатолий Приставкин Портрет отца
Анатолий Приставкин Портрет отца Н. В. Гоголь. Вечера на хуторе близ Диканьки…
Н. В. Гоголь. Вечера на хуторе близ Диканьки… Новый год на страницах Советской Печенги
Новый год на страницах Советской Печенги Ханс Кристиан Андерсен, сказка Снежная королева
Ханс Кристиан Андерсен, сказка Снежная королева Ойын-сайыс Абай
Ойын-сайыс Абай Гордость земли Тверской. Выдающиеся люди Тверского края
Гордость земли Тверской. Выдающиеся люди Тверского края Ксенофан Колофонский
Ксенофан Колофонский Знакомство со сказочными героями
Знакомство со сказочными героями Алексей Талай
Алексей Талай Иван Захарович Суриков Детство
Иван Захарович Суриков Детство Презентация на тему Александр Грин. Биография
Презентация на тему Александр Грин. Биография  Пословицы Владимира Даля
Пословицы Владимира Даля По праву памяти А.Т. Твардовский
По праву памяти А.Т. Твардовский Презентация на тему Дмитро Васильевич Павличко
Презентация на тему Дмитро Васильевич Павличко  Литература как вид искусства
Литература как вид искусства Край чудес и красоты. Книжная выставка
Край чудес и красоты. Книжная выставка Л.Н. Толстой Куда девается вода из моря? Текст - рассуждение
Л.Н. Толстой Куда девается вода из моря? Текст - рассуждение Фиксики. Компакт-диск. Текст по ролям
Фиксики. Компакт-диск. Текст по ролям Обыкновенное чудо – люди России. Иван Никитович Кожедуб
Обыкновенное чудо – люди России. Иван Никитович Кожедуб