Содержание
- 2. Непредельные углеводороды. Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи (>C=C Непредельными называются углеводороды, в
- 3. Непредельные углеводороды: Алкены. Алкадиены. Алкины.
- 4. Алкены Определение алкенов Изомерия Номенклатура Химические свойства Получение Применение Физические свойства Назад
- 5. Алкены ( олефины, этиленовые УВ) CnH2n, n>2 Алкены – это УВ, в молекулах которых два атома
- 6. Изомерия Для алкенов возможны 4 типа изомерии: Изомерия углеродной цепи Изомерия положения двойной связи Цис,- транс-
- 7. Номенклатура CnH2n ан -- ен или илен В качестве главной выбирают цепь, включающую двойную связь, даже
- 8. Физические свойства С2-С4 газы, С5-С16 жидкости, С>19 твердые, р Ткип.(н)>Tкип.(разв.) Ткип.(цис)>Tкип.(транс) Назад
- 9. Химические свойства Активны из-за наличия непрочной π- связи Характерны реакции присоединения Гидрирование( присоединение водорода) СН3-СН=СН2 +Н2→
- 10. Присоединение галогенводородов к несимметричным алкенам происходит по правилу В.В. Марковникова Правило Марковникова !!! При присоединении полярных
- 11. б) неполное( недостаток кислорода) C2H4 +2O2→2CO + 2H2O C2H4 + O2→2C +2H2O в)под действием окислителей типа
- 12. III.Реакции полимеризации. Процесс полимеризации алкенов открыт А.М.Бутлеровым. Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за
- 13. Исследования выдающегося русского химика Владимира Васильевича Марковникова явились блестящим подтверждением теории химического строения его учителя, А.М.
- 14. Реакция Вагнера. ! Реакцию окисления олефинов водным раствором перманганата калия открыл в 1888 г. русский химик
- 15. Получение алкенов. 1)Крекинг нефтепродуктов С16Н34 --- С8Н18 + С8Н16( t ) 2) Дегидрирование алканов ( де
- 16. 5) Дегидрогалогенирование моногалогеналканов (-HHal) действием твердой щелочи или ее спиртового раствора. Происходит по правилу Зайцева: СН3-СН2-С(СН3)Cl-CH3
- 17. Применение алкенов
- 18. Правило Зайцева Эта закономерность открыта в 1875 г. выдающимся русским химиком, учеником и тезкой А.М. Бутлерова
- 19. Алкены. Назовите по систематической номенклатуре: СН2=СН-С(СН3)2СН3 а) 3,3 –диметилбутен-2, б) 2-диметилбутен -3, в) 2,2- диметилбутен -3,
- 20. Домашнее задание. Цветков Хомченко № 20.1,20.2, 20.6(изомерия и номенклатура),2013,20.14,20.33,20.34. Журин А. Левина Л. с.31 № 52.
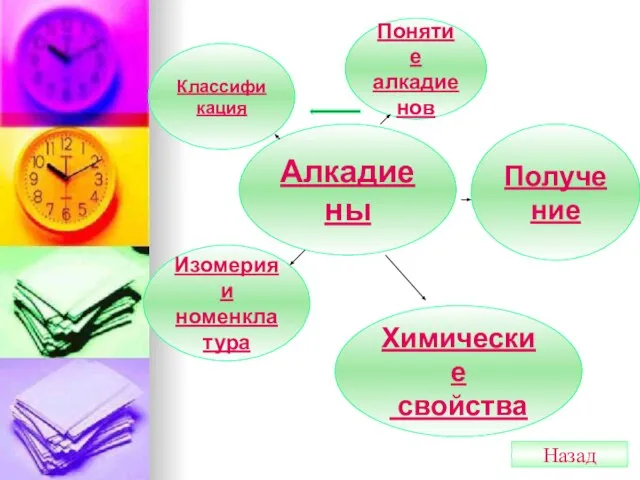
- 21. Алкадиены Понятие алкадиенов Классификация Изомерия и номенклатура Химические свойства Получение Назад
- 22. Диеновые углеводороды (алкадиены) Диеновые УВ (алкадиены) – это УВ, в молекулах которых между атомами углерода имеются
- 23. Классификация Диены с кумулированными связями Две двойные связи находятся у одного атома углерода СН2=С=СН2 пропадиен (аллен)
- 24. Изомерия и номенклатура 1)Структурная изомерия цепи СН3-СН=СН-СН=СН-СН3 гексадиен-2,4 СН3-СН=С(СН3)-СН=СН2 3 -метилпентадиен-1,3 2)Структурная изомерия взаимного положения двойных
- 25. Химические свойства 1) Реакции присоединения: а) галогенирование СН2=СН-СН=СН2+Br2(H2O)→CH2Br-CH=CH-CH2Br+ бутадиен-1,3 1,4-дибромбутен-2 + Br2(H20)→CH2Br-CHBr-CHBr-CH2Br 1,2,3,4-тетрабромбутан Бромная вода обесцвечивается.
- 26. Получение алкадиенов 1)Каталитическое дегидрирование а) алканов СН3-СН2-СН2 –СН3 →СН2=СН-СН=СН2 +2Н2 (условия: Cr2O3/Al2O3,700) б)алкенов СН2=СН-СН2-СН3-→ СН2=СН-СН=СН2 +
- 27. В начале ХХ в. в связи с резким подорожанием натурального каучука возникла острая необходимость в разработке
- 28. Победителем оказалась группа химиков под руководством профессора Военно-медицинской академии г. Ленинграда Сергея Васильевича Лебедева. В качестве
- 29. Понятие о терпенах Каучук- не единственное природное производное изопрена. В природе существует множество углеводородов, структурными фрагментами
- 30. Эфирными маслами называют нерастворимые в воде маслообразные продукты, которые в отличие от жирных масел полностью испаряются
- 31. β-каротин содержит длинную цепочку сопряженных двойных связей. Такие фрагменты называют хромофорными группами. Подобные молекулы окрашивают в
- 32. Алкадиены 1. Укажите число - связей в молекуле 1,3- бутадиена: а) 8 б) 9 в) 7
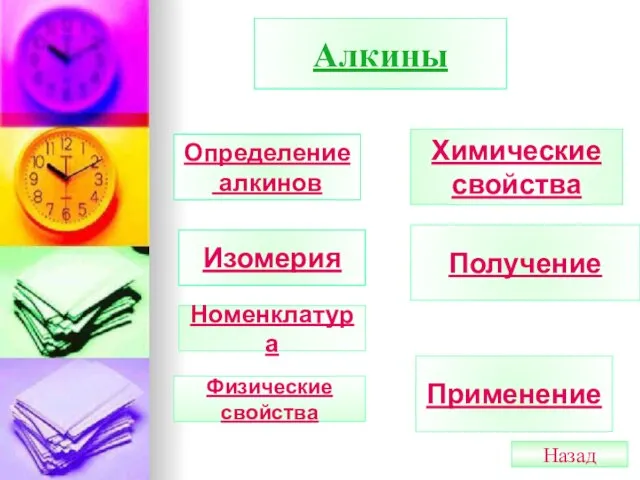
- 33. Алкины Определение алкинов Изомерия Номенклатура Химические свойства Получение Применение Физические свойства Назад
- 34. Алкины (ацетиленовые УВ) Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии
- 35. Изомерия Углеродного скелета с «С» >5 CНΞС-СН2-СН2-СН3 СНΞС-СН –СН3 бутин-1 СН3 3-метилбутин-1 Положения тройной (кратной) связи
- 36. Номенклатура АН → ИН Выбор главной цепи и начало нумерации определяется тройной связью Правила составления названий
- 37. Физические свойства С2-С4-газы, С5-С16-жидкости,С>17 твердые вещества, растворимость в воде небольшая, но больше чем у алкенов и
- 38. Химические свойства алкинов. Алкины во многих реакциях обладают большей реакционной способностью,чем алкены. Для алкинов,как и для
- 39. I.Реакции присоединения: 1.Присоединение водорода (гидрирование) На I ступени образуются алкены, на II cтупени- алканы: С 2
- 40. 3.Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются моногалогеналкены, на II –дигалогеналканы: С 2Н 2 + НCl
- 41. Реакция с KMnO4 является качественной реакцией на алкины. Раствор KMnO4 обесцвечивается.
- 42. Кислотные свойства ацетиленовых углеводородов. Атом водорода в ацетилене и его гомологах, содержащих тройную связь на конце
- 43. III. Реакции полимеризации. Очень длинные цепи молекулы ацетилена образуют с трудом, а вот несколько молекул (от
- 44. !!!В 1955г. Д. Натта с сотрудниками синтезировал полиацетилен, представлявший собой смесь цис-, трансизомеров: цис-полиацетилен, красного цвета,
- 45. Получение алкинов Пиролиз метана (метановый способ) .В 1868 г. М. Бертло, пропуская через метан электрический разряд,
- 46. Применение ацетилена
- 48. Скачать презентацию











































 Презентация на тему Что такое окружающий мир (1 класс)
Презентация на тему Что такое окружающий мир (1 класс)  Презентация на тему Земноводные (2 класс)
Презентация на тему Земноводные (2 класс)  Презентация на тему Первое путешествие в космос
Презентация на тему Первое путешествие в космос  Презентация на тему Есть ли жизнь в воде подо льдом
Презентация на тему Есть ли жизнь в воде подо льдом  Презентация на тему Расы и народы Земли
Презентация на тему Расы и народы Земли  Презентация на тему Мороженое
Презентация на тему Мороженое  Презентация на тему Иван III (4 класс)
Презентация на тему Иван III (4 класс)  Презентация на тему Страна городов: Древний Киев. Древний Новгород
Презентация на тему Страна городов: Древний Киев. Древний Новгород  Презентация на тему Топаз
Презентация на тему Топаз  Презентация на тему Привет, Весна!
Презентация на тему Привет, Весна!  Презентация на тему Водные богатства (2 класс)
Презентация на тему Водные богатства (2 класс)  Презентация на тему Спасибо прадедушке за победу!
Презентация на тему Спасибо прадедушке за победу!  Презентация на тему Жизнь и судьба наших верных четвероногих друзей
Презентация на тему Жизнь и судьба наших верных четвероногих друзей  Презентация на тему Надо ли охранять болота (3 класс)
Презентация на тему Надо ли охранять болота (3 класс)  Презентация на тему Туман и облака (3 класс)
Презентация на тему Туман и облака (3 класс)  Презентация на тему Наши соседи. Китай (3 класс)
Презентация на тему Наши соседи. Китай (3 класс)  Презентация на тему Горные породы (3 класс)
Презентация на тему Горные породы (3 класс)  Презентация на тему Угадайка
Презентация на тему Угадайка  Презентация на тему Весна (1 класс)
Презентация на тему Весна (1 класс)  Презентация на тему Зима в неживой природе (2 класс)
Презентация на тему Зима в неживой природе (2 класс)  Презентация на тему Первоцветы Крыма
Презентация на тему Первоцветы Крыма  Презентация на тему Правила вежливости (2 класс)
Презентация на тему Правила вежливости (2 класс)  Презентация на тему "Россия - Родина моя" 4 класс
Презентация на тему "Россия - Родина моя" 4 класс  Презентация на тему Ледяные пустыни
Презентация на тему Ледяные пустыни  Презентация на тему Древнерусская культура (3 класс)
Презентация на тему Древнерусская культура (3 класс)  Презентация на тему Живая и неживая природа
Презентация на тему Живая и неживая природа  Презентация на тему Дружба (4 класс)
Презентация на тему Дружба (4 класс)  Презентация на тему Короли, президенты и граждане (4 класс)
Презентация на тему Короли, президенты и граждане (4 класс)