Механизм образования, термическая устойчивость и термодинамические свойства катионоупорядоченныхперовскитоподобных слоистых
Содержание
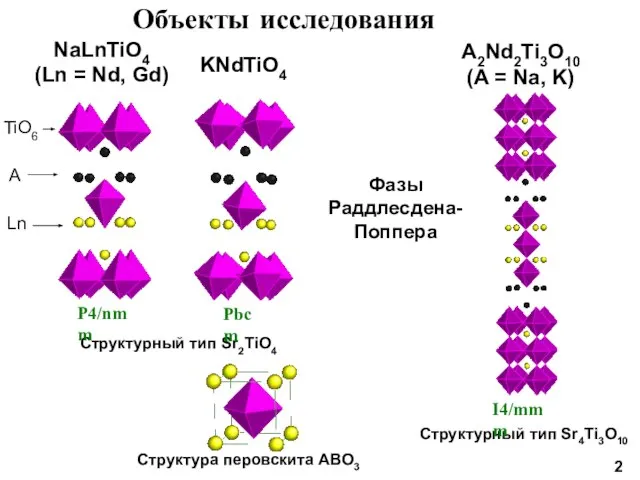
- 2. Объекты исследования NaLnTiO4 (Ln = Nd, Gd) Фазы Раддлесдена- Поппера Структурный тип Sr2TiO4 Структурный тип Sr4Ti3O10
- 3. Цель работы Изучение механизма формирования катионоупорядоченных перовскитоподобных слоистых титанатов, их термической устойчивости и определение термодинамических свойств.
- 4. Экспериментальные методы Синтез: Керамическая технология (NaNdTiO4 – 780°C 2ч; NaGdTiO4 – 850°C 4ч; Na2Nd2Ti3O10 – 1100°C
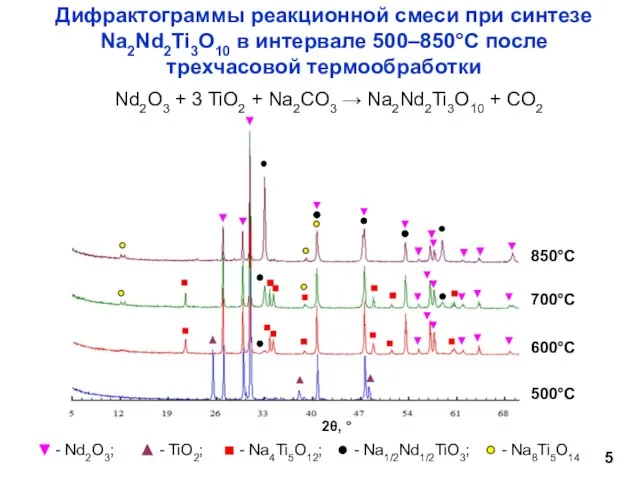
- 5. Nd2O3 + 3 TiO2 + Na2CO3 → Na2Nd2Ti3O10 + CO2 Дифрактограммы реакционной смеси при синтезе Na2Nd2Ti3O10
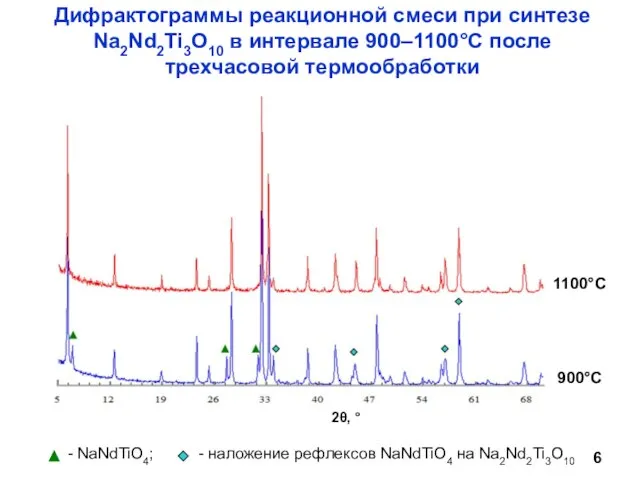
- 6. Дифрактограммы реакционной смеси при синтезе Na2Nd2Ti3O10 в интервале 900–1100°С после трехчасовой термообработки
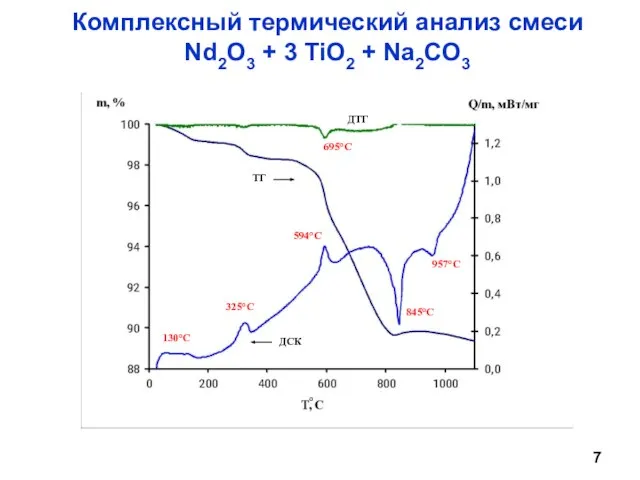
- 7. Комплексный термический анализ смеси Nd2O3 + 3 TiO2 + Na2CO3
- 8. Механизм образования Na2Nd2Ti3O10
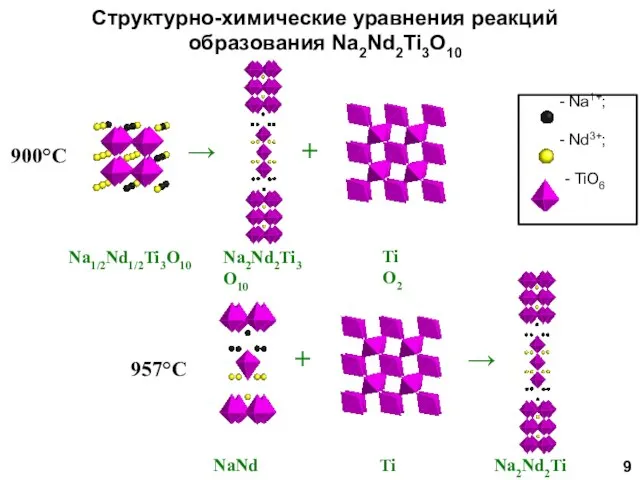
- 9. Структурно-химические уравнения реакций образования Na2Nd2Ti3O10 900°С 957°С
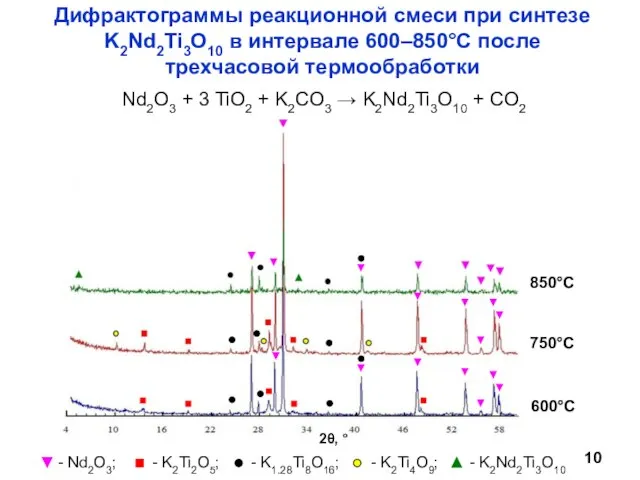
- 10. Nd2O3 + 3 TiO2 + K2CO3 → K2Nd2Ti3O10 + CO2 Дифрактограммы реакционной смеси при синтезе K2Nd2Ti3O10
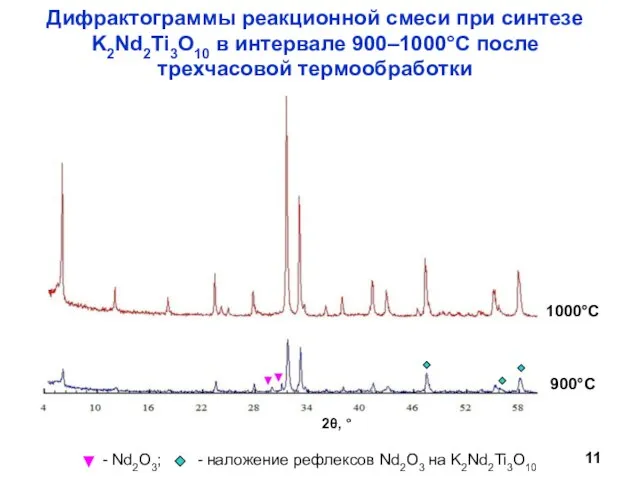
- 11. Дифрактограммы реакционной смеси при синтезе K2Nd2Ti3O10 в интервале 900–1000°С после трехчасовой термообработки
- 12. Механизм образования K2Nd2Ti3O10
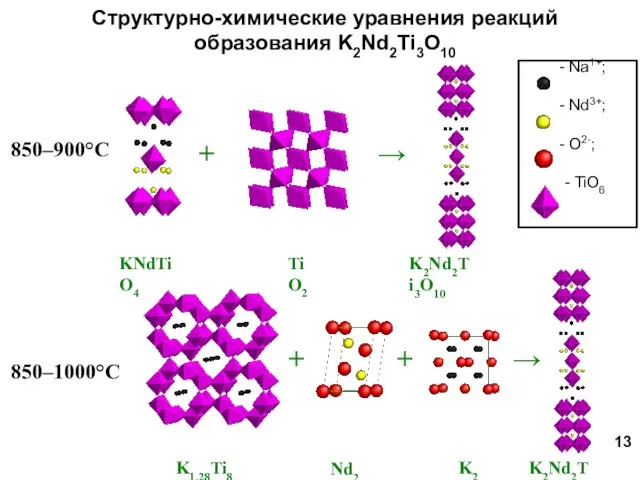
- 13. Структурно-химические уравнения реакций образования K2Nd2Ti3O10 850–900°С 850–1000°С
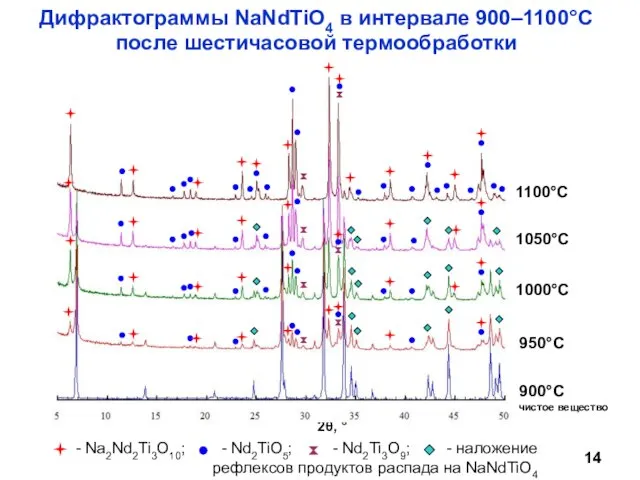
- 14. Дифрактограммы NaNdTiO4 в интервале 900–1100°С после шестичасовой термообработки чистое вещество
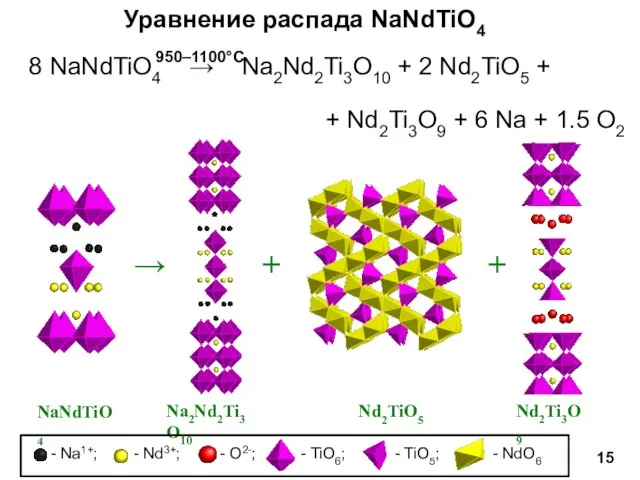
- 15. Уравнение распада NaNdTiO4 8 NaNdTiO4 → Na2Nd2Ti3O10 + 2 Nd2TiO5 + + Nd2Ti3O9 + 6 Na
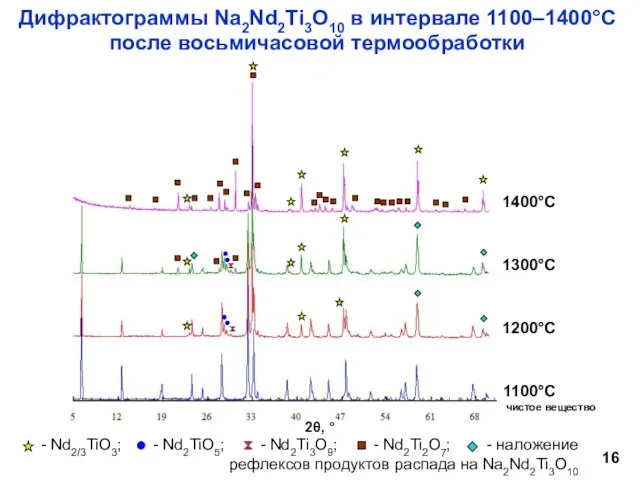
- 16. Дифрактограммы Na2Nd2Ti3O10 в интервале 1100–1400°С после восьмичасовой термообработки чистое вещество
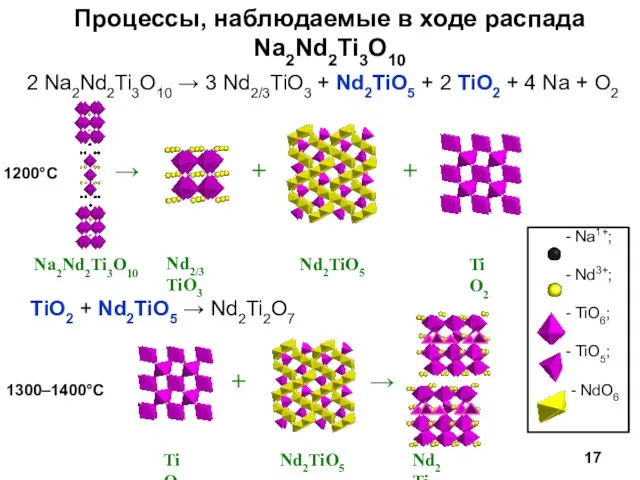
- 17. Процессы, наблюдаемые в ходе распада Na2Nd2Ti3O10 2 Na2Nd2Ti3O10 → 3 Nd2/3TiO3 + Nd2TiO5 + 2 TiO2
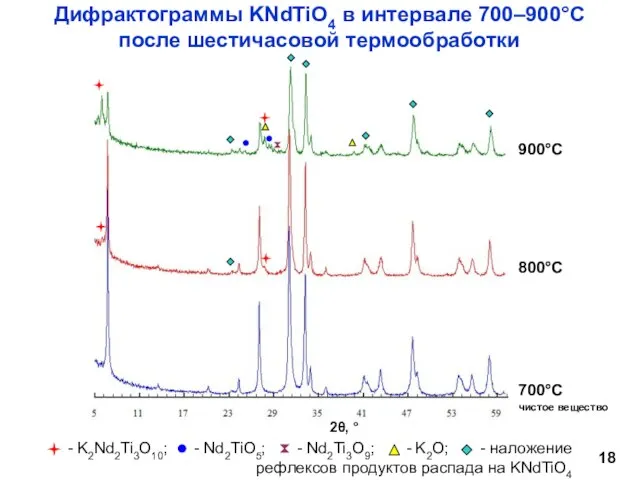
- 18. Дифрактограммы KNdTiO4 в интервале 700–900°С после шестичасовой термообработки чистое вещество
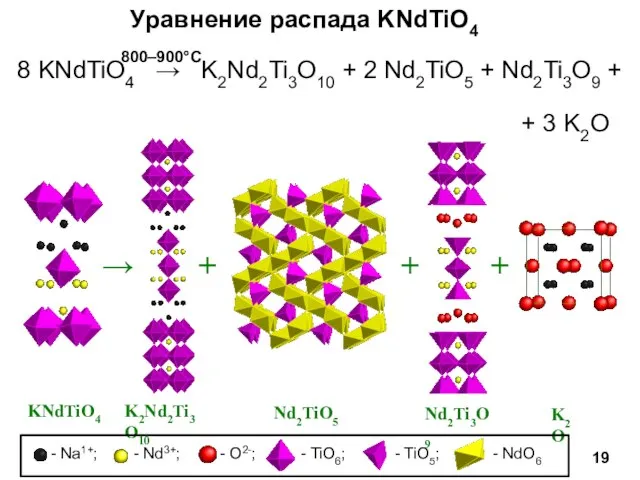
- 19. 8 KNdTiO4 → K2Nd2Ti3O10 + 2 Nd2TiO5 + Nd2Ti3O9 + + 3 K2O Уравнение распада KNdTiO4
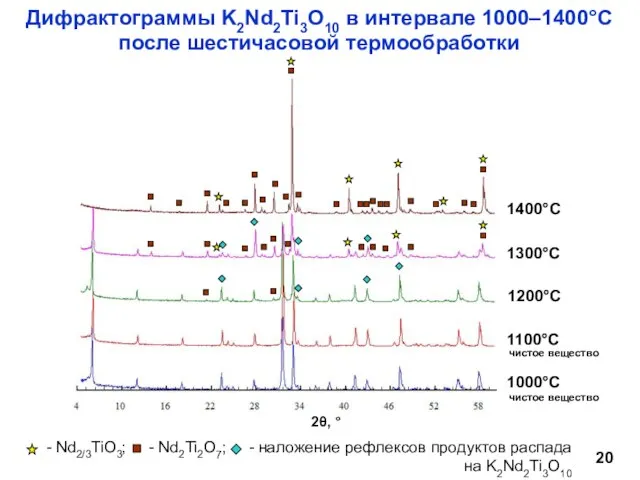
- 20. Дифрактограммы K2Nd2Ti3O10 в интервале 1000–1400°С после шестичасовой термообработки чистое вещество чистое вещество
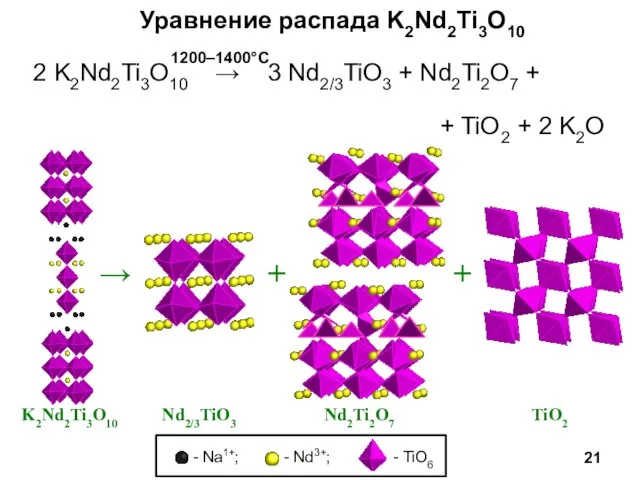
- 21. Уравнение распада K2Nd2Ti3O10 2 K2Nd2Ti3O10 → 3 Nd2/3TiO3 + Nd2Ti2O7 + + TiO2 + 2 K2O
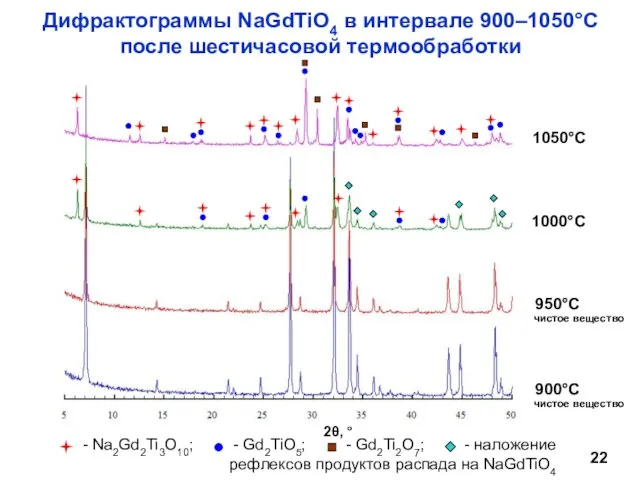
- 22. Дифрактограммы NaGdTiO4 в интервале 900–1050°С после шестичасовой термообработки чистое вещество чистое вещество
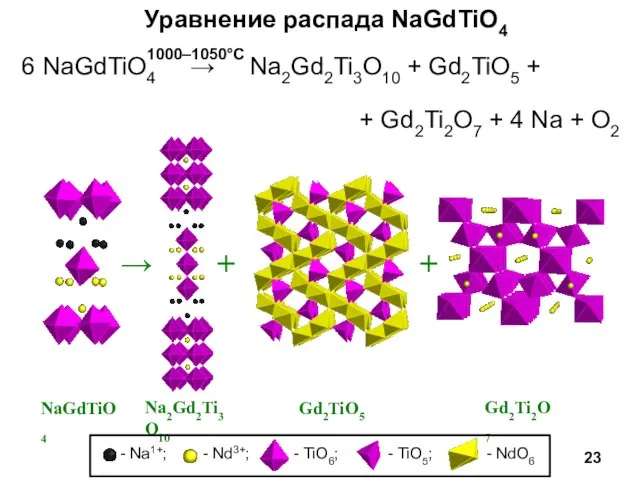
- 23. Уравнение распада NaGdTiO4 6 NaGdTiO4 → Na2Gd2Ti3O10 + Gd2TiO5 + + Gd2Ti2O7 + 4 Na +
- 24. Микроскопия поверхности образцов NaNdTiO4 и Na2Nd2Ti3O10 NaNdTiO4 исходный NaNdTiO4 разложившийся Na2Nd2Ti3O10 исходный Na2Nd2Ti3O10 разложившийся
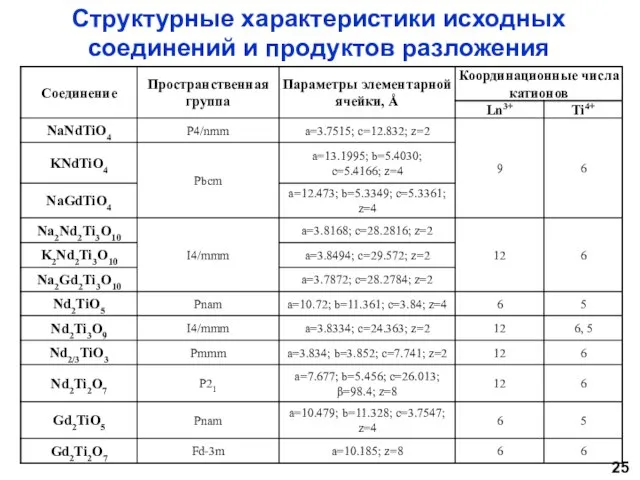
- 25. Структурные характеристики исходных соединений и продуктов разложения
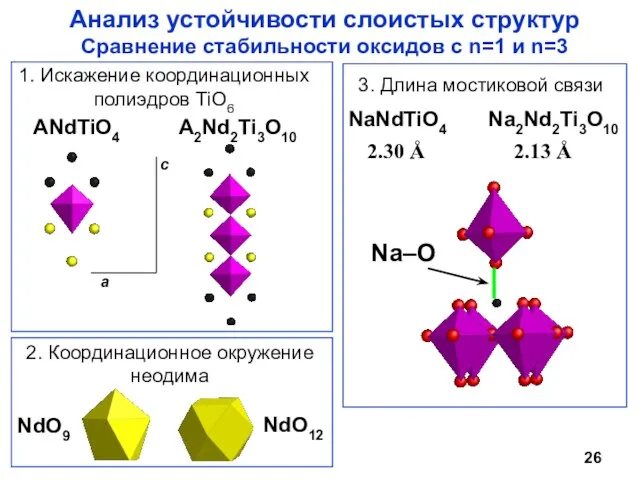
- 26. Анализ устойчивости слоистых структур Сравнение стабильности оксидов с n=1 и n=3
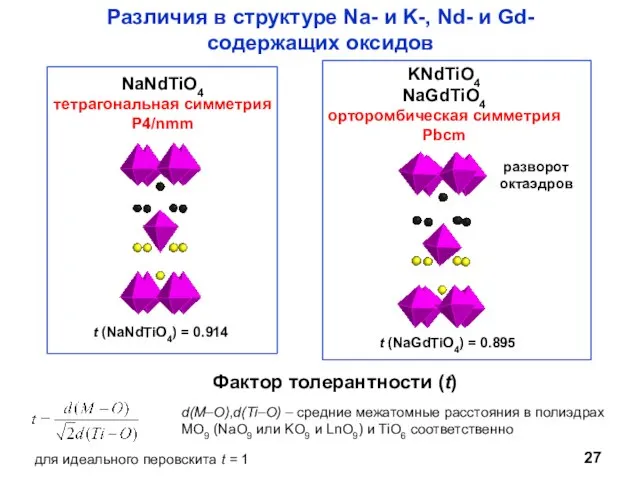
- 27. Различия в структуре Na- и K-, Nd- и Gd-содержащих оксидов d(M–O),d(Ti–O) – средние межатомные расстояния в
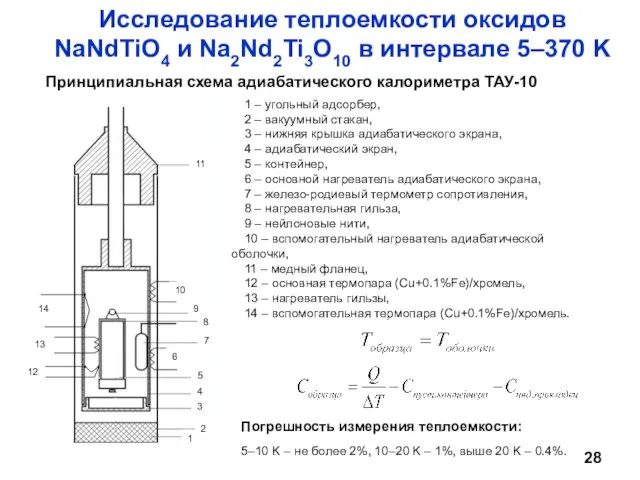
- 28. Исследование теплоемкости оксидов NaNdTiO4 и Na2Nd2Ti3O10 в интервале 5–370 K 1 – угольный адсорбер, 2 –
- 29. Обработка данных калориметрических измерений D – функция Дебая с тремя степенями свободы ϑD – характеристическая температура
- 30. Расчет термодинамических функций в интервале 5–370 K
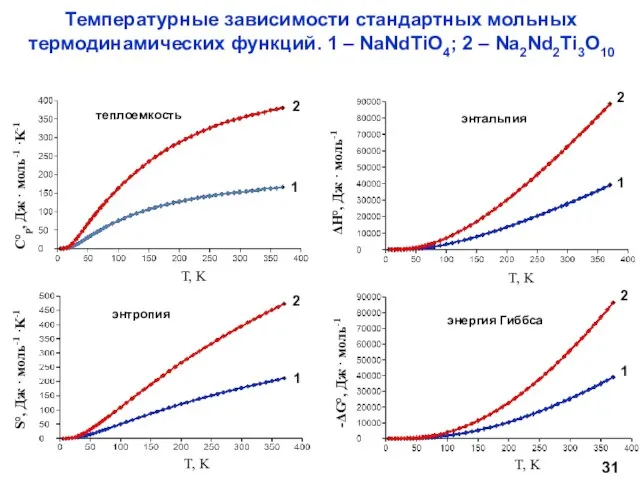
- 31. Температурные зависимости стандартных мольных термодинамических функций. 1 – NaNdTiO4; 2 – Na2Nd2Ti3O10 теплоемкость энтальпия энергия Гиббса
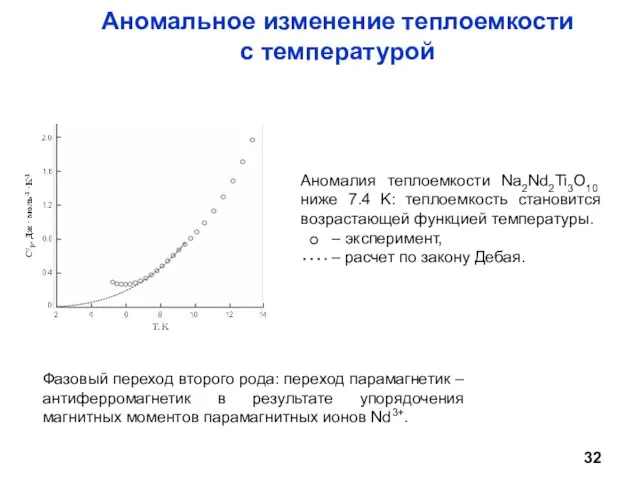
- 32. Аномальное изменение теплоемкости с температурой Фазовый переход второго рода: переход парамагнетик – антиферромагнетик в результате упорядочения
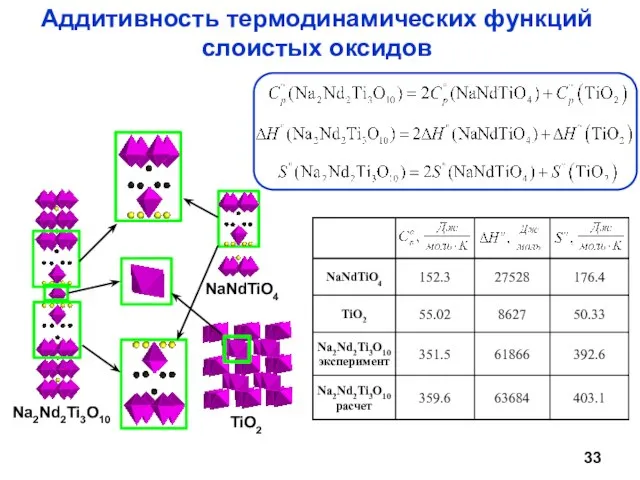
- 33. Аддитивность термодинамических функций слоистых оксидов
- 35. Скачать презентацию







 Ералы аяжан мулть (1)
Ералы аяжан мулть (1) KING OF COLD
KING OF COLD На мирных просторах России Сыны её верные спят. И мы никогда не забудемСтрану защитивших солдат.
На мирных просторах России Сыны её верные спят. И мы никогда не забудемСтрану защитивших солдат. Классификация складов
Классификация складов Водоросли 6 класс
Водоросли 6 класс ТИПОЛОГИЯ ПРЕСС-МЕРОПРИЯТИЙ
ТИПОЛОГИЯ ПРЕСС-МЕРОПРИЯТИЙ Муниципальное казенное дошкольное образовательное учреждение Тогучинского района Зареченский детский сад «Родничок»
Муниципальное казенное дошкольное образовательное учреждение Тогучинского района Зареченский детский сад «Родничок» Презентация на тему Геополитическое и экономико-географическое положение России (ЭГП)
Презентация на тему Геополитическое и экономико-географическое положение России (ЭГП)  Праздники ислама
Праздники ислама Презентация на тему Природные тела и явления Окружающий мир 2 класс
Презентация на тему Природные тела и явления Окружающий мир 2 класс Сибирское здоровье. Бизнес-план аптеки
Сибирское здоровье. Бизнес-план аптеки Картина - особый мир
Картина - особый мир Князь Владимир на картинах художников
Князь Владимир на картинах художников Ch1-LinEquations
Ch1-LinEquations Презентация на тему Особенности накопления капитала в форме ценных бумаг
Презентация на тему Особенности накопления капитала в форме ценных бумаг  Союз Фотографов Республики Татарстан
Союз Фотографов Республики Татарстан Изготовление уникальной конструкции Бутерброда
Изготовление уникальной конструкции Бутерброда Проверка домашнего задания
Проверка домашнего задания Советское государство и право. Государство и право современной Российской Федерации. Разделы 2-3
Советское государство и право. Государство и право современной Российской Федерации. Разделы 2-3 А.П Платонов «Никита»
А.П Платонов «Никита» Быстрый найм продавцов. Анкета для соискателей
Быстрый найм продавцов. Анкета для соискателей ООО СиЛа-Эксперт. Перечень услуг
ООО СиЛа-Эксперт. Перечень услуг Мой дедушка Паша
Мой дедушка Паша Я здесь учусь, и мне это нравится!. Зубово-полянский аграрный техникум
Я здесь учусь, и мне это нравится!. Зубово-полянский аграрный техникум Презентация на тему Правовое положение населения в Древнем Риме
Презентация на тему Правовое положение населения в Древнем Риме  Дух предпринимательства преобразует экономику
Дух предпринимательства преобразует экономику Система эффективного сопровождения от новичка до полной самостоятельности
Система эффективного сопровождения от новичка до полной самостоятельности Секретарь онлайн-проектов
Секретарь онлайн-проектов