Содержание
- 2. Эксперименттерді орындау кезінде күтілетін нәтижелерге қол жеткізу әрдайым мүмкін бола бермейді. Бір затты бір химиялық ыдыста
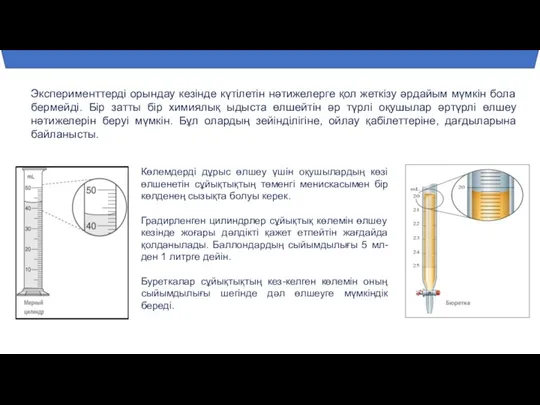
- 3. Зертханалық жабдықпен өлшеу кезіндегі қателік дәрежесі Өлшеу үшін аспаптардың екі түрі қолданылады. Сандық шкала - өлшемдер
- 4. Дене температурасының екі өлшемі дәрі-дәрмектерді енгізгенге дейін және енгізілгеннен кейін тіркелген 38.2°C и 38.4°C Бұл қолданылған
- 5. Кез-келген эксперимент төрт кезеңнен тұрады: Зертханалық жабдықты орнату. Тәжірибе жүргізу. Нәтижелерді талдау және оларды негіздеу Алынған
- 6. ХИМИЯ БОЙЫНША ЭКСПЕРИМЕНТТІК ЖҰМЫСТАРДЫҢ ЖАЛПЫЛАНҒАН АЛГОРИТМІ Жұмыстың атауын оқып, барлық түсініксіз терминдердің мағынасын біліңіз. Формулаларды шығаруға
- 7. Жылу әсерлерін анықтау бойынша практикалық жұмысқа байланысты бағдарламаны оқыту мақсаттары 8.3.1.3 экзотермиялық реакциялар жылу сіңірумен, ал
- 8. Жылу эффектілерін зерттеудің тұжырымдамалық тәсілі
- 9. Дж/г кал/г ккал/г Ақуыздар 17 000 4000 4 Майлар 38 000 9000 9 Көмірсулар 17 000
- 10. Al Al m = 20 г T = 20oC жүйесі Қоршаған орта m = 10 г
- 11. Су мен күмістің жылу берілісі әртүрлі. Судың жылу сыйымдылығы Cp = 4.184 Дж/гoC Күмістің жылу сыйымдылығы
- 12. Тепе-теңдік кезінде жүйенің соңғы температурасын анықтау
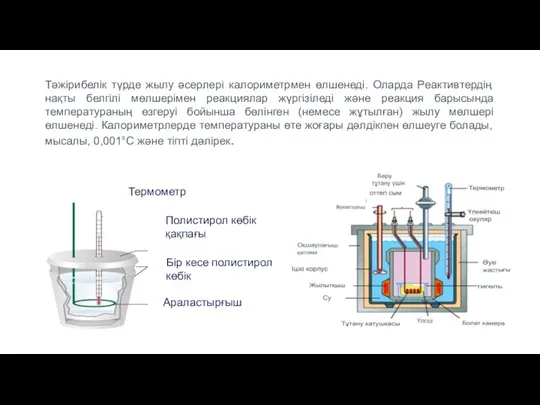
- 13. Тәжірибелік түрде жылу әсерлері калориметрмен өлшенеді. Оларда Реактивтердің нақты белгілі мөлшерімен реакциялар жүргізіледі және реакция барысында
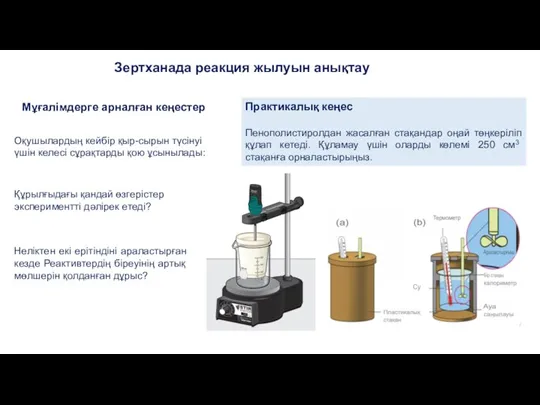
- 14. Мұғалімдерге арналған кеңестер Оқушылардың кейбір қыр-сырын түсінуі үшін келесі сұрақтарды қою ұсынылады: Құрылғыдағы қандай өзгерістер экспериментті
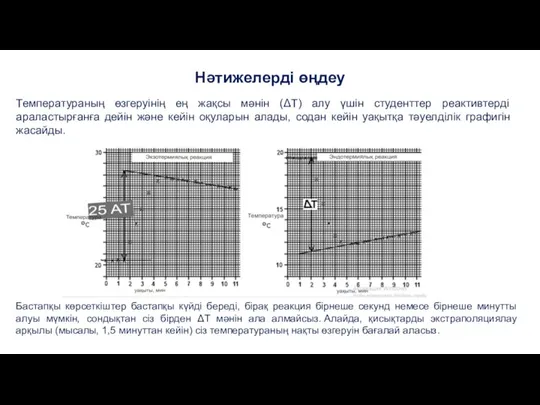
- 15. Нәтижелерді өңдеу Температураның өзгеруінің ең жақсы мәнін (ΔT) алу үшін студенттер реактивтерді араластырғанға дейін және кейін
- 16. Экспериментте қателіктердің мүмкін көздері қандай? Полистиролдың жылу оқшаулағыш материалынан жасалған контейнер мен қақпақты қолданғанына қарамастан, жылудың
- 17. Практикалық тапсырмалардың мысалдары Тапсырма 1 25,0°C температурада 0,025 моль HCl бар 25,0 мл ерітінді 0,025 моль
- 18. Оқу бағдарламасы бойынша оқыту мақсаттары: 7.2.2.2 сұйылтылған қышқылдардың әртүрлі металдармен реакциясын зерттеңіз және іс жүзінде сапалы
- 19. Оқу бағдарламасы бойынша оқыту мақсаттары : 11.2.1.25 сумен және аммиакпен кешендерді, оның ішінде мыс (+2) кешендерін,
- 20. Затты талдау үшін химиктер оны компоненттерге бөлді, яғни. сапалы талдау жүргізді, оның міндеттері : белгілі бір
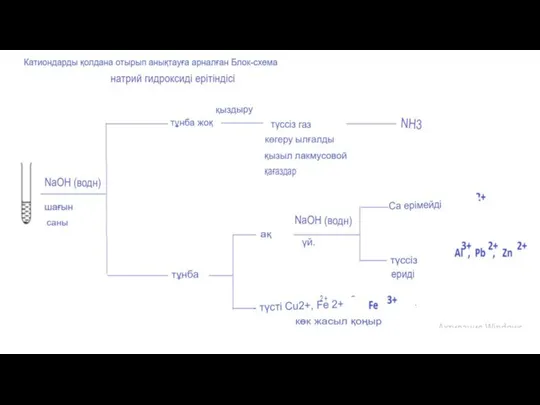
- 21. Катиондарды анықтаудың құрғақ әдісі – жалынды бояуға арналған тест Тестке элемент немесе қосылыс үлгісін нихром немесе
- 22. As - көк B - ашық жасыл Ba - сары-жасыл Ca - кірпіш қызыл Cs -
- 24. Оқушылар "түссіз" және "мөлдір"терминдерін ажырататындығына көз жеткізіңіз. Ерітінділер мөлдір болуы мүмкін және түсі болуы мүмкін, мысалы:
- 25. Оқушылар бақылауларды жазу үшін ғылыми терминологияны, мысалы, кілт сөздерді қолданатындығына көз жеткізіңіз Оқушыларға жүргізілген тәжірибелердің егжей-тегжейлі
- 27. Оқушыға мыс (II) хлориді мен алюминий нитраты қоспасының Сулы ерітіндісіне талдау жасалды. а. Оқушының ерітіндіде хлорид
- 28. Шешім 1 тапсырма 1а. Сұйылтылған азот қышқылын, содан кейін күміс нитратының сулы ерітіндісін қосыңыз. Ақ тұнба
- 30. Скачать презентацию






















 Публичный отчет
Публичный отчет Два положения 2-го закона термодинамики. Круговые процессы тепловых машин. 2. Термический КПД цикла. Холодильный коэффициент. 3. Прям
Два положения 2-го закона термодинамики. Круговые процессы тепловых машин. 2. Термический КПД цикла. Холодильный коэффициент. 3. Прям Мы помним
Мы помним Эмиграционные настроения: портрет потенциального эмигранта
Эмиграционные настроения: портрет потенциального эмигранта 85689
85689 Об итогах социально-экономического развития Красновишерского муниципального района Пермского края за 2010 г. и о перспективах разв
Об итогах социально-экономического развития Красновишерского муниципального района Пермского края за 2010 г. и о перспективах разв Право в системе социальных норм
Право в системе социальных норм Презентация на тему Ядовитые грибы
Презентация на тему Ядовитые грибы Лидерство в системе менеджмента.Тесты
Лидерство в системе менеджмента.Тесты ПРЕДЕЛЫ МИРОВОГО ЭКОНОМИЧЕСКОГО РОСТА И ПОТРЕБЛЕНИЯ
ПРЕДЕЛЫ МИРОВОГО ЭКОНОМИЧЕСКОГО РОСТА И ПОТРЕБЛЕНИЯ Презентация на тему Чудотворные иконы России
Презентация на тему Чудотворные иконы России РАЗРАБОТКА И ВНЕДРЕНИЕ АВТОМАТИЗИРОВАННОЙ СИСТЕМЫ АНАЛИЗА И ПРОГНОЗИРОВАНИЯ ПРОИЗВОДСТВЕННЫХ СИТУАЦИЙ ДОМЕННОГО ЦЕХА С ЦЕЛЬЮ ПО
РАЗРАБОТКА И ВНЕДРЕНИЕ АВТОМАТИЗИРОВАННОЙ СИСТЕМЫ АНАЛИЗА И ПРОГНОЗИРОВАНИЯ ПРОИЗВОДСТВЕННЫХ СИТУАЦИЙ ДОМЕННОГО ЦЕХА С ЦЕЛЬЮ ПО Дисциплина: Международные перевозки грузов Раздел 1. Основы организации международной перевозки грузов Тема 1.2. Логистические си
Дисциплина: Международные перевозки грузов Раздел 1. Основы организации международной перевозки грузов Тема 1.2. Логистические си Альтернатива. Мозговая атака. Метод выдвижения предложений. Групповой анализ ситуации
Альтернатива. Мозговая атака. Метод выдвижения предложений. Групповой анализ ситуации История шоколада
История шоколада Обеспечение покрытия рисков при наступлении несчастного случая или укусе клеща во время нахождении детей в летних лагерях
Обеспечение покрытия рисков при наступлении несчастного случая или укусе клеща во время нахождении детей в летних лагерях FutureToday
FutureToday Природа и архитектура. Организация архитектурно-ландшафтного пространства
Природа и архитектура. Организация архитектурно-ландшафтного пространства Подготовка к ВПР
Подготовка к ВПР Гимназия №8
Гимназия №8 Я – Успешный человек?
Я – Успешный человек? Методические рекомендации к преподаванию модуля Основы православной культуры в курсе «Основы религиозных культур и светской эти
Методические рекомендации к преподаванию модуля Основы православной культуры в курсе «Основы религиозных культур и светской эти Инновационный поиск учителя
Инновационный поиск учителя Презентация 18.10
Презентация 18.10 Цель кодирования
Цель кодирования Презентация на тему Электронные деньги
Презентация на тему Электронные деньги  Взаимодействие с правоохранительными органами по вопросам борьбы с подделкой
Взаимодействие с правоохранительными органами по вопросам борьбы с подделкой Презентация на тему Храм святой Софии в Стамбуле
Презентация на тему Храм святой Софии в Стамбуле