Слайд 2Тема и цели урока:
Тема: «Ацетилен. Алкины».
Цель урока:
Дать представления об углеводородах с

тройной связью. О их физико-химических свойствах и области применения.
Воспитательная цель:
Развитие умственных способностей у студентов.
Слайд 3Определение алкинов
Алкинами называются УГ в которых есть тройная связь и отвечающие формуле

CnH2n-2
где n ≥ 2.
Слайд 4
Электронное строение
C2H2 (этин) с электронной гибритизацией SP,с валентным углом между ними 120

градусов, гибридные облака образуют σ связи меджу атомами углерода и водорода, два остальных р-электрона образуют под углом относительно друг друга в 90 градусов две π связи по осям Y и Z. Расстояние между атомами С-С составляет 0,120 нм, между С-Н 0,106 нм.
Энергия образования тройной связи =
824 кДж/моль (σ- 355,5 кДж/моль,
π1-251,1 кДж/моль, π2-227,7 кДж/моль).
Слайд 5Номенклатура и Изомерия
CH≡CH Этин
CH≡C-CH3 Пропин
CH≡C-CH2-CH3 Бутин - 1
CH3-C ≡ C-CH2-CH3 Пентин -

2
CH≡C-CH2-CH-CH2-CH3
I 4-метил-гексин-1
CH3
Слайд 6Способы получения.
CaC2 + 2H2O → Ca(OH)2 + C2H2
Пиролиз 2CH4 → C2H2 +

3H2
Синтез 2С + 2H2 → C2H2
CH≡CH + NaNH2 → CH≡C−Na + NH3;
CH≡C−Na + CH3Cl → NaCl + CH≡C−CH3
CH3−CHBr2 + 2KOH(спирт) → CH≡CH + 2KBr+2H2O
Слайд 7Физические свойства.
УГ от C2H2 до C4H6 – это газы, с C5H8 по

C15H28 – это жидкости, с C16H30 –твёрдые вещества.
t кип, t пл, ρ увеличиваются с увеличением молярной массы. Этин, газ t кип – 83,8ºС.
Слайд 8Химические свойства.
Как и все непредельные УГ вступают в реакции присоединения:
CH≡CH +H2 →

CH2=CH2 + H2 → CH3−CH3
CH≡CH + Br2 → CHBr=CHBr + Br2 → CHBr2−CHBr2
CH≡CH + HI → CH2=CHI + HI → CH3−CHI2
Слайд 9Химические свойства
Реакция М.Г. Кучерова
CH≡CH + H2O → (CH2=CH−OH) → CH3−CH=O
Реакция Эльтекова
CH≡CH +

HCN → CH2=CH−C≡N акрилонитрил (CuCl и NH3)
2 CH≡CH → CH2=CH−C≡CH
винилацетилен (CuCl и H+)
Слайд 10Химические свойства
3 CH≡CH → C6H6
(активированный уголь и t 500)
4 CH≡CH →

(−CH=CH−)4
циклооктотетраен
CH≡CH + 2[Ag(NH3)2]OH → AgC≡CAg + 4NH3 + 2H2O
(ацетиленид Ag)
2 CH≡CH + 6KMnO4 → 4CO2 + 2H2O + 2H−COOH
(муравьиная кислота)









 Контрольний норматив. Тести і нормативи оцінки фізичної підготовленості студентів
Контрольний норматив. Тести і нормативи оцінки фізичної підготовленості студентів Inventions. Text provided by ukurcheev bogdan
Inventions. Text provided by ukurcheev bogdan Подходы к управлению
Подходы к управлению Колледж бодибилдеров
Колледж бодибилдеров Географические координаты
Географические координаты Презентация на тему Частушки
Презентация на тему Частушки СКАЗКА
СКАЗКА Проект «Первая помощь при переломах, вывихах и растяжении связок»
Проект «Первая помощь при переломах, вывихах и растяжении связок» Виртуальные машины
Виртуальные машины Презентация на тему "Формирование учебной мотивации у младших школьников" - скачать презентации по Педагогике
Презентация на тему "Формирование учебной мотивации у младших школьников" - скачать презентации по Педагогике Профессиональный клуб учителей
Профессиональный клуб учителей Сувенирная мастерская, 2 год обучения
Сувенирная мастерская, 2 год обучения БГТУ ВОЕНМЕХ им. Д.Ф. Устинова
БГТУ ВОЕНМЕХ им. Д.Ф. Устинова Пророки
Пророки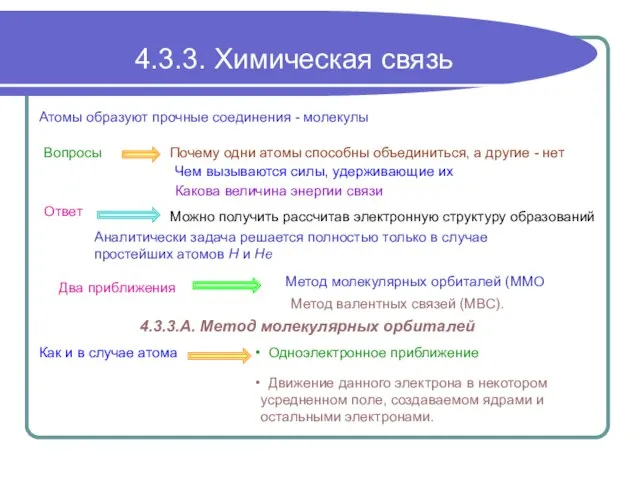 4.3.3. Химическая связь
4.3.3. Химическая связь Тема урока:Сделки и представительство.
Тема урока:Сделки и представительство. Мои пробабушка и продедушка
Мои пробабушка и продедушка Презентация на тему Изобразительное искусство классицизма и рококо
Презентация на тему Изобразительное искусство классицизма и рококо Проектирование блочной котельной
Проектирование блочной котельной Презентация на тему Характеристика стран ОПЕК
Презентация на тему Характеристика стран ОПЕК  Тренинг-семинар Твой характер – в твоих руках
Тренинг-семинар Твой характер – в твоих руках Мастер-класс Цветочное панно
Мастер-класс Цветочное панно Мастер-класс на тему: Мозаика из яичной скорлупы
Мастер-класс на тему: Мозаика из яичной скорлупы Соматоформды бұзылыстар
Соматоформды бұзылыстар Взаимодействие аллельных генов. Кодомирование
Взаимодействие аллельных генов. Кодомирование День Святого Валентина
День Святого Валентина IT-лицей Казанского федерального университета
IT-лицей Казанского федерального университета ПЕРИОДЫ ДЕТСКОГО ВОЗРАСТА. ЗНАЧЕНИЕ ГЕНЕТИЧЕСКИХ И НАСЛЕДСТВЕННЫХ факторов
ПЕРИОДЫ ДЕТСКОГО ВОЗРАСТА. ЗНАЧЕНИЕ ГЕНЕТИЧЕСКИХ И НАСЛЕДСТВЕННЫХ факторов