Содержание
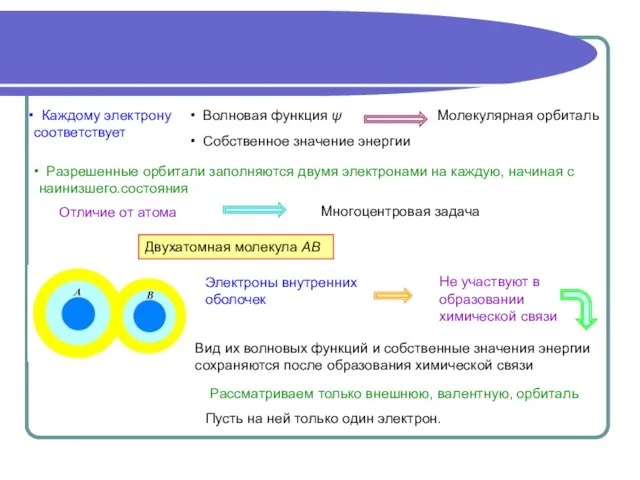
- 2. Разрешенные орбитали заполняются двумя электронами на каждую, начиная с наинизшего.состояния Рассматриваем только внешнюю, валентную, орбиталь Пусть
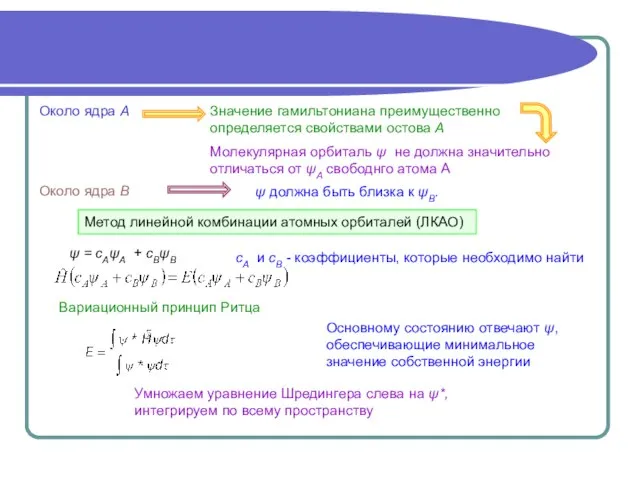
- 3. ψ должна быть близка к ψВ. Метод линейной комбинации атомных орбиталей (ЛКАО) ψ = сАψА +
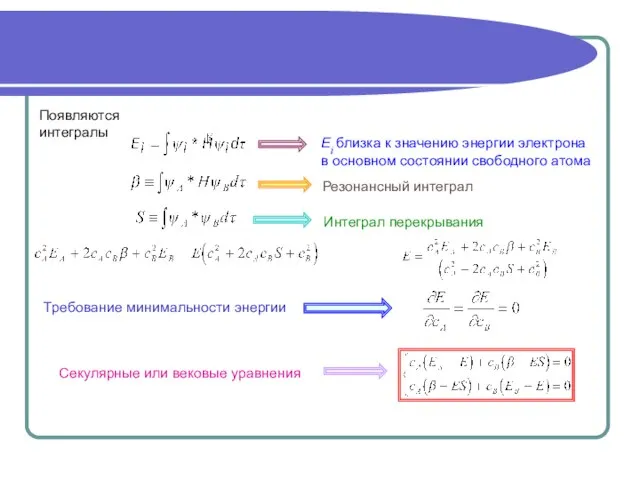
- 4. Появляются интегралы Ei близка к значению энергии электрона в основном состоянии свободного атома Резонансный интеграл Интеграл
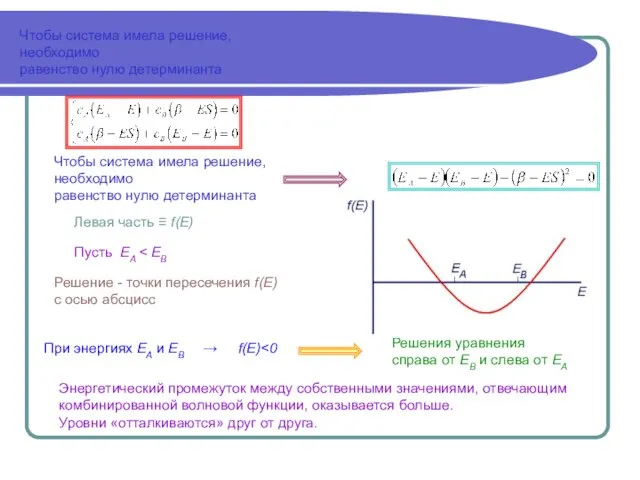
- 5. Чтобы система имела решение, необходимо равенство нулю детерминанта Чтобы система имела решение, необходимо равенство нулю детерминанта
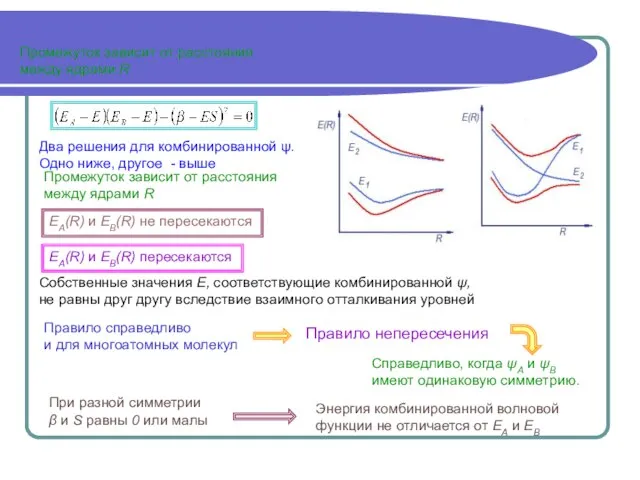
- 6. Промежуток зависит от расстояния между ядрами R Промежуток зависит от расстояния между ядрами R Собственные значения
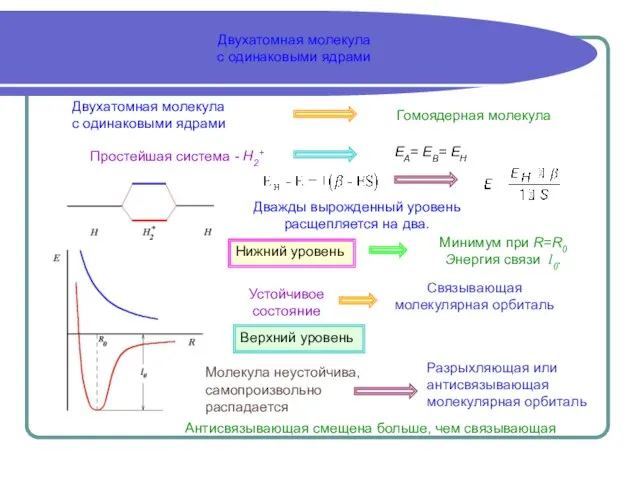
- 7. Двухатомная молекула с одинаковыми ядрами Двухатомная молекула с одинаковыми ядрами Гомоядерная молекула Простейшая система - Н2+
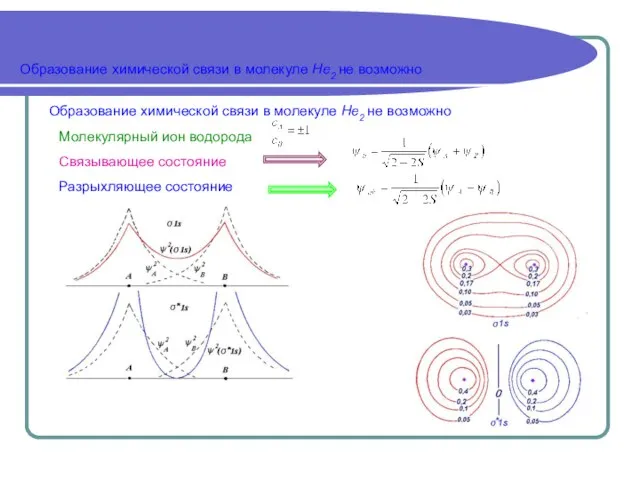
- 8. Образование химической связи в молекуле Не2 не возможно Образование химической связи в молекуле Не2 не возможно
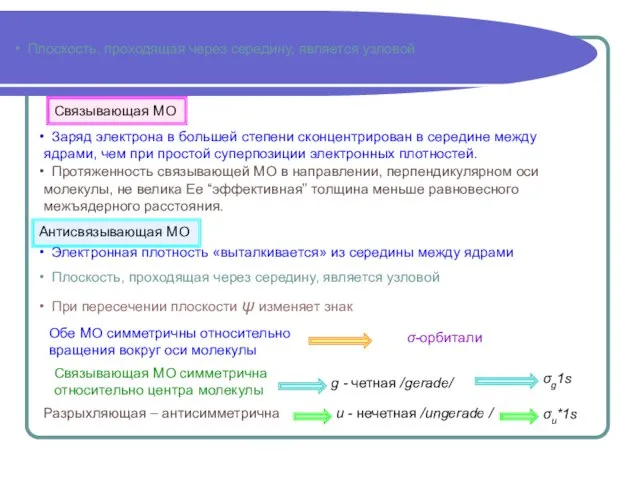
- 9. Плоскость, проходящая через середину, является узловой Плоскость, проходящая через середину, является узловой Связывающая МО симметрична относительно
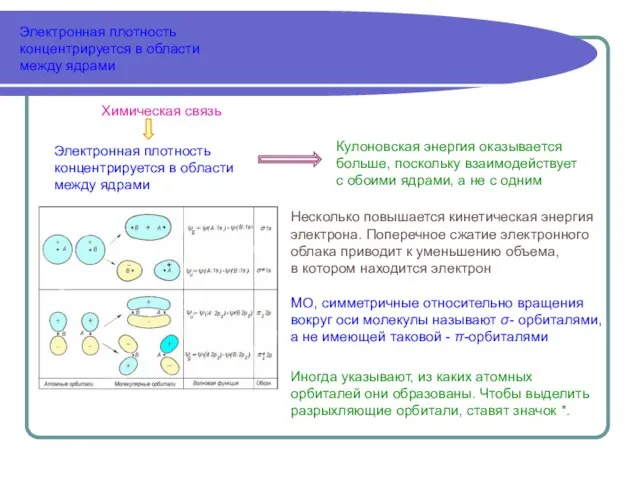
- 10. Электронная плотность концентрируется в области между ядрами Электронная плотность концентрируется в области между ядрами Кулоновская энергия
- 12. Скачать презентацию
 Федеральное государственное унитарное предприятие«Всероссийский научно-исследовательский институт расходометрии»ФГУП «ВНИ
Федеральное государственное унитарное предприятие«Всероссийский научно-исследовательский институт расходометрии»ФГУП «ВНИ Прокурорский надзор в сфере терроризма
Прокурорский надзор в сфере терроризма Развитие управленческих компетенций
Развитие управленческих компетенций Роль игрушки и игровых средств в центре игровой поддержки
Роль игрушки и игровых средств в центре игровой поддержки Важная биология в ИКТ
Важная биология в ИКТ Газовые разряды
Газовые разряды 11-я ежегодная конференция РАМУ«Рынок маркетинговых услуг.Новые: времена, дыхание, вызовы, тренды»
11-я ежегодная конференция РАМУ«Рынок маркетинговых услуг.Новые: времена, дыхание, вызовы, тренды» Кодирование информации в компьютере
Кодирование информации в компьютере Путешествие по Лингвинии
Путешествие по Лингвинии Растениеводство. Агрохимия
Растениеводство. Агрохимия Анатомия и морфология растений
Анатомия и морфология растений ЭФФЕКТИВНОЕ ПРОВЕДЕНИЕ ТЕНДЕРОВ: УРОКИ И ВОЗМОЖНОСТИ
ЭФФЕКТИВНОЕ ПРОВЕДЕНИЕ ТЕНДЕРОВ: УРОКИ И ВОЗМОЖНОСТИ Ребусы
Ребусы Презентация на тему АЛЕКСАНДР ИСАЕВИЧ СОЛЖЕНИЦЫН 1918-2008
Презентация на тему АЛЕКСАНДР ИСАЕВИЧ СОЛЖЕНИЦЫН 1918-2008  Порядок приемки электровоза
Порядок приемки электровоза Токсическое действие соединений ртути на животных и человека
Токсическое действие соединений ртути на животных и человека Мышление дошкольника
Мышление дошкольника Тело человека Скелет .Мышцы
Тело человека Скелет .Мышцы Силы. Вес тела. Законы Ньютона
Силы. Вес тела. Законы Ньютона Презентация на тему С Днем Победы!!!
Презентация на тему С Днем Победы!!! Пешеходный туризм. Часть 2 ( треккинг)
Пешеходный туризм. Часть 2 ( треккинг) Кризи, кризові ситуації, можливості виходу з кризи
Кризи, кризові ситуації, можливості виходу з кризи Компания «RAURA» представляет швейцарскую натуральную косметику COLOSE
Компания «RAURA» представляет швейцарскую натуральную косметику COLOSE Презентация на тему Математический марафон
Презентация на тему Математический марафон Приказки на Граматиката
Приказки на Граматиката Получение научного знания в объекте и предмете исследования. Задачи в курсовой работе
Получение научного знания в объекте и предмете исследования. Задачи в курсовой работе Пудалова Елена Игоревна Руководитель направления Департамента управления персоналом ОАО «Объединенная авиастроительная корп
Пудалова Елена Игоревна Руководитель направления Департамента управления персоналом ОАО «Объединенная авиастроительная корп Интегрированный исследовательский проект Тема: «Курение – дань моде, привычка, болезнь». Выполнили учащиеся 7 – 11классов
Интегрированный исследовательский проект Тема: «Курение – дань моде, привычка, болезнь». Выполнили учащиеся 7 – 11классов